
лекции павловского / Лекции по биоорганической химии (2011 г
.).pdf
Реакции бимолекулярного элиминирования Е2
Если условия неблагоприятны для протекания реакции по механизму бимолекулярного нуклеофильного замещения, то можно ожидать, что основность нуклеофила, как донора пары электронов, определит направление реакции между субстратом и атакующей нуклеофильной частицей. В случаях, когда стерические препятствия затрудняют атаку нуклеофильной частицей атома углерода, нуклеофильная частица действует как основание и атакует С-Н кислотный центр в молекуле субстрата. Конечным итогом этой атаки на атом водорода будет -элиминирование.
Общая схема механизма реакций Е2:
|
R1 |
|
|
|
R1 |
|
R1 |
|
Y- |
|
|
|
Y- |
|
|
||
+ CH3 C |
Z |
H CH2 |
C Z |
HY + H C C + Z- |
||||
|
|
|
|
|
|
|
|
2 |
|
R2 |
|
|
|
R2 |
|
R2 |
|
|
|
|
|
|
|
|||
Реакции Е2 протекают через образование переходного состояния, в котором участвуют две частицы, при этом синхронно происходит образование -связи Y-H и -связи С=С и разрыв -связей Н С и С Z. Скорость реакции зависит как от концентрации субстрата, так и от концентрации реагента. В качестве примера рассмотрим взаимодействие изопропилбромида и этоксида (этилата)натрия:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SN2 |
CH3 |
|
|
|
|
CH |
|
|
OC2H5 + NaBr |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20% |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
CH3 |
|
CH2 |
|
O Na |
+ CH |
|
CH |
|
CH |
|
|
|
|
|
CH |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
3 |
|
|
3 |
|
|
|
|
|
3 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
CH |
|
|
CH |
|
|
CH |
+ NaBr + |
C H OH |
80% |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
2 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E2 |
|
|
|
|
|
|
|
|
|
|
|
2 |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
71
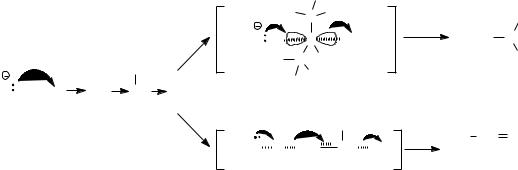
В молекуле субстрата вторичный атом углерода, связанный с двумя метильными группами, труднодоступен для нуклеофильной атаки этоксид-ионом, вследствие чего в результате реакции только 20% 2- бромпропана превращаются в 2-этоксипропан, являющийся продуктом реакции бимолекулярного нуклеофильного замещения. Более доступным для атаки этоксид-ионом является атом водорода в - положении к уходящей группе (СН-кислотный центр):
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
C |
|
H |
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
H5C2O |
|
|
|
C |
|
Br |
|
C2H5O CH + Br- |
||||
|
|
|
|
SN2 |
|
|
|
|
|
|
|||||||
|
|
|
CH3 |
|
|
|
|
H |
|
C |
|
H |
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
||
H5C2O |
|
|
|
|
|
|
H |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
+ H CH2 |
CH Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E2 |
|
|
|
|
|
|
|
CH3 |
|
|
CH3 |
CH CH2 |
|
|
|
|
|
H C |
O- |
CH |
|
CH |
|
Br |
|||||||
|
|
|
|
|
H |
|
2 |
|
|
|
|||||||
|
|
|
|
|
5 |
2 |
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br- + |
C2H5OH |
Этоксид-ион, атакуя атом водорода, выступает уже в качестве основания, так как предоставляет свою пару электронов для образования связи не атому углерода, а атому водорода. По мере образования связи О-Н синхронно происходит гетеролитический разрыв связи С-Н, высвобождающаяся пара электронов идет на образование - связи между атомами углерода, что приводит к гетеролитическому разрыву связи С-Br и отщеплению иона брома.
Направление элиминирования. Правило Зайцева
При взаимодействии галогеналканов, содержащих различные типы-водородных атомов, может образовываться несколько продуктов элиминирования. О преимущественном образовании одного из них говорит правило Зайцева: если в соединении все -водородные атомы
72

не могут стать одинаково доступными, то образующийся в результате элиминирования алкен содержит при двойной связи наибольшее число заместителей.
|
|
|
|
|
|
C2H5ONa |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
CH3 |
|
CH2 |
|
|
CH |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
_ |
NaBr |
CH3 |
|
CH |
|
CH |
|
CH3 + CH3 |
|
CH2 |
|
CH |
|
CH2 |
||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|||||||||||||||||||
|
|
|
|
Br |
|
|
|
81% |
|
|
|
19% |
|
|
||||||||
|
|
|
|
|
|
|
C2H5OH |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Реакции мономолекулярного элиминирования Е1
Реакциям мономолекулярного нуклеофильного замещения SN1 часто сопутствуют реакции мономолекулярного элиминирования Е1, что обусловлено наличием общей лимитирующей стадии – образование карбкатиона:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ Nu- |
CH3 |
|
|
CH |
|
|
|
CH3 |
SN1 |
CH3 |
|
|
CH |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
CH |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
_ Z- |
|
|
|
|
|
|
Nu |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
Z |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
_ H+ |
CH3 |
CH |
|
|
CH2 |
E1 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Алкилгалогениды, протонированные спирты и другие субстраты могут ионизироваться, образуя карбкатионы, которые затем, соединясь с нуклеофилом, завершают последовательность стадий SN1. Выход продукта в этих реакциях зачастую оказывается невысоким, основными побочными продуктами являются алкены.
Рассмотрим механизм элиминирования Е1 на примере катализируемой кислотами дегидратации спиртов:
CH3 |
|
CH2 |
|
|
CH |
|
CH3 |
H2SO4 |
H C |
|
CH |
|
CH |
|
CH |
+ CH |
|
CH |
|
CH |
|
CH |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
_ H O |
3 |
|
|
|
|
3 |
3 |
2 |
2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
73

На первом этапе происходит протонирование атома кислорода гидроксильной группы, приводящее к превращению её в хорошо уходящую группу. Отщепление воды от оксониевого катиона приводит к образованию карбкатиона, который стабилизируется путем отщепления протона от возникающих СН-кислотных центров. В итоге реакции получится смесь двух алкенов, в которой будет преобладать более стабильный алкен, содержащий при двойной связи большее число заместителей.
|
|
|
|
|
|
|
|
|
|
H+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
CH2 |
|
CH |
|
CH3 |
CH |
|
|
CH |
|
|
|
|
CH |
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
3 |
2 |
|
|
|
3 |
_ H O |
CH3 |
|
CH2 |
|
CH |
CH3 |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
OH2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
CH3 |
CH CH |
CH2 |
H |
_ H+ |
|
H3C |
|
CH |
|
CH |
|
CH3 |
+ CH3 |
|
|
CH2 |
|
|
CH |
|
CH2 |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
H
Таким образом, дегидратация спиртов протекает согласно правилу Зайцева, которое можно сформулировать и в таком виде: при дегидрогалогенировании несимметричных галогеналканов и дегидратации несимметричных спиртов атом водорода преимущественно отщепляется от менее гидрогенизированного атома углерода.
74

ЛЕКЦИЯ № 6
Реакции нуклеофильного присоединения (АN) к карбонильным соединениям. Окисление и восстановление органических
соединений
Карбонильные соединения являются производными углеводородов, в молекулах которых два атома водорода, находившиеся при одном атоме углерода, замещены атомом кислорода. Получающаяся таким путем группа С=О называется карбонильной группой, или оксогруппой. Если карбонильная группа связана с одним водородным атомом и углеводородным радикалом (или с двумя атомами водорода), то такие соединения называют альдегидами, а группу – альдегидной, если карбонильная группа связана с двумя углеводородными радикалами, соединения называют кетонами, а группу
– кетогруппой. Таким образом, альдегиды и кетоны представляют собой один класс органических веществ – оксосоединения.
R C O |
R C O |
''' |
''+ |
'+ |
|
O |
основный центр |
CH+3 |
CH2 |
CH |
C |
|
электрофильный центр |
||
H |
R1 |
|
|
|
|
H |
|
|
|
H |
|
С-Н кислотный центр |
|||
|
|
|
|
|
|
альдегидная кетогруппа группа
Атомные орбитали углерода карбонильной группы находятся в состоянии sp2-гибридизации. Три гибридные орбитали, расположенные в одной плоскости под углом 120 друг по отношению к другу, участвуют в образовании трех -связей. Негибридная р-орбиталь атома углерода, расположенная перпендикулярно плоскости, в которой лежат -связи, участвует в образовании -связи с атомом кислорода. Двойная связь
75

углерод-кислород полярная, электронная плотность смещена к более электроотрицательному атому кислорода, на котором возникает частичный отрицательный заряд, а на атоме углерода карбонильной группы – частичный положительный заряд:
|
|
|
С O |
C O |
электронное и пространственное строение оксогруппы
Из этого следует, что характерной для карбонильной группы реакцией должна быть нуклеофильная атака по атому углерода. В молекулах карбонильных соединений, кроме электрофильного центра – атома углерода оксогруппы – есть и другие реакционные центры. Атом кислорода за счет неподеленной пары электронов выступает в реакциях как основный центр, реагируя с кислотами. Альдегиды и кетоны являются слабыми основаниями, концентрация протонированной формы карбонильного соединения достигает величин 0,1-1% только в 60–80% серной кислоте.
R C |
O |
H |
+ |
O H |
O H |
|
+ |
R C |
R C |
||||
|
||||||
|
|
|
|
|
||
|
H |
|
|
H |
H |
|
|
|
|
|
оксониевый катион |
карбкатион |
В результате присоединения протона за счет образования -связи О-Н возрастает электрофильность атома углерода оксогруппы и облегчается присоединение нуклеофильной частицы.
Карбонильные соединения, имеющие атомы водорода в - положении к оксогруппе, являются слабыми С-Н кислотами и способны под действием сильных оснований образовывать карбанион и енол:
76

|
|
O |
|
|
|
O |
O |
+ HB |
OH |
|
|
|
B |
|
|
R CH C |
R CH C |
R CH C |
|||
R CH |
C |
+ |
_ |
|
|
|
||||
|
|
|
|
|
|
|
|
|||
|
|
H |
|
HB |
H |
H |
|
H |
||
|
|
|
|
|||||||
H |
|
|
|
|
|
карбанион |
енолят-анион |
|
|
енол |
|
|
|
|
|
|
|
|
|||
Содержание енола в равновесной смеси составляет 10-2–10-6 %, однако этого количества достаточно, чтобы протекали реакции с участием енольной формы. В водных растворах в присутствии сильных оснований (рН 12) концентрация аниона может достигать порядка 10-1- 10-5% от неионизированного соединения. В спиртовых растворах алкоголятов концентрация образующегося аниона выше и составляет примерно 1-10%.
Поскольку положительный заряд на атоме углерода карбонильной группы обуславливает участие оксосоединений в реакциях АN, то введение в углеводородный радикал электронодонорных заместителей, уменьшающих величину этого заряда, приводит к снижению реакционной способности соединений. Увеличение размеров углеводородных радикалов, связанных с углеродом карбонильной группы, затрудняет нуклеофильную атаку за счет создания стерических препятствий.
|
O |
|
O |
O |
H C |
|
R C |
|
R C |
|
H |
|
H |
R |
уменьшение положительного заряда увеличение стерических препятствий уменьшение реакционной способности
77

Механизм нуклеофильного присоединения АN:
|
O |
|
R |
R |
E+ |
R |
|
||||||
E+ Nu- |
|
|||||
R C |
|
C Nu- E+ |
O C Nu |
|
EO C Nu |
|
|
R1 |
R |
R1 |
|
R1 |
|
|
|
|
1 |
|
|
|
Реакция протекает через переходное состояние (при написании механизмов реакций АN его обычно опускают), в котором синхронно идет образование -связи между нуклеофильной частицей и атомом углерода карбонильной группы и разрыв -связи углерод-кислород. Атака нуклеофильной частицей атома углерода происходит с обеих сторон от плоскости карбонильной группы. Образовавшийся алкоксид-анион далее подвергается электрофильной атаке. Большинство реакций, характерных для карбонильных соединений, протекают по механизму нуклеофильного присоединения (реакции присоединения воды, спиртов, тиолов, синильной кислоты, аминов и их производных, альдольная конденсация и другие).
Реакции присоединения воды
Низшие альдегиды и кетоны хорошо растворимы в воде, наряду с образованием межмолекулярных водородных связей возможно протекание реакции гидратации – присоединения воды к карбонильному соединению. Реакционная способность альдегидов и кетонов убывает с уменьшением величины частичного положительного заряда на атоме углерода карбонильной группы. Это подтверждается данными о степени гидратации альдегидов и кетонов: формальдегид гидратирован более чем на 99,9%, ацетальдегид – приблизительно на 58%, ацетон – практически не гидратирован. Продукты реакции неустойчивы,
78

существуют, как правило, только в растворе, при попытке выделить в свободном виде разлагаются на воду и карбонильное соединение.
H |
|
|
|
|
|
OH |
||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
C |
|
O + H2O |
|
H |
|
C |
|
OH |
||
|
||||||||||
|
|
|
|
|||||||
|
||||||||||
|
|
|
|
|
|
|
|
|
||
H |
|
|
|
|
|
|
|
|
||
|
|
|
H |
|
|
|||||
|
|
|
|
|
|
|
|
|||
Механизм реакции включает нуклеофильную атаку альдегида молекулой воды, что приводит к образованию биполярного иона, который далее превращается в нестойкий двухатомный спирт.
H |
|
|
H |
|
H |
H |
OH |
|
|
|
O H |
||||
C O |
+ H2O |
C |
H C O |
H |
C OH |
||
H |
|
|
H |
|
|||
|
|
H |
O |
H |
H |
||
|
|
|
|
||||
Гидратация кетонов возможна лишь в присутствии кислот или щелочей как катализаторов.
CH3 |
|
|
H |
+ |
или OH |
- |
|
|
|
OH |
||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CH3 |
C |
|
O + H2O |
|
|
|
CH3 |
|
C |
|
OH |
|||
|
|
|||||||||||||
|
|
|
|
|
|
|||||||||
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
CH3 |
|||||
|
|
|
|
|
|
|
|
|
|
|||||
Механизм реакции гидратации при кислотном катализе:
CH3 |
CH3 |
CH3 |
H2O CH3 |
OH |
CH3 |
OH |
|
C O + H+ |
C O H |
|
C O H |
2 |
|
||
|
C |
C |
+ H+ |
||||
CH3 |
CH3 |
CH3 |
CH |
||||
OH |
CH3 |
OH |
|||||
|
|
|
3 |
На первом этапе протон присоединяется к атому кислорода карбонильной группы (за счет неподеленной пары электронов кислорода) с образованием оксониевого катиона, который на следующем этапе превращается в карбкатион, легко (за счет целого положительного заряда на углероде) подвергающийся нуклеофильной атаке молекулой воды. Образующийся оксониевый катион стабилизируется отщеплением протона (возврат катализатора).
79

Механизм реакции гидратации при основном катализе:
CH3 |
|
|
|
CH |
O |
|
H2O CH3 |
|
|||
|
3 |
|
OH |
||||||||
|
|
||||||||||
CH3 |
C |
|
O + OH- |
|
C |
|
|
|
|
C |
+ OH- |
|
|
|
|
|
|||||||
|
|
|
|
||||||||
|
|
|
|
|
|||||||
|
|
|
|
|
|
||||||
|
|
|
|
CH |
OH |
|
CH |
OH |
|||
|
|
|
|
3 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
3 |
|
|
При проведении гидратации в щелочной среде гидроксид-ион атакует электрофильный атом углерода карбонильной группы с образованием оксониевого аниона, который далее стабилизируется путем отщепления протона от молекулы воды.
В отличие от большинства карбонильных соединений, 2,2,2- трихлорэтаналь (хлораль) легко реагирует с водой, образуя устойчивый продукт гидратации – хлоральгидрат, используемый в медицине и ветеринарии как успокаивающее и снотворное средство. Повышенная реакционная способность этого соединения объясняется сильным электроноакцепторным эффектом трихлорметильной группы, которая увеличивает эффективный положительный заряд на атоме углерода карбонильной группы, а также стабилизирует продукт реакции.
Cl |
O |
Cl |
OH |
|
|||
Cl C C |
+ H O |
Cl C |
C OH |
|
2 |
||
Cl |
H |
Cl |
H |
|
|||
|
|
|
Реакции присоединения спиртов
В присутствии сухого хлороводорода альдегиды реагируют со спиртами, образуя ацетали. Промежуточно образующиеся полуацетали в большинстве случае в свободном виде выделить не представляется возможным. Необходимо отметить, что превращение полуацеталей в ацетали без кислотных катализаторов не происходит.
80
