
Термодинамика
.pdfвідбулася, вихідні речовини необхідно випаровувати, вони реагують як гази при р = const.
Тут витрачається теплота Qвип і робота Lвип , а після випаровування відбувається реакція з тепловим ефектом Qр2 , роботою Lр . Після цього кінцеві газоподібні продукти реакції конденсуються при р = const, здійснюється робота Lконд і віднімається теплота Qконд.
Залежність від температури
Тепловий ефект реакції при температурі t2, якщо він відомий для температури t1, можна визначити за формулою
|
Qt2 |
|
|
|
|
|
= |
|
|
|
Qt1 |
|
+ |
|||||
Σn( |
|
t 2 |
−Σn/ ( |
|
t 2 |
]t |
|
−Σn( |
|
t1 |
−Σn/ ( |
|
t1 |
]t |
|
|||
|
µc/ ) |
|
µc ) |
(145) |
||||||||||||||
µc) |
2 |
µc) |
||||||||||||||||
|
0 |
0 |
|
0 |
0 |
1 |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
де µс – середня мольна теплоємність речовин, що беруть участь в хімічній реакції.
http://tbk.at.ua |
51 |
Кафедра ТБВіМ |
|
2.4 Термодинаміка рівноважного стану
2.4.1. Параметри
При хімічних реакціях кількість хімічного впливу dZ дорівнює добутку хімічного потенціалу µ не елементарну зміну маси реагуючої речовини dm:
dz = µdm |
(146) |
у випадку термічного впливу кількість тепла dQ дорівнює dQ = TdS,
а для механічних процесів
dL = pdV.
Закон збереження і перетворення енергії можна записати як зростання внутрішньої енергії системи від всіх впливів:
dU = dQ − dL + dZ +...
або через параметри стану
dU =TdS − pdV + µdm +...
Тепловміст складає
dH = dU + pdV
Або після інтегрування
H =U + pV .
При p = const (умова для більшості процесів в твердій фазі)
Qp |
= H2 − H1 або H2 − H1 = ∫TT12 CpdT |
(147) |
Для |
більшості твердих речовин і газів |
Ср = f (T) |
відповідає функції
Cp = a +bT +CT 2 , або
(148)
Сp = a +bT +CT −2
Тоді для температур Т1 і Т2
|
∆Н1 − ∆Н2 |
= ∫ТТ 2 ∆СрdT |
(149) |
|
де |
∆H1, ∆H2 - теплові |
ефекти |
даної ізотермічної реакції |
|
( ∆H |
- це різниця |
між |
сумою |
тепловмісту речовин, які |
вступають в реакцію).
http://tbk.at.ua |
52 |
Кафедра ТБВіМ |
|

якщо dU = dQ + dZ − dL , а dQ =TdS , |
dL = pdV , |
dZ = µdm , |
|
то dU =TdS + µdm − pdV . При p = const dU + pdV = dH ;
але dH =TdS + µdm , тоді |
|
∆H =T∆S + ∆Z (2–й закон термодинаміки) |
(150) |
Ізобарно-ізотермічний потенціал є характеристичною
функцією при незмінних р , Т: |
|
|
|
||
|
∂Z |
=V , |
|
∂Z |
= −S , |
|
|
|
|
||
|
|
|
∂T P |
|
|
|
∂p T |
|
|
||
тобто об’єм системи є мірою зростання термодинамічного потенціалу із зростанням тиску при T = const, а ентропія мірою зменшення термодинамічного потенціалу із зростанням температури при p = const.
Крім dS ≤ 0 рівновага може мати й інші визначення в плані взаємодії системи із оточуючим середовищем, наприклад
dZ ≤ 0 (T , V = const), dZ ≤ 0 (T , р = const)’.
Здатність різних речовин до взаємодії з утворенням нових продуктів має назву хімічної спорідненості.
Вант-Гофф запропонував як міру хімічної спорідненості використати максимальну роботу хімічних сил, тобто зміну вільної енергії F (при V = const) або зміну потенціалу Z (при p = const).
Для ідеальних розчинів і газів
µ³ = µ³î + RT ln pi
Хімічна спорідненість визначається через функції F, Z, µ, вона не залежить від вихідного і кінцевого стану.Знак функції визначає направлення реакції, а величина – величину константи рівноваги. Якщо позначити вихідні концентрації або вихідні тиски всіх речовин, що беруть участь в реакції, рівними одиниці, то
http://tbk.at.ua |
53 |
Кафедра ТБВіМ |
|
Lop = −∆Z o = RT ln K p |
(151) |
||
Lo |
= −∆F o = RT ln K |
|
|
V |
|
||
V |
|
|
|
Ці рівняння характеризують ступінь віддаленості процесу від стану рівноваги. Якісне направлення процесу можна передбачити за принципом Ле-Шательє, згідно якому будьяка фізико-хімічна система, що перебуває в рівновазі, намагається зберегти її та на будь-який вплив зовні відповідає виникненням процесів в середині системи, які намагаються ліквідувати цей вплив.
Тепловий ефект хімічної реакції можна визначити із двох констант для двох температур:
d ln K = − |
Q |
|
dT |
(152) |
|
RT |
2 |
||||
|
|
|
Враховуючи, що тепловий ефект реакції залежить від
температури, рівняння ізохори має вигляд |
|
|
|
||||||||
ln K = |
Q0 |
+ ∆a lnT + |
|
∆b |
T + |
∆c |
T −2 |
+... + y |
(153) |
||
RT |
|
|
|||||||||
|
R |
|
2R |
2R |
|
|
|
|
|||
або рівняння Габера |
|
|
|
|
|
|
|
|
|
||
L = Q + ∆aT lnT + ∆b T 2 + |
∆c T −1 + R |
y |
T |
(154) |
|||||||
0 |
|
2 |
|
2 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
Враховуючи, що Q(T) ≈ L(T) при Т = О0К, також незначну |
|||||||||||
різницю між Lр і Lv, рівняння Габера спрощується: |
|
||||||||||
L = RT ln K =Q +∆aT lnT + ∆b T 2 + ∆c T −1 |
(155) |
||||||||||
|
|
0 |
|
|
|
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Строго кажучи, рівняння, (139) є коректним для температур, близьких О0К, але ним можна скористатися і в області більш високих температур за умов, що криві Q = f(T), L = f(T) не мають розривів і перегинань до температури поліморфних перетворень і плавлення.
Постулат Планка сформульований у вигляді
lim S = 0 або SO0K = 0 ,
T →0
http://tbk.at.ua |
54 |
Кафедра ТБВіМ |
|
стверджує, що поблизу абсолютного нуля ентропія правильно утвореного чистого кристалу дорівнює нулю, а в будь якому іншому стані речовини її ентропія більше нуля.
Це означає, що:
1.Властивості конденсованих систем U, H, F, Z, Cp, Cv та ін. поблизу абсолютного нуля перестають залежати від температури;
2.Ще не доходячи до Т = 0, система перейде в такий стан, що досягти абсолютного нуля стає принципово неможливим.
Хімічна рівновага
Для хімічної реакції bB + cC = lL + mM при р, Т = const зміна ізобарно-ізотермічного потенціалу визначається рівнянням
∆Z p,T = ∆Z 0 + RT ln |
al am |
(156) |
|
L M |
|||
aBb aCc |
|||
|
|
де ∆Z 0 - стандартне значення зміни ∆Z , а – відповідні значення
активностей компонентів, що приймають участь в реакції. Для умов рівноваги ∆Z p,T = 0 , тоді
|
|
|
∆Z0 = −RT ln |
alL aMm ...рівн. |
|
, |
|||||
звідки |
|
|
|
||||||||
|
|
|
|
|
|
|
|
aBb aCc ...рівн. |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
∆Z 0 |
,T |
= −RT ln K |
a |
+ RT ln A , |
(157) |
||||||
p |
|
|
|
|
|
|
k |
|
|||
де |
|
|
al |
|
am |
|
|
|
|
|
|
|
Ka = |
|
...рівн. |
(константа реакції), |
|||||||
|
L |
M |
|
|
|||||||
|
|
|
aBb aCc ...рівн. |
|
|
|
|||||
|
A = |
al |
am |
|
(активаційний коефіцієнт). |
||||||
|
L |
|
M |
|
|||||||
|
|
|
|
|
|||||||
|
|
k |
aBb |
aCc |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Рівняння (151) має назву рівняння ізотерми реакції, воно дозволяє визначати вірогідність направлення процесу за даних
http://tbk.at.ua |
55 |
Кафедра ТБВіМ |
|
умов. Щоб процес пішов у потрібному напрямку, необхідною умовою є ∆Z < 0, тобто
Ka > Ak
Це можна досягти або збільшенням Ка при збереженні активаційного Ak (наприклад, для випадку ендотермічних процесів, таких як дисоціація, підвищення температури), або зменшення Ak за сталими значеннями Ка (наприклад, зміною тиску або складу системи).
Ізобарно-ізотермічний потенціал може змінюватись із тиском, температурою, концентрацією. Між будь-яким і стандартним значенням ізобарно-ізотермічного потенціалу існує залежність:
∆Z = ∆Z 0 + RT ln a |
(158) |
де а – активність речовини (для чистої рідини і чистого твердого тіла а = 1 для середніх значень р і Т, а активність газів приймається рівною парціальному тиску газів – при р не
більше декількох бар). |
|
|
|
|||
Із (153) |
|
|
∆ZT0 |
|
|
|
ln K p = − |
∆ZT0 |
або lg Kp = |
, |
(159) |
||
4.573Т |
||||||
|
RT |
|
|
|
||
тобто, визначивши ∆ZT0 , можна знайти значення константи рівноваги при даній температурі.
Для підрахунку величини ∆ZT0 рекомендовано [5] користуватись формулою
∆Z0T = ∆H0298 −T∆S0298 + ∫298Т ∆CpdT −T∫298T ∆CdT /T (160)
(тут ∆HT = ∆HT0 + ∫TT ∆Cp dT , |
||
|
0 |
|
∆Cp = ∑CРкін.прод − ∑СРвих.прод , |
||
∆ST0 = ∆S2980 + T |
∆Cp dT |
). |
|
||
∫298 |
T |
|
http://tbk.at.ua |
56 |
Кафедра ТБВіМ |
|
2.4.2. Термодинаміка високотемпературних технологічних процесів
Термодинамічний аналіз високотемпературних процесів дозволяє визначити теоретичний тепловий ефект утворення мінералів на 1 кг продукту випалу. Наприклад, якщо необхідно визначити теоретичний тепловий ефект утворення в’яжучих речовин (клінкеру, вапна або гіпсових в’яжучих), можна скористуватись залежністю:
|
q = [GCaCOC |
(∆H )1 |
+GMgCOC |
(∆H )2 |
+GCC |
H (∆H )3 |
+GASC |
2 |
H |
(∆H )4 + L1 ]−0.01× |
|||||
|
|
3 |
|
|
3 |
|
|
S 2 |
|
|
|
|
2 |
||
|
×[C3S (∆H )9 +C2 S (∆H )5 +C4 AF (∆H )6 +C12 A7 (∆H )8 +∑Mi (∆H )i ]− L2 |
||||||||||||||
де |
GC |
, |
GC |
|
, |
GC |
H |
, |
GC |
H |
|
- вміст в сировині, |
|||
|
CaCO |
|
MgCO |
|
C |
2 |
AS |
2 |
|
|
|
|
|||
|
3 |
|
|
3 |
|
S |
|
2 |
|
|
|
|
|
||
відповідно, карбонатів кальцію і магнію, двоводного гіпсу, каолініту; ∆Н1...∆Н4 - ентальпія реакції декарбонізації та
дегідратації; L1 – коефіцієнт, який враховує ентальпію утворення розплаву; С3S, C2S, C4AF, C12A7 – вміст відповідних мінералів; Мі , (∆Н)і – вміст інших мінералів в готовому продукті та ентальпія їх утворення; L2 – коефіцієнт, який враховує ентальпію охолодження розплаву.
Продуктивність процесу (відповідно, теплових апаратів) випалу гіпсових, вапняних в’яжучих і клінкеру пов’язана з ентальпією дегідратації або декарбонізації та характеристиками теплоносія і температурним рівнем процесу наступною залежністю:
|
|
tg V c t |
|
||
|
− |
|
|
|
(161) |
|
|
||||
G = 1 |
|
|
∆Hi |
||
|
|
t |
|
||
де tg, t – відповідно температура дегідратації гіпсу або декарбонізації кальциту (магнезиту) та температура теплоносія, 0С; ∆Ні – ентальпія реакції дегідратації або декарбонізації, кДж/кг; V –об’єм теплоносія, який забезпечує
енергію термічної обробки, м3/с, с – теплоємність теплоносія, кДж/м3 .оС.
За даними різних авторів [1, 2] тепловий ефект реакції складає (на 1 кг мінералу) в кДж/кг:
http://tbk.at.ua |
57 |
Кафедра ТБВіМ |
|

Al2O3 2SiO2 2H2O → Al2O3 2SiO2 ,2H2O(450... |
5000C)... −935 . |
||
MgCO → MgO,CO (500... |
9000C)... −817...1420 |
||
3 |
2 |
10000 C) |
|
CaCO →CaO,CO (900... |
−1660 |
||
3 |
2 |
|
|
Утворення розплаву.......................................... |
|
– 209 |
|
Al2O3 + 2SiO2 → Al2O3 2SiO2 (9600 C)... +302 3CaO + Al2O3 → 3CaO Al2O3 (1200...13000 C)... +88
4CaO + Al2O3 + Fe2O → 4CaO Al2O3 Fe2O3
(1200..13000 C)... +160 êÄæêã
2CaO + SiO2 → 2CaO SiO2 (1200...13000 C)... + 620 3CaO + SiO2 →3CaO SiO2 (1300...14500 C)... + 465
CaSO4 2H2O → CaSO4 × |
|
|
|
|
|
×0.5H2O,1.5H2O(125...1600 C)... − |
(606 + 0.4t) |
êÄæ |
|
|
|
êãÑs H2 |
|||||
|
|
||||
CaSO4 0.5H 2O → CaSO4 ,0.5H 2O(190...200 |
0 C)... −(804 +0.54t) |
êÄæ |
|||
êãÑs H 2 |
|||||
|
|
|
|||
http://tbk.at.ua |
58 |
Кафедра ТБВіМ |
|
Глава 3. Фазові переходи. Пароподібний стан
3.1. Правило фаз Гіббса
Число незалежних змінних (або число ступенів вільності) гетерогенної системи в момент рівноваги повинно дорівнювати загальному числу змінних m, які характеризують стан системи в будь-який момент, за винятком числа залежних змінних r в момент рівноваги.
Таким чином,
N = m – r + 2 (161)
Вираз (161) можна також сформулювати так: число ступенів вільності гетерогенної системи в момент рівноваги дорівнює числу компонентів мінус число фаз плюс два.
Число N > 0, m + 2 ≥ r.
3.2. Фазові перетворення
Перетворення 1-го роду – це процеси, які йдуть із затратами теплоти і зміною об’єму; в них змінюється агрегатний стан речовини або відбувається перехід від одного твердого до другого твердого стану.
Для 1-компонентної системи з незмінним хімічним складом параметрами стану є Т, р. Для такої системи N = 1 – r + 2 = 3 –
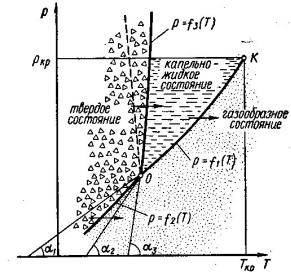
r. Якщо система також однофазна, то N = 3 – 1 = 2. |
|
|
||
|
Стан системи m = 1, r = 1 |
|||
|
повністю визначається двома |
|||
|
незалежними параметрами – |
|||
|
р, Т, які можна довільно |
|||
|
змінювати в широких межах |
|||
|
без появлення інших фаз, |
|||
|
тобто |
система |
може |
|
|
перебувати лише в твердому, |
|||
|
або лише |
в |
крапельно- |
|
|
рідкому, або лише в |
|||
Рис. 8 Т-р – діаграма речовин з |
газоподібному стані. Область |
|||
цих станів |
зображується на |
|||
однією потрійною точкою |
Т-р – діаграмі (рис. 8) |
|
||
|
|
|||
http://tbk.at.ua |
59 |
Кафедра ТБВіМ |
|
Якщо незалежним параметром є температура Т, то можна провести на р-Т – діаграмі 3 лінії:
p = f1(T ), p = f2 (T ), p = f3 (Т), які дають лінії рівноваги будь-якої пари параметрів із 3-х фаз. Тоді p = f1(T ) - лінія випаровування або конденсації, p = f2 (T ) - лінія сублімації (або поглинання), p=f3(Т) - лінія плавлення (або затвердівання).
Випаровування, сублімація і плавлення (або оборотні процеси ) відбуваються при строго певному тиску (або за даним тиском при строго певній температурі). Якщо речовина випаровується за певним тиском, температура її залишається сталою, доки вся рідина не перейде в пару.
Таке ж явище характерно для ліній плавлення і сублімації. Для двофазних (r = 2) систем число ступенів вільності
N = 3 – 2 = 1, для 3-фазних (r = 3) N = 3 - 3 = 0.
Для N =0 система може існувати лише при строго певних значеннях р і Т,а на Т-р – діаграмі такому стану відповідає лише точка 0 (потрійна точка). При порушенні параметрів точки О система перейде на одну із ліній p = f1(T ), p = f2 (T )
або p = f3 (Т), при цьому зникне одна із фаз.
Точка К (критична) відповідає стану, коли для певних р і Т (для даної речовини) об’єми рідкої фази і пари зрівнюються, тобто зникне фізична різниця між крапельно-рідинним і газоподібним станом. Лінія випаровування починається з т. 0 і закінчується в т. К.
На лінії плавлення експериментально така точка не виявлена, тому лінія плавлення прямує далеко вверх. Лінія сублімації направлена до 00К.
Для фазових перетворень 1-го роду
Сp = dTdq = ∞, тому що dq ≠ 0 , а dT = 0 . Коефіцієнт ізобарного розширення
α = |
1 |
|
∂v |
= ∞, тому що ∂v ≠ 0,∂T = 0 |
||
|
|
|
|
|||
v0 |
|
|||||
|
|
∂T p |
|
|
||
http://tbk.at.ua |
|
|
|
|
60 |
Кафедра ТБВіМ |
|
|
|
|
|
||
