
Загальна фізика / Теоретичні курси / Молекулярна фізика та термодинаміка
.pdf
Державний економiко - технологiчний унiверситет транспорту
Кафедра фiзики i електротехнiки
Проф.Чепiлко М.М. Доц.Романко Л.О.
Молекулярна фiзика та термодинамiка
(Теоретичний курс)
18 декабря 2008 г.

ЗМIСТ |
|
|
1 Молекулярно - кiнетична теорiя iдеальних газiв |
5 |
|
1.1 |
Статистичний i термодинамiчний методи. Експериментальнi закони iдеального газу . . . |
5 |
1.2 |
Рiвняння Клапейрона Менделєєва . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
10 |
1.3 |
Основне рiвняння молекулярно-кiнетичної теорiї iдеальних газiв . . . . . . . . . . . . . . |
13 |
1.4Закон Максвела про розподiл молекул iдеального газу по швидкостях i енергiях теплового
|
руху . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
16 |
1.5 |
Барометрична формула. Розподiл Больцмана . . . . . . . . . . . . . . . . . . . . . . . . . . |
20 |
1.6 |
Середнє число зiткнень i середня довжина вiльного пробiгу молекул . . . . . . . . . . . . |
22 |
1.7 |
Експериментальне обгрунтування молекулярно - кiнетичної теорiї . . . . . . . . . . . . . |
24 |
1.8 |
Явища переносу в термодинамiчно нерiвноважних системах . . . . . . . . . . . . . . . . . |
26 |
1.9 |
Вакуум i методи його отримання. Властивостi ультрарозрiджених газiв . . . . . . . . . . |
29 |
1.10Тестування теоретичної пiдготовки з молекулярно - кiнетичної теорiї iдеальних газiв . . 34 1.10.1 Пiдсумок тестування теоретичної пiдготовки з молекулярно - кiнетичної теорiї iде-
альних газiв . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
41 |
1.11 Розв’язування задач з молекулярно - кiнетичної теорiї iдеальних газiв . . . . . . . . . . . |
42 |
1.11.1 Пiдсумок тестування практичної пiдготовки з молекулярно - кiнетичної теорiї iде- |
|
альних газiв . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
50 |
2 Основи термодинамiки |
51 |
2.1Число ступенiв свободи молекули. Закон рiвномiрного розподiлу енергiї по ступенях сво-
боди молекул . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
51 |
2.2 Перший закон (принцип) термодинамiки . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
54 |
2.3Робота газу при змiнi його об’єму. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 56
2.4 Теплоємнiсть . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
58 |

2.5 Застосування першого закону термодинамiки до iзопроцесiв . . . . . . . . . . . . . . . . . |
61 |
2.6Адiабатичний процес. Полiтропний процес. . . . . . . . . . . . . . . . . . . . . . . . . . . . 65
2.7 |
Круговий процес (цикл). Оборотнi i необоротнi процеси . . . . . . . . . . . . . . . . . . . |
69 |
2.8 |
Ентропiя, її статистичне тлумачення i зв’язок з термодинамiчною вiрогiднiстю. . . . . . . |
72 |
2.9 |
Другий закон термодинамiки . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
76 |
2.10 |
Тепловi двигуни i холодильнi машини. Цикл Карно i його к.п.д. для iдеального газу . . . |
79 |
2.11 |
Тестування теоретичної пiдготовки з основ термодинамiки . . . . . . . . . . . . . . . . . . |
85 |
|
2.11.1 Пiдсумок тестування теоретичної пiдготовки з основ термодинамiки . . . . . . . . |
96 |
2.12 |
Розв’язування задач з основ термодинамiки . . . . . . . . . . . . . . . . . . . . . . . . . . . |
97 |
|
2.12.1 Пiдсумок тестування практичної пiдготовки з основ термодинамiки . . . . . . . . |
106 |
3 Реальнi гази, рiдини та твердi тiла |
107 |
|
3.1 |
Сили i потенцiйна енергiя мiжмолекулярної взаємодiї . . . . . . . . . . . . . . . . . . . . |
107 |
3.2 |
Рiвняння Ван-дер-Ваальса . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
110 |
3.3 |
Iзотерми Ван-дер-Ваальса i їх аналiз . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
112 |
3.4 |
Внутрiшня енергiя реального газу . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
116 |
3.5 |
Ефект Джоуля Томсона . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
118 |
3.6 |
Зрiджування газiв . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
122 |
3.7 |
Властивостi рiдин. Поверхневий натяг . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
124 |
3.8 |
Змочування . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
129 |
3.9 |
Тиск пiд викривленою поверхнею рiдини . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
131 |
3.10 |
Капiлярнi явища . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
134 |
3.11 |
Твердi тiла. Моно- i полiкристали. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
135 |
3.12 |
Типи кристалiчних твердих тiл . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
137 |
3.13 |
Дефекти в кристалах . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
146 |
3.14 |
Теплоємнiсть твердих тiл . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
149 |

3.15 |
Випаровування, сублiмацiя, плавлення i кристалiзацiя. Аморфнi тiла . . . . . . . . . . . . |
151 |
3.16 |
Фазовi переходи I i П роду . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
155 |
3.17 |
Дiаграма стану. Потрiйна точка . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
157 |
3.18 |
Тестування теоретичної пiдготовки з фiзики реальних суцiльних середовищ . . . . . . . . |
161 |
|
3.18.1 Пiдсумок тестування теоретичної пiдготовки з фiзики реальних суцiльних середовищ172 |
|
3.19 |
Розв’язування задач з фiзики реальних суцiльних середовищ . . . . . . . . . . . . . . . . |
173 |
|
3.19.1 Пiдсумок тестування практичної пiдготовки з фiзики реальних суцiльних середовищ180 |
|

1.Молекулярно - кiнетична теорiя iдеальних газiв
1.1.Статистичний i термодинамiчний методи. Експериментальнi закони iдеального газу
Статистичний термодинамiчний методи дослiдження. Молекулярна фiзика i термодинамiка роздiли фiзики, в яких вивчаютьсямакроскопiчнi процеси в тiлах, якi пов’язанi з наявнiстю в тiлах величезної кiлькостi атомiв i молекул. Для дослiдження цих процесiв застосовують два якiсно рiзних i взаємно доповнюючих один одного методи:статистичний (молекулярно-кiнетичний) i термодинамiчний. Перший лежить в основi молекулярної фiзики, другий термодинамiки.
Молекулярна фiзика роздiл фiзики, який вивчає будову i властивостi речовини виходячи з молекулярно-кiнетичних уявлень, що грунтуються на тому, що всi тiла складаються з молекул, якi знаходяться в безперервному хаотичному русi.
Iдея про атомну будову речовини висловлена старогрецьким фiлософом Демокрiтом (460 370 до н. э.). Атомiстика вiдроджується знову лише в XVII в. i розвивається в роботах М. В. Ломоносова, погляди якого на будову речовини i тепловi явища були близькi до сучасних. Строгий розвиток молекулярної теорiї вiдноситься до середини XIX в. i пов’язаний з роботами нiмецького фiзика Р. Клаузiуса (1822 1888), Дж. Максвела i Л. Больцмана.
Процеси, що вивчаються молекулярною фiзикою, є результатом сукупної дiї величезного числа молекул. Закони поведiнки величезного числа молекул, будучи статистичними закономiрностями, вивчаються за допомогою статистичного методу. Цей метод оснований на тому, що властивостi макроскопiчної системи в кiнцевому результатi, визначаються властивостями частинок системи, особливостями їх руху i усередненими значеннями динамiчних характеристик цих частинок (швидкостi, енергiї i т.i.). Наприклад, температура тiла визначається швидкiстю хаотичного руху його молекул, але, оскiльки, у будь-який момент часу рiзнi молекули мають рiзнi швидкостi, то вона може бути виражена тiльки через середнє значення швидкостi руху молекул. Не можна говорити про температуру однiєї молекули. Таким

чином, макроскопiчнi характеристики тiл мають фiзичний сенс лише у разi великого числа молекул. Термодинамiка роздiл фiзики, який вивчає загальнi властивостi макроскопiчних систем, що
знаходяться в станi термодинамiчної рiвноваги, i процеси переходу мiж цими станами. Термодинамiка не розглядає мiкропроцеси, якi лежать в основi цих перетворень. Цим термодинамiчний метод вiдрiзняється вiд статистичного. Термодинамiка базується на двох началах фундаментальних законах, встановлених в результатi узагальнення дослiдних даних.
Область застосування термодинамiки значно ширше, нiж молекулярно-кiнетичної теорiї, бо немає таких областей фiзики i хiмiї, в яких не можна було б користуватися термодинамiчним методом. Проте, з iншого боку, термодинамiчний метод дещо обмежений: термодинамiка нiчого не говорить про мiкроскопiчну будову речовини, про механiзм явищ, а лише встановлює зв’язок мiж макроскопiчними властивостями речовини. Молекулярно-кiнетична теорiя i термодинамiка взаємно доповнюють одна одну, утворюючи єдине цiле, але вiдрiзняються рiзними методами дослiдження.
Термодинамiка має справу з термодинамiчною системою сукупнiстю макроскопiчних тiл, якi взаємодiють i обмiнюються енергiєю як мiж собою, так i з iншими тiлами (зовнiшнiм середовищем). Основа термодинамiчного методу визначення стану термодинамiчної системи. Стан системи задається термодинамiчними параметрами (параметрами стану) сукупнiстю фiзичних величин, що характеризують властивостi термодинамiчної системи. Зазвичай в якостi параметрiв стану вибирають температуру, тиск i питомий об’єм. Температура одне з основних понять, що грають важливу роль не тiльки в термодинамiцi, але i у фiзицi в цiлому.Температура фiзична величина, що характеризує стан термодинамiчної рiвноваги макроскопiчної системи. Вiдповiдно до рiшення XI Генеральної конференцiї по мiрам i терезам (1960) в даний час можна застосовувати тiльки двi температурнi шкали -термодинамiчну i Мiжнародну практичну, градуйованi вiдповiдно в кельвiнах (K) i в градусах Цельсiя (0C). ВМiжнароднiй практичнiй шкалi температура замерзання i кипiння води при тиску 1, 013 · 105 Па вiдповiдно 0 i 1000(репернi точки).
Термодинамiчна температурна шкала визначається по однiй репернiй точцi, в якостi якої взята потрiйна точка води (температура, при якiй лiд, вода i насичений пар при тиску 609 Па знаходять-

ся в термодинамiчнiй рiвновазi). Температура цiєї точки по термодинамiчнiй шкалi дорiвнює 273,16 К (точно). Градус Цельсiя дорiвнює кельвiну. В термодинамiчнiй шкалi температура замерзання води дорiвнює 273,15 К (при тому ж тиску, що i в Мiжнароднiй практичнiй шкалi), тому, за визначенням, термодинамiчна температура i температура по Мiжнароднiй практичнiй шкалi зв’язана спiввiдношенням
T = 273, 15 + t.
Температура T=0 К називається нулем кельвiна. Аналiз рiзних процесiв показує, що 0 К недосяжний, хоча наближення до нього скiльки завгодно близько можливе.
Питомий об’єм υ це об’єм одиницi маси. Коли тiло однорiдне, тобто його густина ρ=const, то υ = V/m = 1/ρ. Оскiльки при постiйнiй масi питомий об’єм пропорцiйний загальному об’єму, то макроскопiчнi властивостi однорiдного тiла можна характеризувати об’ємом тiла.
Параметри стану системи можуть змiнюватися. Будь-яка змiна в термодинамiчнiй системi, пов’язана iз змiною хоча б одного з її термодинамiчних параметрiв, називається термодинамiчним процесом. Макроскопiчна система знаходиться в термодинамiчнiй рiвновазi, якщо її стан з часом не мiняється (припускається, що зовнiшнi умови даної системи при цьому не змiнюються).
В молекулярно-кiнетичнiй теорiї користуються iдеалiзованою моделлю iдеального газу, згiдно якої вважають, що:
1)власний об’єм молекул газу малий в порiвняннi з об’ємом посудини;
2)мiж молекулами газу вiдсутнi сили взаємодiї;
3)зiткнення молекул газу мiж собою i зi стiнками посудини абсолютно пружнi.
Модель iдеального газу можна використовувати при вивченнi реальних газiв, оскiльки вони в умовах, близьких до нормальних (наприклад, кисень i гелiй), а також при низькому тиску i високих температурах близькi по своїх властивостях до iдеального газу. Крiм того, взявши до уваги поправки, що враховують власний об’єм молекул газу i дiючi молекулярнi сили, можна перейти до теорiї реальних газiв.
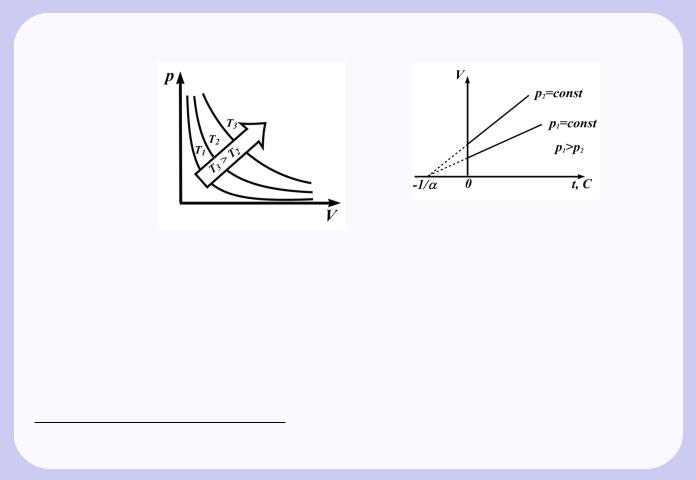
Розглянемо закони, що описують поведiнку iдеальних газiв.
Рис. 1.1. |
Рис. 1.2. |
Закон Бойля Марiотта: 1 для даної маси газу при постiйнiй температурi добуток тиску газу на його об’єм є величина стала:
pV = const при T = const, m = const. |
(1.1) |
Крива, що зображає залежнiсть мiж величинами p i V , якi характеризують властивостi речовини при постiйнiй температурi, називається iзотермою. Iзотерми є гiперболами, розташованими на графiку тим вище, чим вище температура, при якiй вiдбувається процес (Рис.1.1).
Закони Гей-Люссака:2 1) об’єм даної маси газу при постiйному тиску змiнюється лiнiйно з температурою:
V = V0(1 + αt) при p = const, T = const; |
(1.2) |
1Р. Бойль (1627 1691) англiйський учений; Е. Марiотт (1620 1684) французький фiзик. 2Ж. Гей-Люссак (1778 1850) французький учений
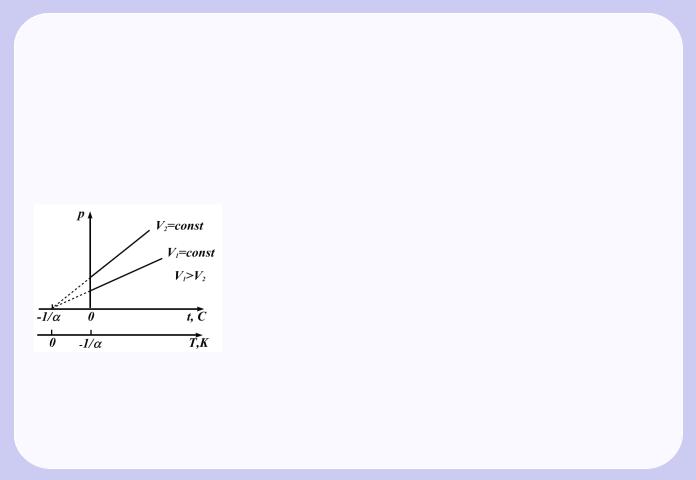
2) тиск даної маси газу при постiйному об’ємi змiнюється лiнiйно з температурою:
p = p0(1 + αt) при V = const, T = const; |
(1.3) |
В цих рiвняннях t - температура по шкалi Цельсiя, i V - тиск i об’єм при 00C, коефiцiєнт α=1/273,15 K −1.
Процес, що протiкає при постiйному тиску, називається iзобарним. На дiаграмi в координатах V, T (Рис.1.2) цей процес зображається прямою, яка називається iзобарою.
Процес, що протiкає при постiйному об’ємi, називається iзохорним. На дiаграмi в координатах p, T (Рис.1.3) вiн зображається прямою, яка називається iзохорою.
З (1.2) i (1.3) слiдує, що iзобари i изохори перетинають вiсь температур в точцi t = −1/α = −273, 150C, яка визначається з умови 1 +α t=0. Якщо перенести початок вiдлiку в цю точку, то вiдбувається перехiд до шкали Кельвiна (Рис.1.3), звiдки
|
|
|
T = t + 1/α |
|
Вводячи у формули (1.2) i (1.3) термодинамiчну температуру, законам |
||||
Гей-Люссака можна надати бiльш зручний вигляд : |
|
|||
Рис. 1.3. |
V = V0(1 + αt) = V0[1 + α(T − 1/α)] = V0αT |
|
||
|
|
|
|
|
p = p0(1 + αt) = p0[1 + α(T − 1/α)] = p0αT |
|
|||
V1/V2 = T1/T2 |
при |
p = const, |
m = const. |
(1.4) |
p1/p2 = T1/T2 |
при |
V = const, |
m = const. |
(1.5) |
де iндекси 1 i 2 вiдносяться до довiльних станiв, що лежать на однiй iзобарi або iзохорi.

Закон Авогадро 3: молi будь-яких газiв при однаковiй температурi i тиску займають однаковi об’єми. За нормальних умов цей об’єм дорiвнює 22,4·10−3м3 /моль.
За визначенням, в одному молi рiзних речовин мiститься одне i те ж число молекул, яке називається
постiйною Авогадро:
N = 6, 022 · 1023моль−1.
Закон Дальтона:4 тиск сумiшi iдеальних газiв дорiвнює сумi парцiальних тискiв p1, p2..., pn газiв, що входять в неї:
p = p1 + p2 + − + pn.
Парцiальний тиск тиск, який чинив би газ, що входить в склад газової сумiшi, якби вiн один займав об’єм, який дорiвнює об’єму сумiшi при тiй же температурi.
1.2.Рiвняння Клапейрона Менделєєва
Як вже зазначалося, стан деякої маси газу визначається трьома термодинамiчними параметрами: тиском , об’ємом V i температурою . Мiж цими параметрами iснує певний зв’язок, що називається рiвнянням стану, який в загальному виглядi дається виразом
f(p, V, T ) = 0
де кожна iз змiнних є функцiєю двох iнших
Французький фiзик i iнженер Б. Клапейрон (1799 1864) вивiв рiвняння стану iдеального газу, об’єднавши закони Бойля Марiотта i Гей-Люссака. Нехай деяка маса газу займає об’єм V1, має тиск p1 i знаходиться при температурi T1. Ця ж маса газу в iншому довiльному станi характеризується
3А. Авогадро (1776 1856) iталiйський фiзик i хiмiк. 4Дж. Дальтон (1766 1844) англiйський хiмiк i фiзик.
