
Физхимия_студентам_2семестр / Лаб_раб_19_кн
.DOC
Лабораторная работа № 19
Определение активности электролитов
методом ЭДС
Определение активности электролитов методом ЭДС
Свойства реальных растворов отличаются от идеальных вследствие таких причин как электростатическое взаимодействие ионов, образование ассоциатов, эффекты гидратации. Поэтому в уравнения, описывающие термодинамические свойства реальных растворов, следует вводить необходимые поправки, отчего эти уравнения приобретают грамоздкий и неудобный вид. Можно, однако, сохранить удобную форму уравнений, если вместо концентрации использовать активность.
Активностью а растворенного вещества называют его эффективную концентрацию, которая отличается от общей концентрации и учитывает взаимодействие частиц растворенного вещества между собой.
Общая концентрация может быть выражена в единицах молярной концентрации С (моль/л), моляльной m (моль/кг) или мольной долей x . Для точных измерений используют моляльную концентрацию, поскольку она мало зависит от температуры и давления.
Общая концентрация и активность связаны соотношением:
а = m , (1)
где - коэффициент активности, который учитывает отклонение свойств раствора от идеальности. Для неидеальных растворов отличается от единицы. В бесконечно разбавленных растворах электролитов взаимодействием ионов можно пренебречь, поэтому 1, а m.
Экспериментальное определение коэффициентов активностей отдельных ионов невозможно, поэтому используют среднеионные коэффициенты активности . Для выяснения смысла рассмотрим процесс диссоциации бинарного сильного электролита (типа HСl):
МА М+ + А-
Затем переходят к следующей концентрации НСl и т.д. В каждом случае пропускают водород до насыщения платинового электрода. При этом равновесие на электродах считают установившимся (для данной моляльности НСl ) , если значения ЭДС цепи перестает изменяться и принимает постоянное значение.
2. Построить график зависимости (+3,9610-4 Т lg mнсl) от mнсl и экстраполяцией к mнсl 0 определить Е0 Agcl/ Ag .
3. Расчитать по ур.(8) среднеионные коэффициенты активности НСl при заданных концентрациях НСl и сравнить со справочными данными.
4. Построить график зависимости lg от mнсl .
Вопросы к работе №19
1.Почему необходимо введение понятия “активности” при рассмотрении свойств растворенных веществ. Какую размерность может иметь активность. Что такое среднеионный коэффициент активности и среднеионная активность.
2. Как в общем случае изменяются коэффициенты активности
а) при изменении концентрации
б) при изменении ионной силы раствора
в) при изменении температуры
г) при переходе к растворителю другой полярности
3. Экспериментальные методы определения коэффициентов активности.
Литература
1.Ротинян А.Л. и др. “Теоретическая электрохимия”,Л.:1981,стр. 37-64.
2. “ Курс физической химии”, под редакцией Герасимова Я.И.,М.: 1973, т.2 , стр. 372-391.
3. Измайлов Н.А. “Электрохимия растворов”, М.:1966, стр. 37-94, стр.451.
Для расчетов ±(HCl) по уравнению (8) необходимо знать величину EoAgCl/Ag . Ее определяют графически и сущность метода легко понять, проанализировав уравнение (8). В очень разбавленных растворах ( mHCl 0) взаимодействием ионов можно принебречь, следовательно раствор приближается к идеальному, т.е. ± 1, lg ± 0. Поэтому при больших разбавлениях уравнение (8) приобретает вид:
EoAgCl/Ag - ( + 3,9610-4 T lg mHCl ) = 0 или
EoAgCl/Ag = + 3,9610-4 T lg mHCl
( + 3,9610-4 T lg mHCl)
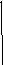

EoAgCl/A

mHCl
mHCl
Таким образом, построив график зависимости (+3,9610-4 T lg mHCl) от mHCl (или mHCl) и экстраполируя его к нулевой концентрации HCl (mHCl 0), находим величину EoAgCl/Ag по величине отрезка, отсекаемого на оси ординат (см.рис.).
Выполнение работы
1. Собрать цепь (-) Pt,H2 HCl AgCl, Ag (+)
(1 атм.)
и измерить ее равновесные э.д.с. при различных моляльных концентрациях HCl, начиная с наименьшей. Заполняют элемент раствором НСl начальной концентрации и фиксируют значения ЭДС с интервалом 5 минут до установления постоянного значения. Химический потенциал растворенного электролита МА складывается из химических потенциалов ионов:
МА = М+ + А- (2)
Используя общее выражение для химического потенциала компонента в растворе = 0 + RT ln а, преобразуем уравнение (2):
МА0 + RT ln а МА = (М+0 + RT ln аМ+ ) + (А-0 + RT ln а А-)
Принимая, что 0МА = 0М+ + 0А- , получаем ln а МА = ln а М+ + ln а А- , а значит и а МА = а М+ а А- .
Активность отдельных ионов не поддается прямому экспериментальному определению, поэтому для характеристики состояния ионов в растворе вводят среднеионную активность электролита:
а = а М+ а А- = а МА (3)
Согласно уравнению (1) а М+ =М+ mМ+; а А- =М+ mМ+, поэтому получаем, что
а = (М+ mМ+ ) (А- mА-) = М+ А- mМ+ mА- или
а = m (4)
где m = mМ+ mА- - среднеионная концентрация электролита (для бинарного электролита m = m, так как mМ+ = mА-= m )
= М+ А- - среднеионный коэффициент активности электролита.
Таким образом, среднеионный коэффициент активности представляет собой среднее геометрическое коэффициентов активностей ионов и является коэффициентом пропорциональности между среднеионной активностью электролита а и концентрацией m.
Для несимметричных электролитов МаАв выражение для выглядит иначе:
= аМв+ вАа-
Например: (H2SO4) = 2Н+ SO42-
Метод определения
Наиболее точно среднеионный коэффициент активности определяют методом измерения ЭДС. Для этого используют гальванический элемент без переноса, т.е. такой элемент, где отсутствует граница между растворами различного состава или различных концентраций (диффузионный потенциал в этом случае отсутствует). Следовательно, в гальваническом элементе без переноса оба полуэлемента ячейки должны быть заполнены одним электролитом одинаковой концентрации.
В данной работе предлагается определить среднеионные коэффициенты активности HCl методом измерения ЭДС следующей цепи:
(-) Pt, H2 HClAgCl, Ag (+)
Цепь состоит из водородного электрода, который обратим относительно H+ ионов раствора HСl и хлорсеребряного электрода, обратимого относительно ионов Cl- того же раствора HСl.
На водородном электроде протекает реакция восстановления: H+ + e 1/2 H2
Равновесный потенциал водородного электрода выражается уравнением Нернста:
EH=/H2 = E0 H=/H2 + RT/nF ln а H= /P1/2 H2
где E0 H=/H2 - стандартный потенциал водородного электрода (принят равным нулю);
n- число электронов в уравнении электрохимической реакции (n = 1);
Р1/2H2 - парциальное давление водорода в полуэлементе.
Для насыщенного водородного электрода (РH2 = 1атм.) потенциал выражаем следующим образом:
E H=/H2 = RT/F ln аH= (5)
На хлорсеребряном электроде протекает реакция окисления: Ag + Cl- - 1е = Ag Cl
При установлении равновесия потенциал хлорсеребряного электрода выражается уравнением Нернста:
EAgCl/ Ag = E0Ag+ / Ag + RT/F ln [ Ag+] =
= E0 Ag+ / Ag + RT /F ln ПРAgCl /[Cl-]=
= E0AgCl / Ag -RT/ F ln [Cl-] (6)
Э.Д.С. элемента определяется разностью равновесных потенциалов электродов (по уравнениям 5 и 6 ):
=ЕАgCl/Аg - Ен+/ н2 =Е0АgCl/ Аg -RT/F ( ln а Cl- + ln а H+) =
= Е0АgCl/ Аg - RT / F ln а Cl- а H+ (7)
Согласно формулам (3 и 4) из произведения активностей отдельных ищнов можно выразить среднеионную активность электролита (HCl):
а Cl- а H+ = а 2 (HCl) = ( mHCl)2
Подставляя это выражение в уравнение (7) получаем:
= Е0АgCl/ Аg - RT / F ln ( mHCl)2 =
= Е0АgCl/ Аg - 2 2,3 RT / F lg - 22,3 RT / F lg mHCl
Отсюда получаем выражение для среднего коэффициента активности HСl ±:
lg ±= [EoAgCl/Ag -(+2,32RT/F lg mHCl)] / 22,3 RT/F
Учитывая, что 22,3 R/F = 3,96 10-4 [В К-1], окончательно получаем:
lg±=[EoAgCl/Ag-(+3,9610-4Tlg mHCl)]/3,9610-4 Т, (8)
где - измеряемая э.д.с. элемента [В];
Т - температура [К];
m - моляльность раствора HСl [моль/кг]
Е0AgCl/Ag - стандартный потенциал хлорсеребряного электрода.
