
Физхимия_студентам_2семестр / Лаб_раб_22_кн
.doc
Лабораторная работа № 22
Газовые цепи
Газовые цепи
Задание к работе
Ознакомиться с теорией, методикой эксперимента, заданием и подготовиться к собеседованию по следующим вопросам:
1) сущность компенсационного метода измерения ЭДС;
2) теория газовых цепей;
3) нормальный элемент Вестона;
4) хлорсеребряный электрод.
Краткая теория работы
На поверхности платины, насыщенной водородом, возникает скачок потенциала, отвечающий работе окисления-восстановления водорода:
Н2 2H(адс.) 2Н+ +2ē
Подобным же образом могут быть осуществлены и другие газовые электроды.
Если газ химически совершенно не взаимодействует с металлом электрода, то на поверхности не происходит необратимых процессов, и потенциал оказывается хорошо воспроизводимым и действительно отвечающим равновесию окисленной и восстановленной формам. Величину скачка потенциала для газовых электродов можно определить по обычной формуле, учитывающей парциальное давление газа.
Так для водородного электрода мы имеем:
 (1)
(1)
или
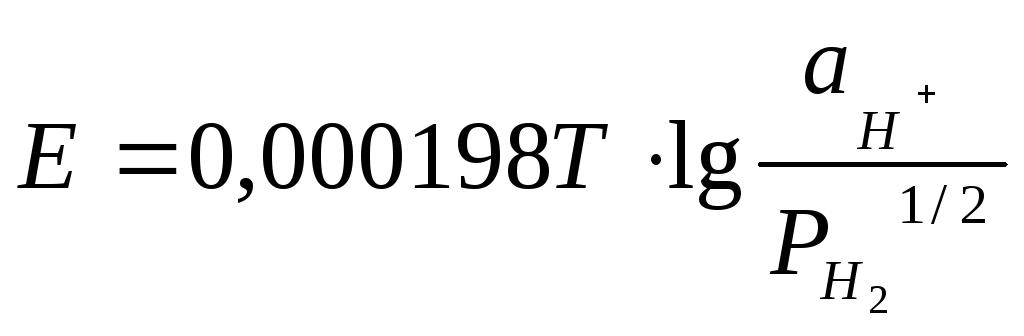 ,
так как E0
= 0 и n = 2.
,
так как E0
= 0 и n = 2.
Из газовых электродов можно составить газовую цепь (газовый элемент); если в качестве газовых электродов взять водородные электроды, получится водородная цепь.
Так в работе исследуется водородная цепь:
измерений ЭДС не дадут совпадающего результата, значение которого и будет искомым.
После измерений этой цепи таким же путем измеряют ЭДС второй и третьей цепи, заменяя один из двух газовых полуэлементов хлорсеребряным электродом.
Измерение ЭДС газовых цепей производится при помощи высокоомного потенциометра Р-37, в основе которого лежит компенсационный метод измерения ЭДС. Принцип действия и правила пользования потенциометром изложены в инструкции, с которой необходимо ознакомиться перед работой.
Порядок работы
-
Собрать установку для измерения ЭДС.
-
Приготовить первую цепь (I) и определить ее ЭДС, после чего по формуле (2) вычислить ионное произведение воды (КВ). Сравнить со справочными данными.
-
Приготовить вторую цепь (II) и определить ее ЭДС и по формуле (3) вычислить концентрацию ионов водорода в щелочи.
-
Приготовить третью цепь (III), измерить ее ЭДС, после чего по формуле (4) вычислить потенциал хлорсеребряного электрода и сопоставить эту величину со справочным значением.
-
Сделать вывод о практическом применении водородных электродов.
-
После работы тщательно промыть сосуды, особенно содержащие щелочь, так как в недостаточно промытом сосуде быстро заедаются краны, и он выходит из строя. После промывки сосуды заполнить дистиллированной водой и сдать инженеру рабочее место.
Устройство сосуда (4) понятно из рисунка. Платиновый платинированный электрод (1) в виде пластинки прикреплен к короткой платиновой проволоке, впаянной в стеклянную трубку (2), к которой при помощи сплава Вуда (3) присоединена медная проволока для соединения электрода с измерительной цепью. Стекло, в которое впаян электрод, является одновременно и шлифом к полуэлементу. Водород подводится к платиновому электроду через трубку (6) и выходит через жидкостной затвор (7). Кран открывается в начале опыта для заполнения носика сосуда (5) раствором.
Перед составлением цепи необходимо убедиться в том, что платиновый электрод хорошо платинирован и имеет черную бархатистую поверхность. Если слой платиновой черни на электроде поврежден, то его нужно заново платинировать (обратиться к инженеру).
Для измерения первой цепи берутся два сосуда. Один из них заполняют 1н раствором HCl, второй – 1н раствором KOH. Вынув шлиф с впаянным платиновым электродом, в сосуд наливают требуемый раствор приблизительно 3/4 сосуда и снова закрывают шлиф. После этого открывают кран и заполняют носик сосуда с таким расчетом, чтобы платиновый электрод в сосуде был покрыт раствором лишь наполовину. Затем оба полуэлемента закрепляют так, чтобы их носики были опущены в стаканчик с соединительной жидкостью (KCl) и приступают к насыщению водородом.
В виду того, что электродами в данной цепи является водород, растворенный в платине, техника работы с ним несколько сложнее, чем в случае с металлическими электродами. Поэтому надо принять меры, чтобы оба электрода были насыщены водородом и, чтобы это насыщение поддерживалось постоянно во время измерения (чтобы к электродам не мог проникнуть воздух). Это достигается использованием водяного затвора (7).
Через 15-20 минут после начала пропускания водорода производят первое измерение. После этого через полуэлементы снова пропускают водород в течение 5-10 минут и снова производят измерение. Если при этом ЭДС цепи несколько увеличилась, то это показывает, что насыщение было недостаточно полным, поэтому водород пропускают еще 5-10 минут, и так продолжают до тех пор, пока два последующих
Pt, H2 KOH KCL HCl H2, Pt (I)
Е2 Е1
ЭДС данной цепи равна =E1-E2,
где
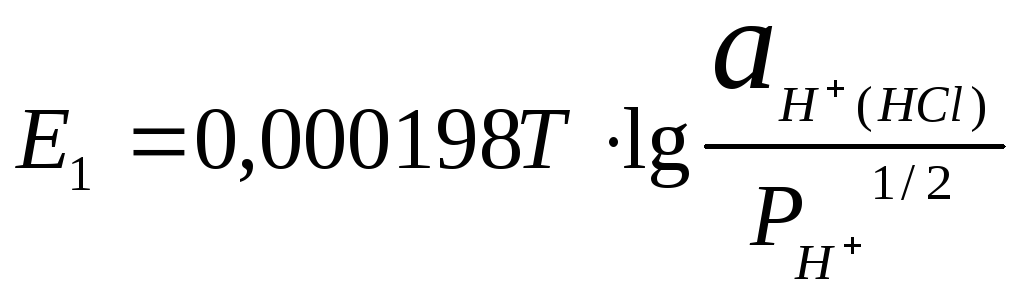 и
и
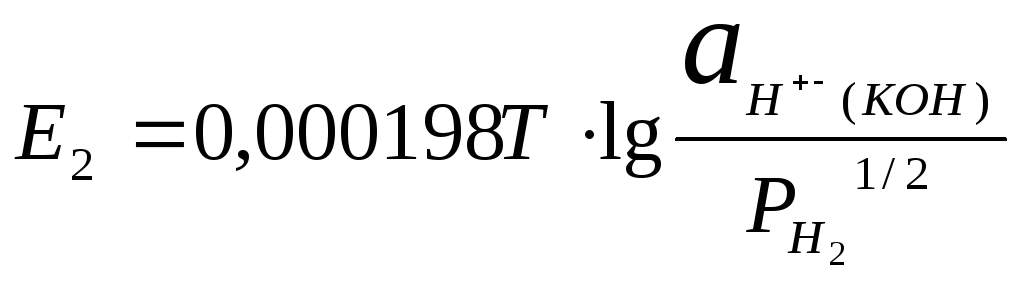
и, следовательно,
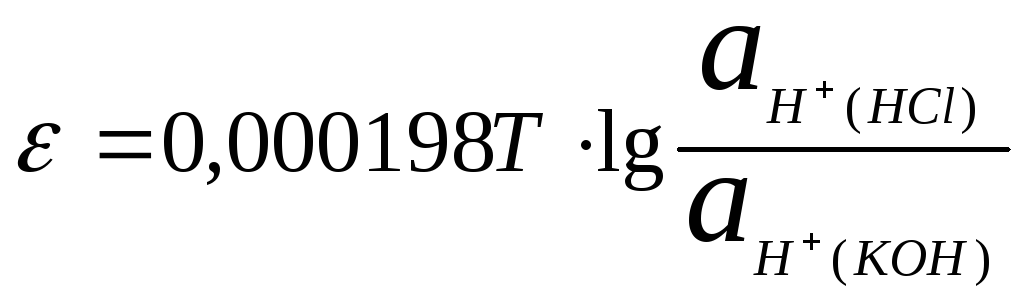
На основании
уравнения ионного произведения воды
![]()
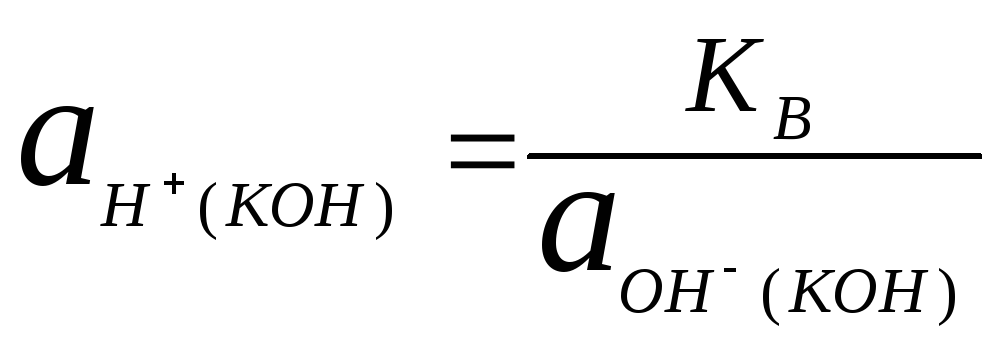 ,
,
поэтому ![]() ,
(2)
,
(2)
или
![]()
где аH+(HCl) = 1 C1 и аОH-(KOH) = 2 C2; C1 и C2 – молярные концентрации кислоты и щелочи в электродных растворах; 1 и 2 – их коэффициенты активности (Краткий справочник физико-химических величин).
Из уравнения (2) находят ионное произведение воды КВ.
Для измерения водородного показателя, а, следовательно, и концентрации ионов водорода в электролите, разработан ряд методов: колориметрический, кондуктометрический, потенциометрический.
Потенциометрическое определение производят, измеряя ЭДС гальванического элемента, составленного из водородного, хингидронного, сурьмяного или стеклянного электрода, погруженного в электролит, содержащий ионы водорода. Вторым электродом сравнения является хлорсеребряный, каломельный или водородный электрод.
В данной работе с
помощью потенциометрического метода
определяется концентрация ионов водорода
в щелочи![]() .
Для этого определяют ЭДС ()
следующей цепи:
.
Для этого определяют ЭДС ()
следующей цепи:
Pt, H2 KOH KCL KCl AgCl, Ag (II)
Е2 ЕAg,AgCl
ЭДС цепи =EАg,AgCl
– E2,
тогда
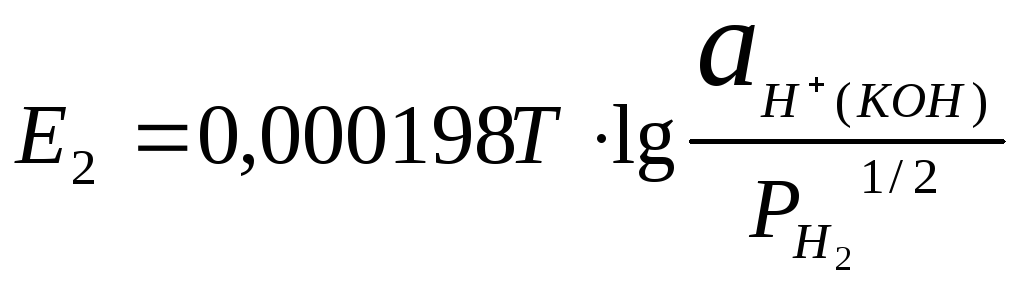 ,
,
т.к. измерения
проводят при Р=1 атм., то
![]()
Таким образом,
![]() ,
,
но аH+(KOH) = CH+ в KOH, поэтому
![]() ,
откуда
,
откуда
![]() ,
,
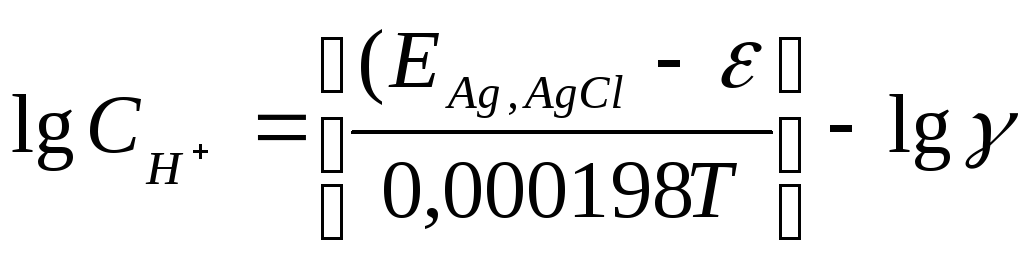
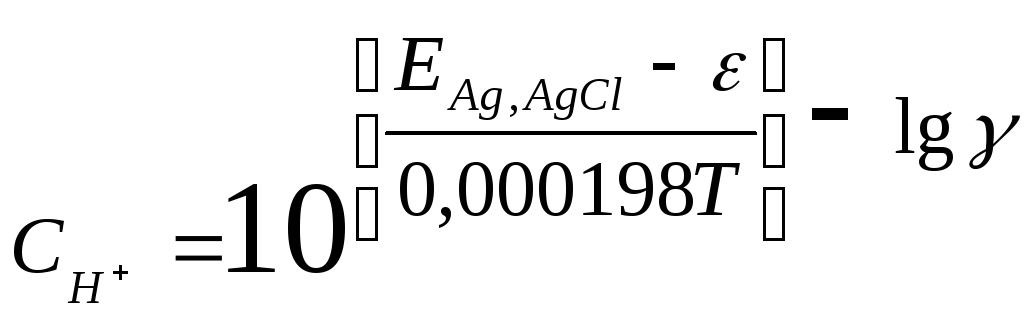 (3)
(3)
Потенциал хлорсеребряного электрода (EAg,AgCl) определять по ЭДС цепи, составленной из хлорсеребряного и водородного электродов. Для этого надо собрать цепь:
Pt, H2 HCl KCL KCl AgCl, Ag (III)
Е1 ЕAg,AgCl
ЭДС цепи = ЕAg,AgCl – E1
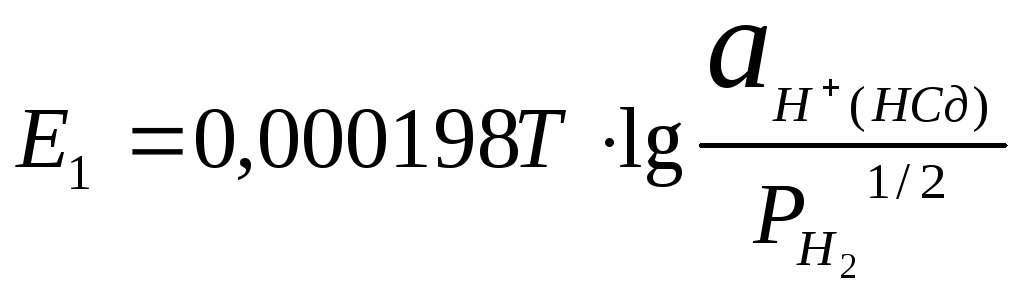 ,
,
так, как Р=1 атм.,
то
![]() ,
где
,
где
С – молярность раствора HCl, а – его коэффициент активности, то
![]() ,
,
откуда по известным , и C находят EAg,AgCl:
![]() (4)
(4)
Экспериментальная часть
Предлагается измерить ЭДС следующих цепей:
-
Pt, H2 KOH KCl HCl H2, Pt
-
Pt, H2 KOH KCl KCl AgCl, Ag
-
Pt, H2 HCl KCl KCl AgCl, Ag
Сосуд для газовой водородной цепи имеет форму, изображенную на рис.1.
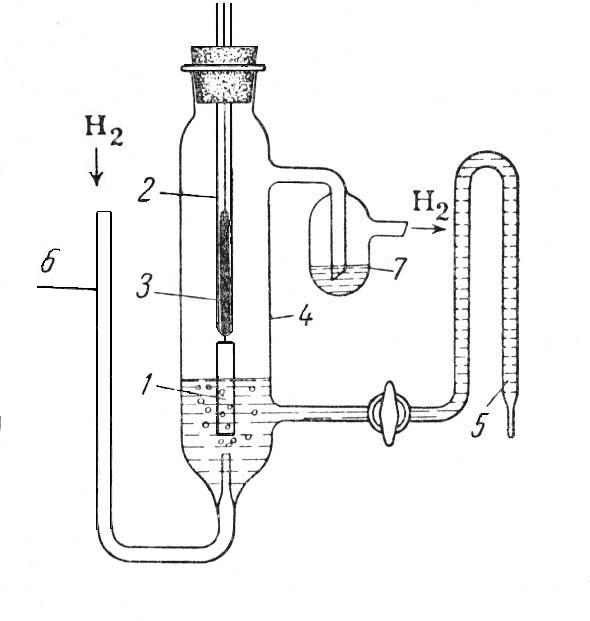
Рис.1.
Водородный электрод.
