
Физхимия_студентам_2семестр / Лаб_раб_14_кн
.doc
Теоретическая
часть
При
прохождении электрического тока через
раствор катионы двигаются к катоду, а
анионы к аноду. Простейший случай, когда
абсолютные скорости движения катионов
и анионов равны, т.е. когда uk
= va
тогда
lk
= la,
∞
=
lk
+ la.
Однако
в большинстве случаев абсолютные
скорости ионов не одинаковы uk
≠ va.
Возьмем, например, случай, когда uk
< va
и допустим, что
Наполнив
раствором горизонтальную трубку,
вставим с двух сторон ее электроды.
Представим, что эта трубка (рис.1)
разделена на три части: катодное
пространство, или катода (К на рис. 1)
анодное пространство, или анолит (А) и
среднее пространство (С). Допустим, что
в каждом на этих трех пространств было
по пять катионов и пяти анионов (или по
пяти полностью диссоциированных молекул
бинарного электролита (см. рис 1). Если
теперь через этот раствор пропустить
ток, т.е. начать электролиз, то катионы
двинутся к катоду, а анионы к аноду.
Анионы в 3/2 раза (по условию) подвижнее
катионов. Поэтому из анолита в католит
перейдет два катиона, за это же время
из католита в анолит перейдет три
аниона. В результате этого на катоде
соберется пять беспарных катионов: два
из них будут "пришедшие" и три
"покинутые" анионами (см. рис. 1,2).
Точно также в анолит соберется пять
беспарных анионов, однако, они будут
составлены из трех "пришедших" и
двух "покинутых". В среднем
пространстве изменения концентрации
не произойдет. Если теперь произойдет
разрядка собравшихся беспарных катионов
и анионов, то на аноде анионами будет
отдано во внешнее поле пять электронов,
в связи с чем эти анионы окисляются,
т.е. понизят свою отрицательную
валентность на единицу. За это же время
на катоде такое же количество катионов
восстановятся, приняв из внешнего поля
пять электронов. Следовательно,
количество перенесенных через раствор
электронов будет равно пяти, причем
два
из них
будут
перенесены катионами (так как их отдали
во внешнюю цепь два "покинутых"
анионов). Часть электричества,
перенесенного катионами, будет равна
2/5. Аннонами будет перенесено 3/5
электричества, так как католита в анолнт
прошло и там разрядилось три аниона.
Общее количество перенесенного анионами
электричества будет равно 2/5
+ З/5
= 1.
А│ + + + + + │ + + + + +
│ + + + + + │К
│ – – – – – │ – – – – – │ – – –
– – │
А
С К
│– – – + + │ +
+ + + + │ + + + + + │
│ – – – – – │ – – – – – │ – – –
+ + │
А
С К
│ + + + │ + + +
+ + │ + + │
Рис. 1. Схема
изменения концентрации ионов в растворе
между электродами
при
электролизе
Та
часть электричества, которую перенесли
через раствор анионы, называются числом
переноса анионов (ta).
Часть электричества, которую перенесли
катионы, называется числом переноса
катионов (tk).
В данном случае ta
= 3/5, a
tk
= 2/5. Сумма числа переноса катионов и
анионов всегда равна единице: ta
+ tk
= 1
Так
как число переноса анионов и катионов
пропорционально их скорости, то отношение
чисел переноса равно отношению их
абсолютных скоростей, а также подвижностей:
Если
проследить изменение концентраций в
растворе при
значениях
чисел переноса анионов катионов, то
окажется следующее:
а) среднее
пространство – концентрация не
изменилась;
б) в
анолите концентрация электролита
уменьшилась и составляет лишь 3/5 от
начальной;
в) в католите
концентрация еще больше уменьшилась,
так как из 5 ионных осталось только 2,
или 2/5 от первоначальной.
Если
первоначальную концентрацию среднего
пространства обозначить через С0,
а концентрацию после электролиза в
католите и анолите, соответственно Сk
и
Са,
то изменения концентрации будет
следующее:
а) среднее
пространство – концентрация не
изменилась;
б) в
анолите ∆Са
= С0
–
Са;
в) в
католите ∆Сk
= С0
–
Сk.
Сочетая это со
сказанным ранее, можно написать:
или
Из работы по
исследованию электропроводности
раствора известно, что
где
- эквивалентная электропроводность;
α- степень
электролитической
диссоциации;
F
- число Фарадея;
Uk
- абсолютная скорость движения катионов;
Va
- абсолютная скорость движения анионов;
Абсолютная скорость
движения ионов – это скорость движения
иона в электрическом поле 1 см в 1 секунду
при градиенте поля, т.е. при отношении
напряжения к длине = 1 вольт на 1 см длины.
Поэтому если при данном градиенте поля
скорость будет и – можно написать:
отсюда или
Для аниона
Следовательно,
определив Uk
и Va,
т.е. скорость
движения ионов, можно вычислить
абсолютную
скорость движения ионов, а также их
подвижность, lk
и la
так как lk
= Uk∙F.
Проще всего
определить скорость движения тех ионов,
которые сообщают раствору окраску, так
как это облегчает наблюдения за
изменением положения высоты окрашенного
слоя раствора
при перемещении
ионов. Поэтому в учебных лабораториях
берут такие
электролиты,
как перманганат калия и другие.
2. Методика
эксперимента
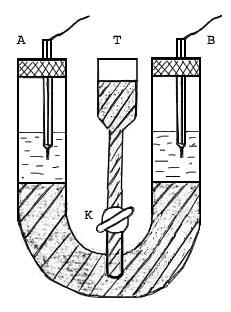
Через отверстия
A
и B
налить в V- образную трубку 0,001н раствор
азотнокислого калия с таким расчетом,
чтобы в каждом колене трубки образовался
слой этого раствора в 5-7
см.
Налить в V-образную
трубку через воронку Т (рис.2) разбавленного,
например, 0,05 н
раствора перманганата калия с таким
расчетом, чтобы этот раствор заполнял
все пространство от воронки Т до
крана К. Если
при этом раствор азотнокислого калия
попадает выше крана К, надо вымыть его
оттуда водой или отобрать пипеткой.
Вставить в верхнее
отверстие V-образной
трубки платиновые электроды (как
показано на рис. 2), закрепленные в
пробках. Для свободного движения
воздуха через пробки
в них должны
быть сделаны вертикальные отверстия.
Не нужно стараться, чтобы вставленные
на пробках электроды были погружены
в раствор. Пока они могут оставаться
в трубках над раствором азотнокислого
кадия (т.е. висеть на воздухе).
Рис. 2. Ячейка для
изучения подвижности ионов.
Осторожным
поворотом крана К очень медленно
впускать в V-образную трубку раствор
перманганата калия из воронки Т,
внимательно следя, чтобы сохранялась
совершенно четкая и, возможно, более
резкая окрашенная граница между
растворами перманганата и нитрата
калия. При этом раствор азотнокислого
калия поднимается вверх, и платиновые
электроды погружаются в него.
Когда толщина
слоя перманганата калия достигнет 3-5
см, кран К закрыть, при этом уровни
раствора будут фиксированы.
Подключив к
верхним проволокам электродов
аккумуляторную батарею (4-6 вольт),
записать время процесса и высоту слоев
раствора
перманганата калия в правом и левом
коленах V-образной
трубки.
Для этого на коленах трубки должна
быть нанесена шкала, если
ее нет, приклеивают к
каждому колену трубки по полоске
миллиметровой бумаги и по этой шкале
ведется расчет.
Подключая на
короткое время параллельно к V-образной
трубке
вольтметр определить приложенное
напряжение на электродах.
Измерить длину
жидкого проводника между электродами.
Для этого, вдоль по средней части трубки
приложить легко изгибающуюся (но
охраняющую свою форму) медную проволоку,
загибая ее по форме трубки
от нижнего конца одного электрода до
нижнего конца другого электрода. Сделав
против этих концов отметки на проволоке,
выпрямить ее и, приложив к линейке, и
измерить длину жидкого проводника
между электродами.
Разделив напряжение
Е на длину L,
вычислить градиент потенциала h
= E/L.
Когда окрашенная
граница слоя
перманганата калия переместится на
0,3-0,5 см, опыт
прекратить
и определить время (секунды), в продолжении
которого шел
процесс электролиза. Вычислить скорость
движения
перманганатного
аниона путь/время
(см/сек) при
данном
градиенте
потенциала. Для получения более точных
результатов опыт проделать три
раза.
Исходя из уравнения
/1/, вычислить абсолютную скорость
движения аниона. Исходя
из уравнения
/2/, вычислить подвижность аниона
перманганата и сравнить ее с приведенной
в дополнительных таблицах.
Рассчитать
относительную ошибку опыта по сравнению
с табличными данными, сделать
соответствующие выводы
По заданию
преподавателя провести точно такой
же опыт с сернокислым никелем.
Литература:
Герасимова Я.И.,
Древинг В.П., Еремин Е.Н., Киселев А.В.,
Лебедев В.П., Панченков Г.М., Шлыгин
А.И. Курс физической химии,. Под. общ.
редакц. Герасимова Я.И. М: Химия, 1966,
Т.2., С. 444-450.
Шаталов А.Я.,
Маршаков И.К. Практикум по физической
химии, М., Высшая шк., 1975, С.27-33.
8
Исследование
скорости движения ионов и
определение
их абсолютной скорости и подвижности
![]() .
.![]()
![]()
![]() ;
;
![]()
![]()
![]() (1)
(1)![]() (2)
(2)
1
2
7
3
6
4
5
