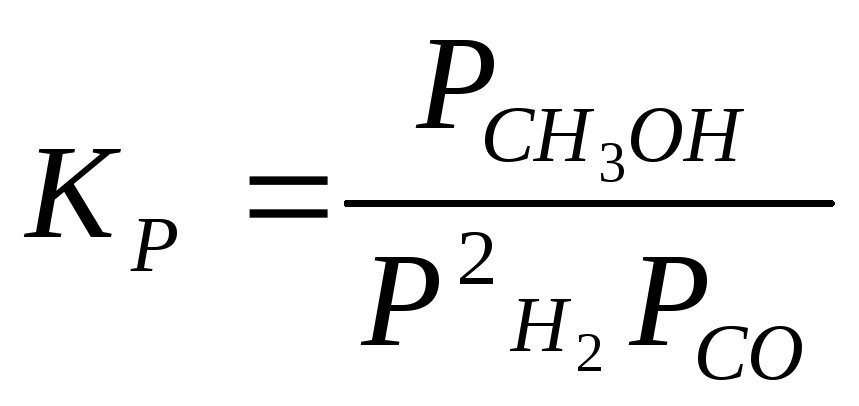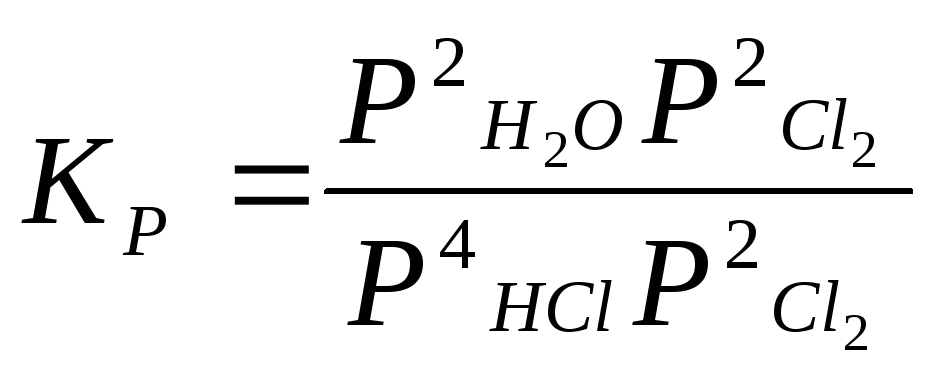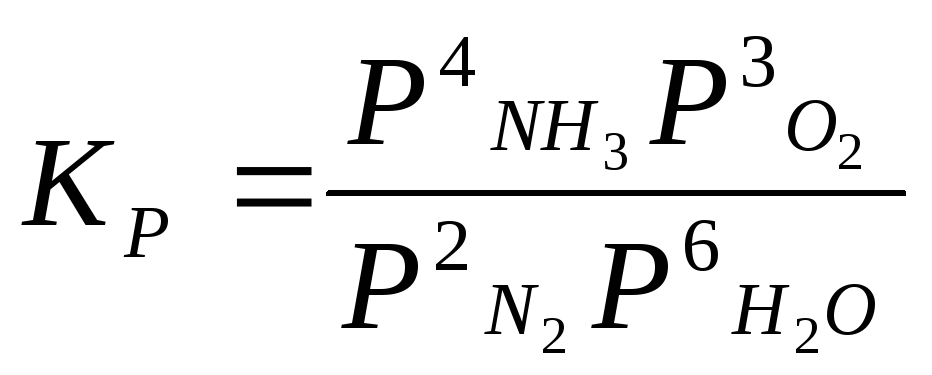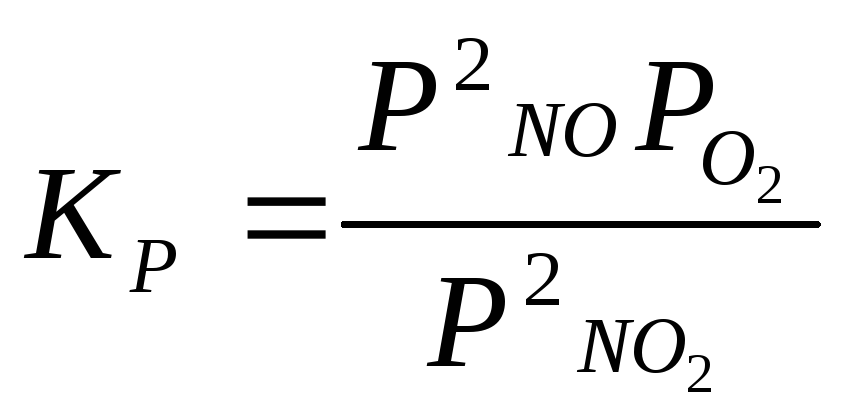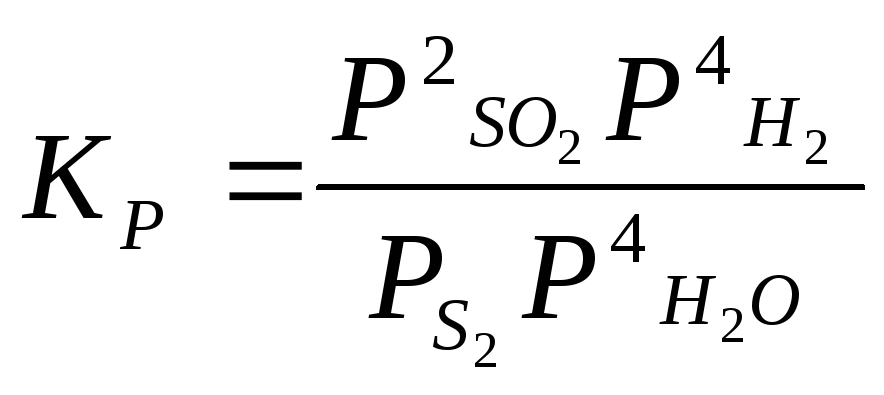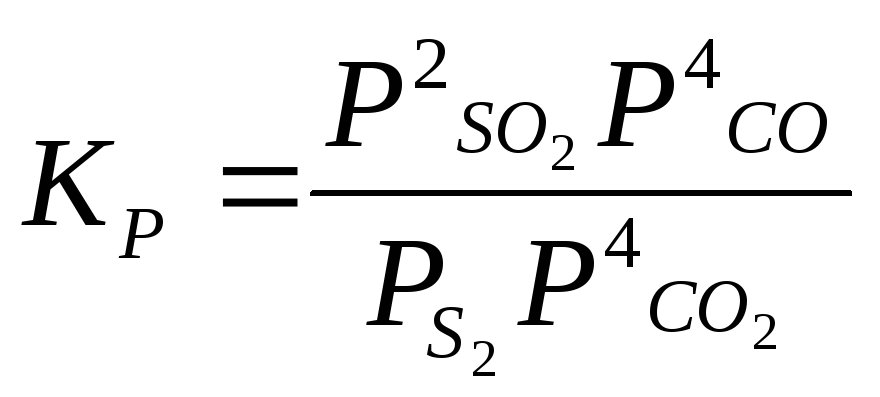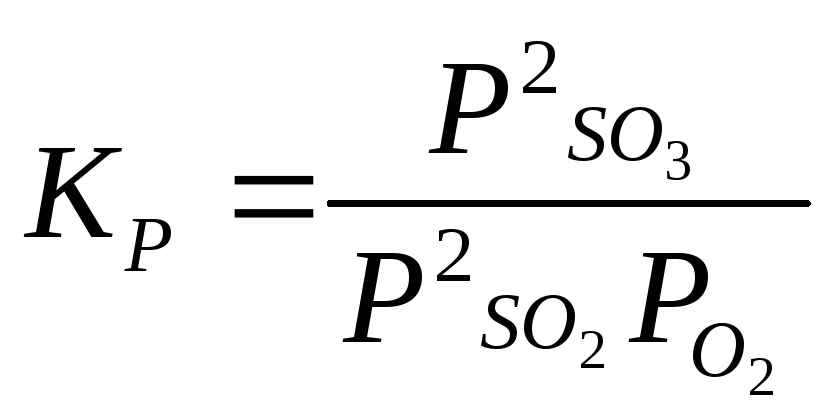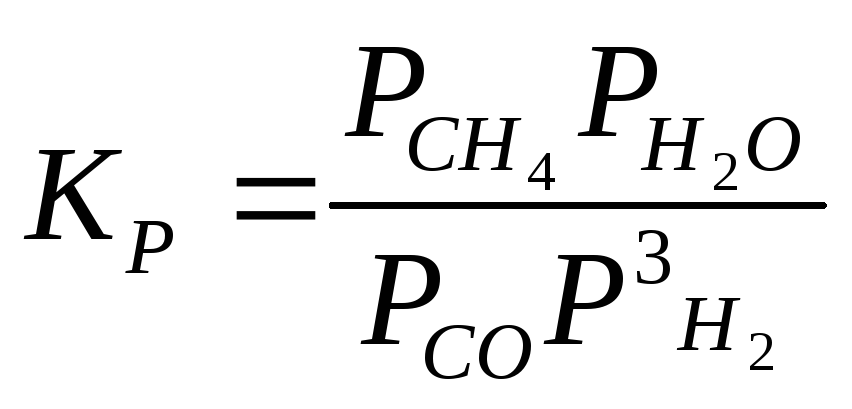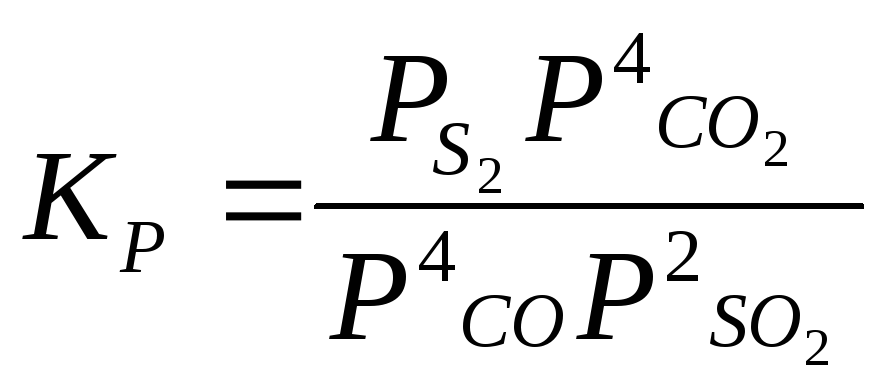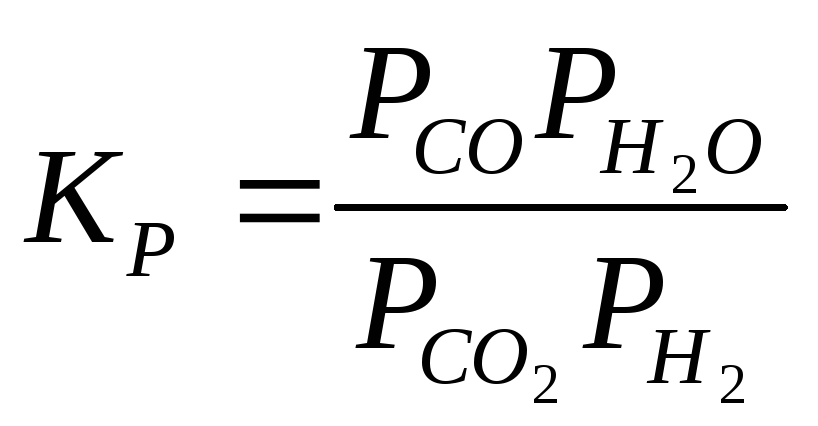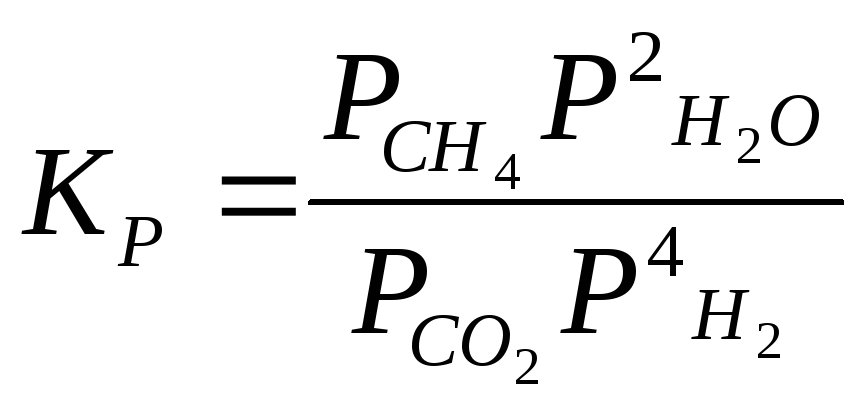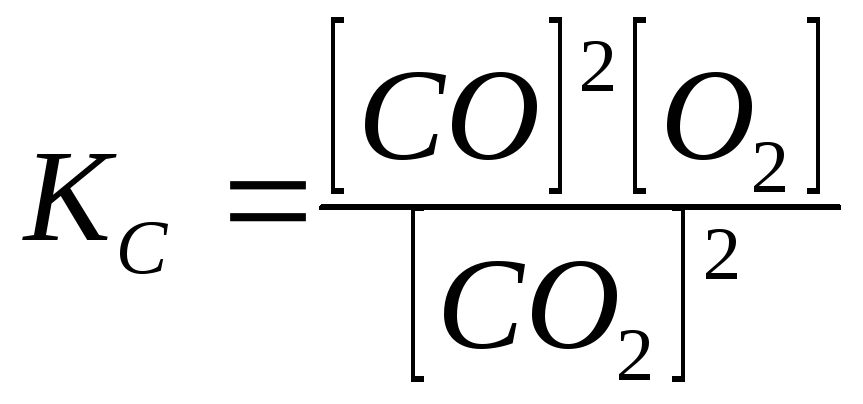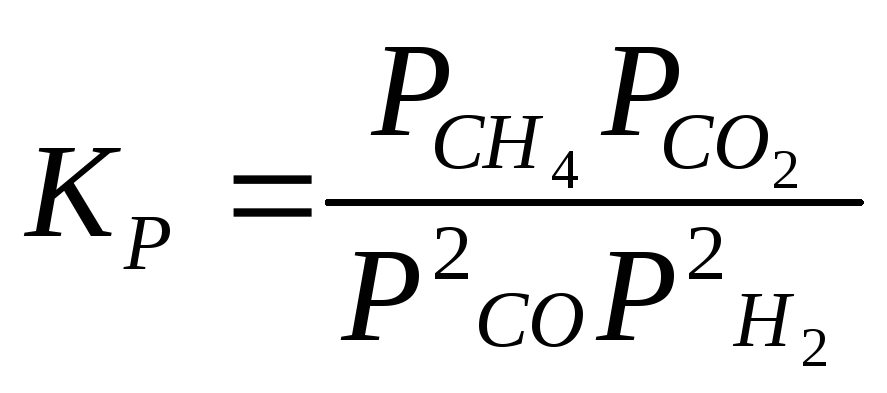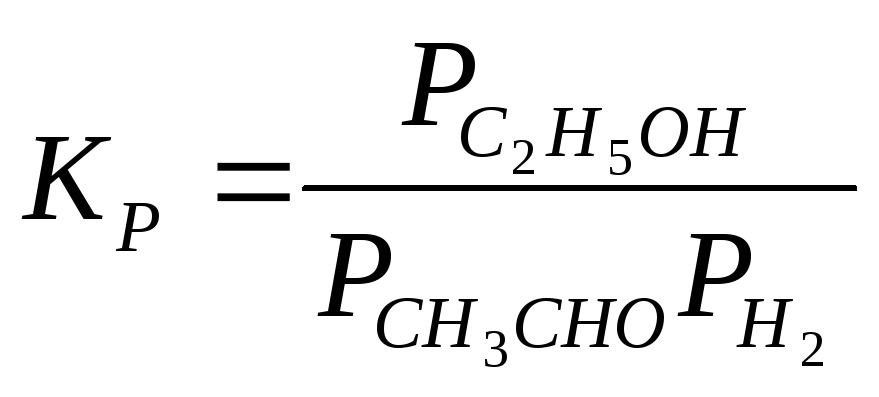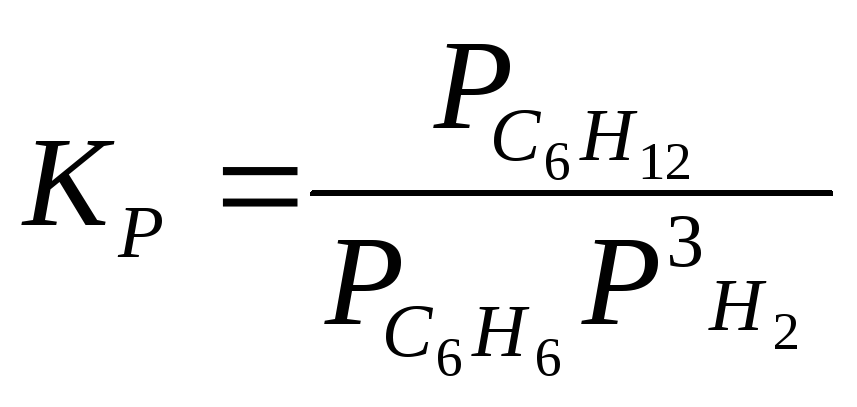Физхимия_студентам_1семестр / Домашние зад 1_семестр / Д_задан_9
.docДомашнее задание 9.
Химическое равновесие (часть 2).
1.
Зависимость константы равновесия
реакции (А)
от температуры выражается уравнением
![]() ;
коэффициенты a,
b,
c
приведены в таблице, давление выражено
в Па:
;
коэффициенты a,
b,
c
приведены в таблице, давление выражено
в Па:
-
определите константу равновесия реакции (А) при Т, К;
-
построй те график lg K = f (T-1) в пределах температур от (Т - 100) до (Т + 100) К;
-
укажите, как изменяется константа равновесия при повышении температуры;
-
определите тепловой эффект реакции (А) Н0Т при Т, К.
|
№ варианта |
Реакция А |
К |
Т, К |
|
1 |
2H2 + CO CH3OH |
|
800 |
|
2 |
4НС1 + О2 2Н2О + 2С12 |
|
750 |
|
3 |
-NH4C1 NH3 + HC1 |
|
455 |
|
4 |
2N2 + 6H2О 4NH3 + 3О2 |
|
1300 |
|
5 |
4NO + 6N2O 4NH3 +5О2 |
|
1000 |
|
6 |
2NO2 2NO + O2 |
|
700 |
|
7 |
N2O4 2NO2 |
|
400 |
|
8 |
Mg(OH)2 MgO + H2О |
|
400 |
|
9 |
СаСО3 СаО + СО2 |
|
1000 |
|
10 |
Ca(OH)2 CaO + H2O |
|
500 |
|
11 |
S2 + 4H2О 2SО2 + 4H2 |
|
1000 |
|
12 |
S2+ 4CО2 2SО2 + 4CO |
|
900 |
|
13 |
2SO2 + O2 2SO3 |
|
700 |
|
14 |
SO2 + Cl2 SО2Cl2 |
|
400 |
|
15 |
CO + 3H2 CH4+H2O |
|
1000 |
|
16 |
4CO + 2SО2 S2+4CО2 |
|
900 |
|
17 |
COC12 CO+C12 |
|
400 |
|
18 |
СО2 + Н2 СО + Н2О |
|
1200 |
|
19 |
СО2 + 4Н2 СН4 + 2Н2О |
|
1000 |
|
20 |
2СО2 2СО + О2 |
|
700 |
|
21 |
2СО + 2Н2 СН4 + СО2 |
|
900 |
|
22 |
C2H6 C2H4 + Н2 |
|
400 |
|
23 |
С2Н5ОН С2Н4 + Н2О |
|
400 |
|
24 |
СН3СНО + Н2 С2Н5ОН |
|
500 |
|
25 |
С6Н6 + 3Н2 С6Н12 |
|
600 |
|
№ варианта |
a |
b |
c |
d |
|
1 |
3724 |
-9,1298 |
0,00308 |
3,401 |
|
2 |
5750 |
-2,136 |
-0,000857 |
-4,710 |
|
3 |
-9,650 |
1,83 |
-0,00324 |
28,239 |
|
4 |
-66250 |
1,75 |
0 |
-10,206 |
|
5 |
-47500 |
1,75 |
0 |
-13,706 |
|
6 |
-5749 |
1,75 |
-0,0005 |
7,809 |
|
7 |
-2692 |
1,75 |
-0,00483 |
1,944 |
|
8 |
-4600 |
0,623 |
-0,00102 |
17,776 |
|
9 |
-9680 |
-1,385 |
-0,000219 |
17,756 |
|
10 |
-5650 |
0,67 |
0,000414 |
9,616 |
|
11 |
-13810 |
-0,877 |
0,00267 |
8,386 |
|
12 |
-2300 |
4,34 |
-0,00162 |
2,567 |
|
13 |
10373 |
1,222 |
0 |
-18,806 |
|
14 |
2250 |
-1,75 |
0,000455 |
-7,206 |
|
15 |
9874 |
-7,14 |
0,00188 |
-1,371 |
|
16 |
2300 |
-4,34 |
0,0000002 |
-2,576 |
|
17 |
5020 |
1,75 |
0 |
-3,748 |
|
18 |
-2203 |
0 |
-0,0000516 |
2,3 |
|
19 |
7674 |
-6,23 |
0,000906 |
-1,291 |
|
20 |
-29500 |
1,75 |
-0,001215 |
-3,29 |
|
21 |
11088 |
3,113 |
-0,0028524 |
-1,483 |
|
22 |
-6365 |
2,961 |
-0,000766 |
-2,344 |
|
23 |
-1485 |
7,54 |
-0,00425 |
7,006 |
|
24 |
1522 |
5,42 |
-0,00229 |
-2,810 |
|
25 |
9590 |
-9,9194 |
0,002285 |
-6,452 |
2. Для данной реакции, используя справочные данные, определите: 1) стандартное сродство при температуре Т, К; 2) равновесный выход вещества D при общем давлении 1,0133-105 Па и Т, К, если газообразные вещества А и В введены в реакционный сосуд в стехиометрических количествах; 3) изменение энергии Гиббса для начального момента реакции, если исходные парциальные давления газов в реакционной смеси равны РА, РВ, РС, РD и реакция протекает идеально обратимо при температуре Т, К.
|
№ ва-рианта |
Реакция |
A |
B |
C |
D |
Р10-4, Па |
T, K |
|||
|
А |
В |
С |
D |
|||||||
|
1 |
Н2 + ½О2 Н2О |
Н2 |
О2 |
- |
Н2О |
7 |
6 |
- |
3 |
1000 |
|
2 |
Н2 + ½О2 Н2О |
Н2 |
О2 |
- |
Н2О |
2 |
1 |
- |
2 |
700 |
|
3 |
Н2 + Сl2 2НCl |
Н2 |
Сl2 |
- |
HCl |
4 |
3 |
- |
1,5 |
900 |
|
4 |
2НCl + О2 Cl2 + Н2О |
HCl |
О2 |
Сl2 |
Н2О |
4 |
3 |
1,5 |
1,5 |
1000 |
|
5 |
2НCl + О2 Cl2 + Н2О |
HCl |
О2 |
Сl2 |
Н2О |
1 |
4 |
2 |
1 |
700 |
|
6 |
½N2 + 3/2H2 NH3 |
N2 |
Н2 |
- |
NH3 |
10 |
15 |
- |
10 |
600 |
|
7 |
½N2 + 3/2H2 NH3 |
N2 |
Н2 |
- |
NH3 |
20 |
20 |
- |
10 |
800 |
|
8 |
½N2 + 1/2O2 NO |
N2 |
О2 |
- |
NO |
2 |
1 |
- |
0,3 |
2000 |
|
9 |
N2 + O2 2NO |
N2 |
О2 |
- |
NO |
4 |
1 |
- |
1 |
1000 |
|
10 |
NO2 NO + 1/2O2 |
NO2 |
- |
NO |
О2 |
6 |
- |
2 |
3 |
460 |
|
11 |
NO2 NO + 1/2O2 |
NO2 |
- |
NO |
О2 |
3 |
- |
3 |
3 |
400 |
|
12 |
N2O4 2NO2 |
N2O4 |
- |
- |
NO2 |
5 |
2 |
2 |
2 |
340 |
|
13 |
N2O4 2NO2 |
N2O4 |
- |
- |
NO2 |
2 |
- |
- |
2 |
320 |
|
14 |
SO2 + 1/2O2 SO3 |
SO2 |
О2 |
- |
SO3 |
3 |
1 |
- |
1,5 |
900 |
|
15 |
SO2 + NO2 SO3 + NO |
SO2 |
NO2 |
SO3 |
NO |
6 |
3 |
1,5 |
1,2 |
700 |
|
16 |
PCl3 + Cl2 PCl5 |
PCl3 |
Сl2 |
- |
PCl5 |
3 |
6 |
- |
2 |
500 |
|
17 |
CO + H2O CO2 + H2 |
CO |
Н2О |
CO2 |
Н2 |
5 |
2 |
0,7 |
1,6 |
1000 |
|
18 |
CO + Cl2 COCl2 |
CO |
Сl2 |
- |
COCl2 |
2 |
3 |
- |
0,5 |
900 |
|
19 |
CO + 2H2 CH3OH |
CO |
Н2 |
- |
CH3OH |
4 |
3 |
- |
1,6 |
570 |
|
20 |
CO + 1/2O2 Û CO2 |
CO |
O2 |
- |
CO2 |
4 |
6 |
- |
3 |
1000 |
|
21 |
CH4 + H2O CO + 3H2 |
CH4 |
Н2О |
CO |
Н2 |
2 |
3 |
0,8 |
0,7 |
500 |
|
22 |
3C2H4 C6H6 + 3H2 |
C2H4 |
- |
C6H6 |
Н2 |
2 |
- |
0,7 |
3 |
700 |
|
23 |
C2H4 + H2 C2H6 |
C2H4 |
Н2 |
- |
C2H6 |
7 |
8 |
- |
3 |
780 |
|
24 |
C2H4 + H2O C2H5OH |
C2H4 |
Н2О |
- |
C2H5OH |
3 |
2 |
- |
1,2 |
480 |
|
25 |
C6H6 + 3H2 C2H12 |
C6H6 |
Н2 |
- |
C2H12 |
6 |
4 |
- |
2 |
600 |
3.
Ha
основании справочных данных
![]() и
Н0
определите
константу равновесия Кр
реакции
при температуре Т,
К.
и
Н0
определите
константу равновесия Кр
реакции
при температуре Т,
К.
|
№ вар-ианта |
Реакция |
Т, К |
№ ва-рианта |
Реакция |
Т, К |
|
1 |
Н2 + F2 = 2НF |
600 |
14 |
Н2 + ½ S2 = Н2S |
500 |
|
2 |
Н2 + Cl2 = 2НCl |
800 |
15 |
PCl3 + Cl2 = PCl5 |
1000 |
|
3 |
Н2 + Br2 = 2НBr |
800 |
16 |
C(гр.) + 2H2 = CH4 |
1500 |
|
4 |
Н2 + J2 = 2НJ |
1000 |
17 |
C2H2 + H2 = C2H4 |
500 |
|
5 |
Н2 + ½О2 = Н2О |
1500 |
18 |
C3H6 + H2 = C3H8 |
800 |
|
6 |
CO + ½О2 = CO2 |
1000 |
19 |
C4H8 = C4H6 + H2 |
1500 |
|
7 |
CO + Cl2 = COCl2 |
800 |
20 |
C4H8 + H2 = C4H10 |
1000 |
|
8 |
C(гр.) + S2 = CS2 |
1000 |
21 |
C6H6 + 3H2 = C6H12 |
500 |
|
9 |
N2 + О2 = 2NО |
500 |
22 |
CO + 2H2 = CH3OH |
800 |
|
10 |
NO2 = NО + ½О2 |
800 |
23 |
HCHO + H2 = CH3OH |
500 |
|
11 |
N2 + 3H2 = 2NH3 |
1200 |
24 |
CHCl3 + Cl2 = CCl4 + HCl |
1000 |
|
12 |
S2 + 2O2 = 2SO2 |
8000 |
25 |
CH3Cl + 2Cl2 = CHCl3 + 2HCl |
800 |
|
13 |
SO2 + ½O2 = SO3 |
1000 |
|
|
|
4.
Применяя принцип Ле Шателье и уравнений
 и
и
![]() ,
определите, как будет меняться равновесный
выход конечных продуктов реакции при:
а) повышении температуры; б) понижении
температуры; в) повышении давления; г)
понижении давления; д) добавлении
инертного газа.
,
определите, как будет меняться равновесный
выход конечных продуктов реакции при:
а) повышении температуры; б) понижении
температуры; в) повышении давления; г)
понижении давления; д) добавлении
инертного газа.
|
№ вар-ианта |
Реакция |
№ ва-рианта |
Реакция |
|
1 |
N2 + 3H2 = 2NH3 |
14 |
2SO2 + O2 = 2SO3 |
|
2 |
C + O2 = CO2 |
15 |
C2H4 + H2O = C2H5OH (ж) |
|
3 |
2CO2 = CO + O2 |
16 |
C2H6 = C2H4 + H2 |
|
4 |
C + 2H2 = CH4 |
17 |
2H2 + CO = CH3OH (ж) |
|
5 |
4H2 + 2SO2 = 4H2O(ж) + S2 (т) |
18 |
C2H5OH (ж) = C2H4 + H2O (г) |
|
6 |
2C + 2H2 = C2H4 |
19 |
4НCl + О2 = 2Н2О + 2Cl2 |
|
7 |
COCl2 = CO+ Cl2 |
20 |
2CO + 2H2 = CH4 + CO2 |
|
8 |
2НJ = Н2 + J2 |
21 |
2NO + O2 = 2NO2 |
|
9 |
2CO + O2 = 2CO2 |
22 |
C2H4 + H2 = C2H6 |
|
10 |
2H2O(ж) = 2H2 + Щ2 (т) |
23 |
2Н2O (г) + 2Сl2 = 4НCl + O2 |
|
11 |
CO + Cl2 = COCl2 |
24 |
NH4Cl (т) = NH3 + HCl |
|
12 |
N2O4 = 2NO2 |
25 |
CH3CHO (г) + H2 = C2H5OH |
|
13 |
NO2 = 2NО+ О2 |
|
|