
Теоретическое
введение
Поляризуемость
и ее составляющие
Если молекулу
поместить в электрическое поле (например,
между обкладками конденсатора), то
внутри молекулы произойдут определенные
изменения. Электроны смещаются в сторону
положительной обкладки конденсатора,
в то время как ядра атомов смещаются к
положительной обкладке. Теперь центры
тяжести положительных и отрицательных
зарядов в молекулах не совпадают, и
возникает электрический дипольный
момент. Этот дипольный момент, возникший
под действием внешнего электрического
поля, называется индуцированным
дипольным моментом - инд
и рассчитывается по формуле:
инд =
д
0Е (1),
где Е – величина
напряженности электрического поля
внутри вещества ( это сумма напряженностей
внешнего поля и поля, возникающего в
веществе под действием внешнего поля);
0
– диэлектрическая проницаемость
вакуума;
д
– коэффициент пропорциональности,
который называют деформационной
поляризуемостью.
Величина д
показывает, насколько сильно деформируются
электронные оболочки и связи в молекулах
под действием внешнего поля.
Поскольку при
наложении внешнего электрического
поля смещаются как электроны, так и
ядра атомов, то деформационная
поляризуемость включает две составляющие:
электронную поляризуемость эл
и атомную поляризуемость ат:
д =эл
+ ат (2).
Электронная
поляризуемость зависит от смещения
электронов, атомная поляризуемость
зависит от смещения ядер и атомных
групп. С увеличением радиуса частиц
величина электронной поляризуемости
возрастает, т.к. электроны внешних
оболочек слабее удерживаются ядром и
сильнее смещаются. Смещение атомных
ядер, более тяжелых по сравнению с
электронами, относительно невелико,
поэтому ат
составляет 5-10% от эл.
Следовательно, можно принять, что д
~
эл
(3).
Если молекула
обладает собственным дипольным моментом,
т.е. полярна, то во внешнем электрическом
поле ее дипольный момент увеличивается
на величину инд.
Кроме того, молекула разворачивается
по направлению силовых линий электрического
поля. Такое ориентирование по полю всех
молекул вещества приводит к изменению
состояния вещества и появлению новой
составляющей поляризуемости ор:
ор
= 2/3kT (4),
где
– собственный дипольный момент полярной
молекулы;
k – постоянная
Больцмана.
Как следует из
формулы (4), ориентационная поляризуемость
зависит от температуры, поэтому ор
= 0 в
отсутствие внешнего поля, поскольку
тепловое движение молекул препятствует
их упорядоченной ориентации. Полная
поляризуемость является суммой всех
составляющих:
эл
+ ат
+ ор
д
+ ор
эл
+
ор.
Молярная
поляризация
Во внешнем
электрическом поле (а также и
электромагнитном) молекулы вещества
поляризуются и поле внутри вещества
ослабляется в
раз. Величину
называют диэлектрической проницаемостью
вещества.
связана с полной поляризуемостью
уравнением Клаузиуса-Мосотти:
где N – число
молекул в единице объема. Если учесть,
что 1 моль вещества содержит NА
молекул (число Авогадро), то
где Vm
– объем одного моля вещества. Т.к. Vm
= M/d – где
M – молярная масса, d – плотность вещества
(г/см3)
– то
Тогда уравнение
(5) можно преобразовать:
Функция Р
называется молярной поляризацией и
имеет размерность см3/моль.
Она характеризует суммарное изменение
электрического состояния вещества во
внешнем электрическом поле. Величина
Р
в общем случае является полной
поляризацией Р
и имеет те же составляющие, что и полная
поляризуемость :
Полная поляризуемость
наблюдается только в постоянных полях
и полях низкой частоты. В полях высокой
частоты диполи не успевают принимать
соответствующие ориентиры, и поэтому
ориентационная составляющая исчезает
(Рор
0). Кроме этого, атомная поляризация
тоже перестает проявляться, т.к. отдельные
атомные группы в молекуле тоже не
успевают смещаться друг относительно
друга вместе с внешним полем (Рат
0). Таким образом, поляризация вещества
будет происходить, в основном, за счет
смещения электронов, которые успевают
смещаться относительно ядра с той же
скоростью, что и частота внешнего поля.
Следовательно, когда на вещество падает
видимый свет, который представляет
собой электромагнитные колебания
высокой частоты, то можно считать, что
Р
Рэл.
Рефракция
Для прозрачных
неполярных веществ электромагнитная
теория Максвелла приводит к соотношению
= п2.
Тогда, если
поляризация таких веществ происходит
за счет действия видимого света,
уравнение (6) можно преобразовать:
Величину R называют
молярной рефракцией вещества. Она имеет
размерность поляризации, т.е. см3/моль.
По физическому смыслу рефракция равна
электронной поляризации вещества в
полях высокой частоты. Уравнение (8) в
виде
было выведено
также из электромагнитной и волновой
теорий света независимо Г.Лоренцем и
Л. Лоренцем.
Как следует из
уравнений (7) и (8)
т.е. величина
молярной рефракции для лучей видимой
части спектра определяется только
электронной поляризуемостью и не
зависит от температуры и агрегатного
состояния вещества.
Аддитивность
рефракции.
Значение молекулярной
рефракции можно рассчитать по правилу
аддитивности:
R = Rат
+ Rсв (11),
где Rат
– атомные рефракции, Rсв
– рефракции связей (инкременты связей).
Например, для хлористого аллила СН2
= СН - СН2Cl:
R
= 3RC
+ 5RH
+ RCl
+ RC=C.
Сопоставление
наблюдаемой рефракции (которая
определяется уравнениями (8), (9)) с
вычисленной по аддитивным схемам
является одним из старейших физических
методов определения строения химических
соединений. Этим методом можно получить
подтверждение брутто-формулы, а также
информацию о числе и расположении
функциональных групп, циклов, кратных
связей. Например, вещество имеет
брутто-формулу С3Н6О
наблюдаемая рефракция равна 15,98 см3/моль.
Предполагаемые структуры могут быть
следующими:
СН3
- СО -СН3
1 или СН2
= СН - СН2 -
ОН 2
Расчет величины
рефракций для этих структур по правилу
аддитивности даст:
R1
= 3RC
+
6RH
+ RO
=
3
.
2,413 + 6 .
1,092 + 2,189 = 15,968 cм3/моль
R2
= 3RC
+ 6RH
+ RO
+ RC=С
= 3 .
2,413 + 6
. 1,092
+ 1,522 + 1,686 = 17,00 см3/
моль.
(Обратите внимание,
что в R1
используется рефракция карбонильного
кислорода, а в R2
- гидроксильного). Из сравнения наблюдаемой
и вычисленных рефракций вытекает, что
неизвестному веществу соответствует
структура
1
и действительно имеет брутто-формулу
С3Н6О.
Рефрактометрический
анализ бинарных смесей.
В основе
рефрактометрического метода анализа
лежит изучение зависимости показателя
преломления раствора от его состава
при постоянной температуре. Эти
зависимости носят название изотерм
показателя преломления. По их виду
можно судить о характере межмолекулярных
взаимодействий в бинарной смеси.
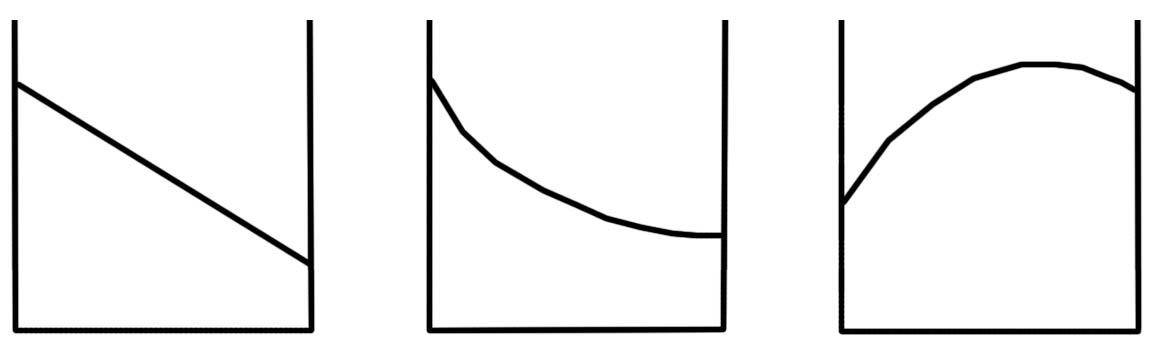
Различают три основных типа изотерм.
I
II
III
100%A 100%B
100%A
100%B
100%A
100%B
Тип I. Изотермы
прямые или с незначительной кривизной.
Такой ход изотерм соответствует
идеальным системам с одинаковым
взаимодействием между всеми молекулами
(вещества неполярны или являются
гомологами).
Тип II. Изотермы
имеют значительную кривизну и обращены
выпуклостью к оси концентраций. В данном
случае система неидеальна или наблюдается
сильная диссоциация одного из компонентов.
Тип III. Кривые с
максимумами, соответствуют системам
с образованием химического соединения
определенного состава (например, 70% В
и 30% А).
Таким образом,
рефрактометрический метод является
одним из методов физико-химического
анализа, позволяющего изучать характер
взаимодействия в бинарных смесях. Для
третьего типа изотерм положение
максимума дает возможность определить
количественный состав образующегося
химического соединения. По изотермам
типа I можно проводить количественный
анализ смесей, т.е. определять концентрацию
смеси, пользуясь изотермой, как
калибровочной прямой.
Необходимо
определить молярную рефракцию чистых
веществ по формуле (9). Для этого измеряют
показатель преломления на рефрактометре,
плотности находят в справочнике. Затем
следует рассчитать рефракцию этих
веществ по правилу аддитивности (11) и
сравнить результаты расчета и опыта.
(Рефракции атомов и инкременты связей
находят из справочника). Измерение
показателя преломления проводят по
следующей методике.
1. Перед началом
работы поверхности обеих призм
рефрактометра осторожно протирают
мягкой тряпочкой или фильтровальной
бумагой, затем наносят 1-2 капли
исследуемого вещества. Плоскости обеих
призм прижимают друг к другу, и жидкость
растекается между ними тонким слоем
(0,1- 0,2 мм). Включают источник света и
поворачивают призмы с помощью винта
до тех пор, пока в окуляре граница
раздела света и тени не совпадет с
перекрестием нитей. После этого по
шкале рефрактометра производят отсчет
показателя преломления (до тысячных
долей). По окончании измерения поверхности
призм протирают ваткой со спиртом или
эфиром и оставляют для сушки 1-2 минуты.
Результаты измерений показателя
преломления, значения опытной и расчетной
рефракций заносят в таблицу. Приводят
справочные данные плотности, рефракций
атомов и связей.
Рассчитать молярную
рефракцию вещества, основываясь на
измеренном показателе преломления и
на экспериментально определенной
плотности (по уравнению 9).
Плотность выбранного
вещества определяют пикнометрическим
способом. Для этого пикнометр, тщательно
вымытый, взвешивают на аналитических
весах. Затем заполняют его до метки
исследуемой жидкостью и вновь взвешивают.
Жидкость выливают, высушивают пикнометр,
заполняют дистиллированной водой,
взвешивают.
Плотность определяют
по формуле:
где
Задание 3
Рефрактометрическое
исследование бинарной смеси
Измерить показатели
преломления смеси растворов. Построить
изотерму показателей преломления в
зависимости от состава растворов.
Составы растворов указаны в объемных
процентах, необходимо сделать перерасчет
в мольные проценты.
Например, имеется
раствор уксусной кислоты с объемным
содержанием воды 40%. Тогда в 100 мл смеси
содержится 40 мл Н2О
и 60 мл СН3СООН.
Находим их массы
по плотности:
m(Н2О)
= V(Н2О)
.
d(Н2О)
= 40 г;
m(СН3СООН)
= V(СН3СООН)
.
d(СН3СООН)
= 60 .
1,049 = 62,9г;
Находим количества
вещества:
Тогда мольные
доли веществ в смеси:
По виду изотермы
сделать вывод о характере межмолекулярных
взаимодействий в смеси и ее идеальности.
Задание 4
Определение по
величине рефракции формулы вещества
В задании
предлагается определить, какое именно
вещество из двух веществ вам выдано
(или состав бинарной смеси). Для этого
необходимо измерить показатель
преломления вещества и, используя
справочные данные плотности, определить
его молекулярную рефракцию. Затем
сравните опытные и расчетные (по правилу
аддитивности) значения рефракций и
сделайте выбор (или определить состав
смеси по калибровочному графику
показатель преломления – состав
растворов).
Контрольные
вопросы
1.Что такое
поляризуемость и отчего она зависит?
Ее составляющие.
Что представляет
собой поляризация? Каковы ее составляющие?
Назовите факторы, влияющие на величину
поляризации.
Что такое рефракция?
От чего зависит ее величина? Какие
заключения о структуре вещества можно
сделать по величине его рефракции?
4.Какие выводы
можно сделать о характере взаимодействия
в бинарной системе по данным
рефрактометрического анализа?
Сделайте выводы
о строении веществ по следующим данным: № Брутто-формула Плотность
(г/мл) Показатель
преломления 1 С10Н16О 2 С8Н12О 3 С10Н16 4 С3Н6О 5 С5Н8 6 С6Н11Cl 7 С6Н11ОBr
6. Сколько двойных
связей содержит вещество С6Н10,
если
Сколько колец и
двойных связей имеет соединение С6Н9Br
(
Содержит ли
углеродное кольцо вещество состава
С4Н6Cl2,
имеющее
П. Эткинс “Физическая
химия”, т.2.
Б.П. Никольский
и др. “Физическая химия”. М.: Химия. -
1987. - С.212- 213.
8Лабораторная работа № 6 Определение молярной рефракции
![]() (5)
(5)![]() ,
,![]() .
.![]() (6).
(6).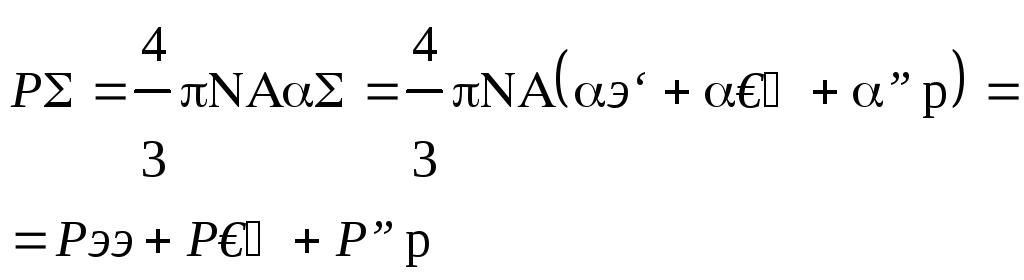 (7)
(7)![]() (8)
(8)![]() (9)
(9)![]() (10),
(10),
Выполнение работы
Задание 1
Задание 2.
![]()
![]() - вес пустого пикнометра;
- вес пустого пикнометра;![]() - вес пикнометра
с исследуемой жидкостью;
- вес пикнометра
с исследуемой жидкостью;![]() - вес пикнометра
с водой;
- вес пикнометра
с водой;![]() - плотность воды
при температуре измерения (по справочнику);
- плотность воды
при температуре измерения (по справочнику);0,0012 - Плотность воздуха.
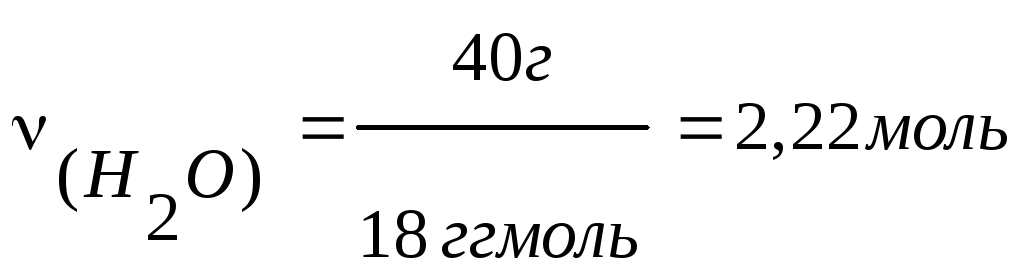
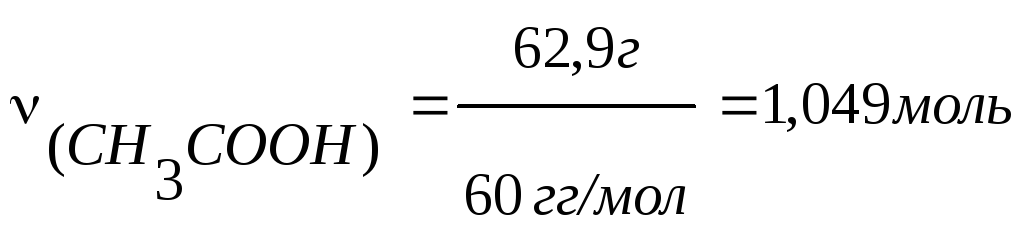
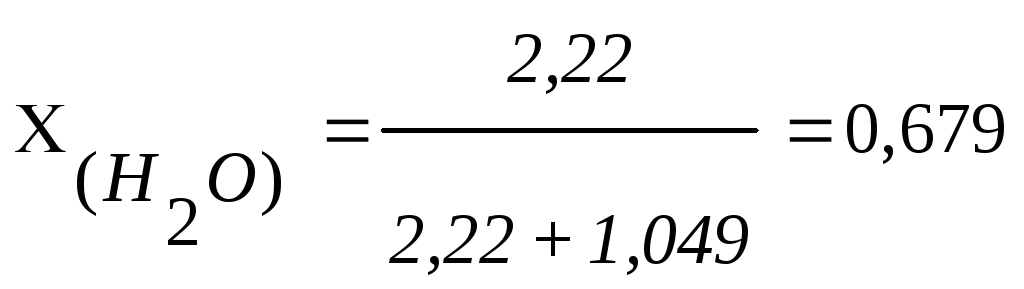 (или 67,9 мольных
%)
(или 67,9 мольных
%)![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ;
;
![]() ?
?![]() ;
;![]() )?
)?![]() ;
;
![]() ?
?Литература
1
2
7
3
6
4
5
