- •3. Класифікація хімічних реакцій та реагентів. Взаємний вплив атомів в органічних сполуках
- •1. Класифікація органічних реакцій за типом перетворень органічних сполук:
- •2. Класифікація органічних реакцій за типом розриву хімічних зв’язків.
- •3. Класифікація органічних реакцій за типом взаємодіючих реагентів.
- •4. Взаємний вплив атомів в молекулах.
- •Література до теми лекції.
- •1. Самостійна робота.
- •2. Основна література.
- •3. Додаткова література.
3. Класифікація хімічних реакцій та реагентів. Взаємний вплив атомів в органічних сполуках
Основні способи класифікації органічних реакцій:
за типом перетворень органічних сполук;
за типом розриву хімічних зв’язків;
за типом взаємодіючих реагентів.
1. Класифікація органічних реакцій за типом перетворень органічних сполук:
1.1. Реакції заміщення S (Substitution), характерні для алканів (насичених вуглеводнів):
![]()
За механізмом реакція може бути: SE – електрофільного заміщення; SN – нуклеофільного заміщення та SR – радикального заміщення.
1.2. Реакції приєднання А (Addition), характерні, наприклад, для алкенів і алкінів (ненасичених вуглеводнів):
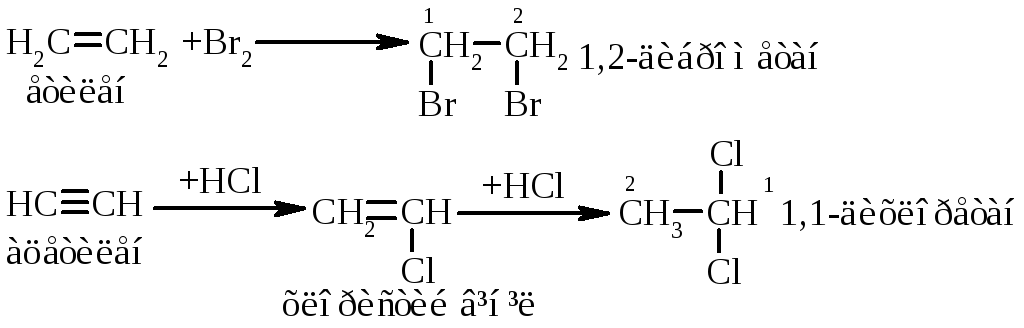
За механізмом реакція може бути: АE – електрофільного приєднання; АN – нуклеофільного приєднання та АR – радикального приєднання.
1.3. Реакції відщеплення (елімінування) Е (Elimination), наприклад:
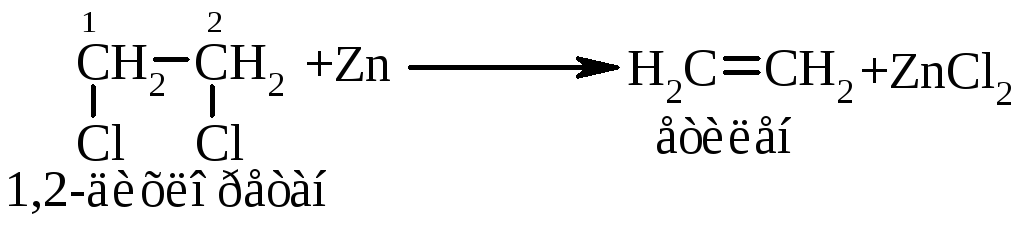
1.4. Реакції дисоціації та рекомбінації, наприклад:
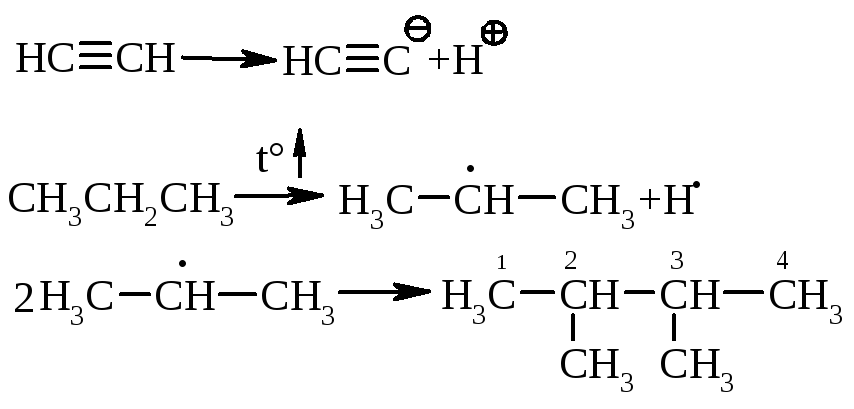
1.5. Реакції окиснення (Oxygenation) та відновлення (Reduction), наприклад:
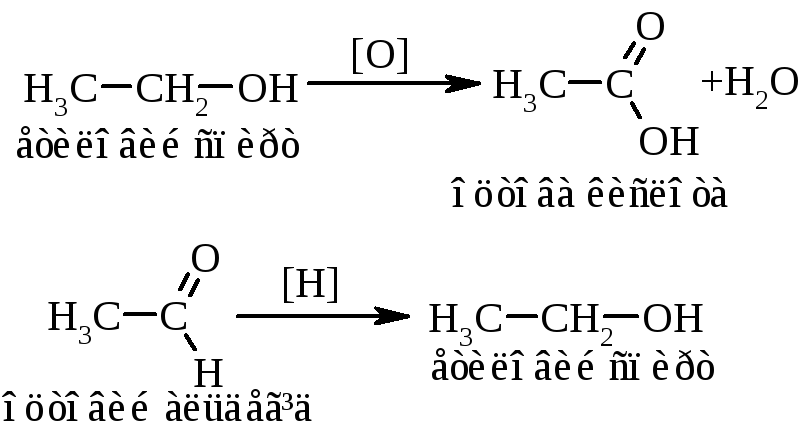
1.6. Реакції ізомеризації (Isomerisation) та перегрупування (Rearangement), наприклад:
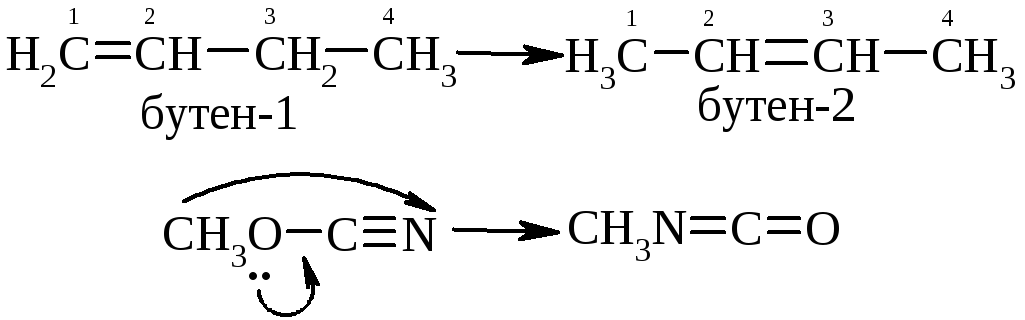
1.7. Реакції полімеризації, які мають велике практичне значення, наприклад:
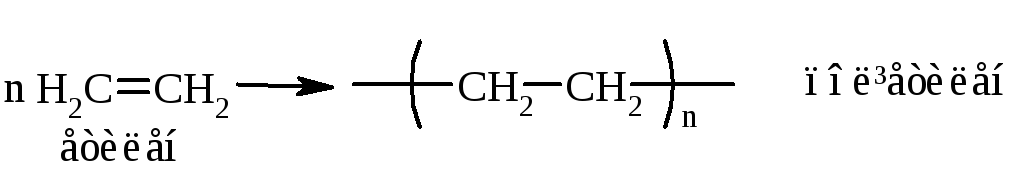
Відмічені типи реакцій можуть здійснюватись із збереженням або зміною числа атомів карбону в вуглеводневому ланцюзі.
2. Класифікація органічних реакцій за типом розриву хімічних зв’язків.
2.1. Реакції гомолітичного (радикального) розриву хімічного зв’язку (гомоліз)супроводжуються утворенням вільних радикалів:
![]()
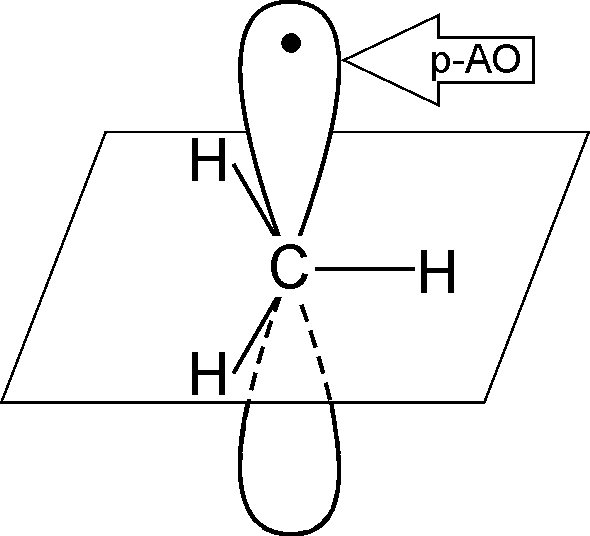
Вільний радикал – це незаряджена частинка, яка має неспарений електрон (одноелектронну атомну орбіталь):
|
метил-радикал |
у випадку первинних алкільних радикалів неспарений електрон знаходиться на р-АО, що визначає його площинну будову. |
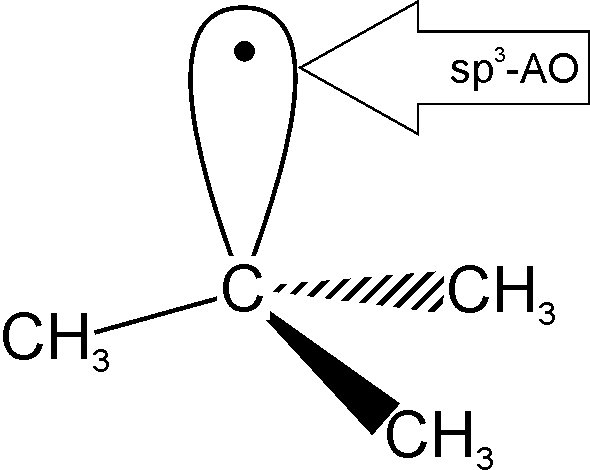
трет-бутил-радикал |
у випадку третинних алкільних радикалів неспарений електрон знаходиться на sp3-гібридизованій АО, що визначає його тетраедричну будову. | ||
|
Для радикальних реакцій є характерним:
|
| ||||
|
| ||||
висока залежність хімічних перетворень від просторових ефектів.
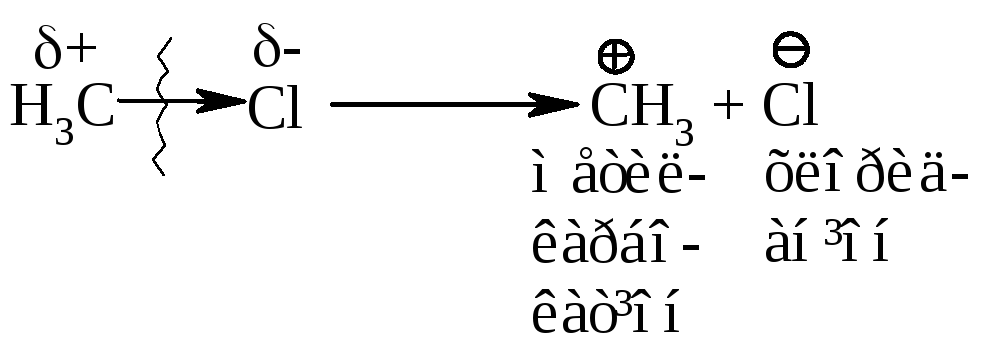
2.2. Реакції гетеролітичного (іонного) розриву хімічного зв’язку (гетероліз) супроводжуються утворенням іонів:
|
|
утворюються протилежно заряджені іони: катіон (+) та аніон (-). | |||
|
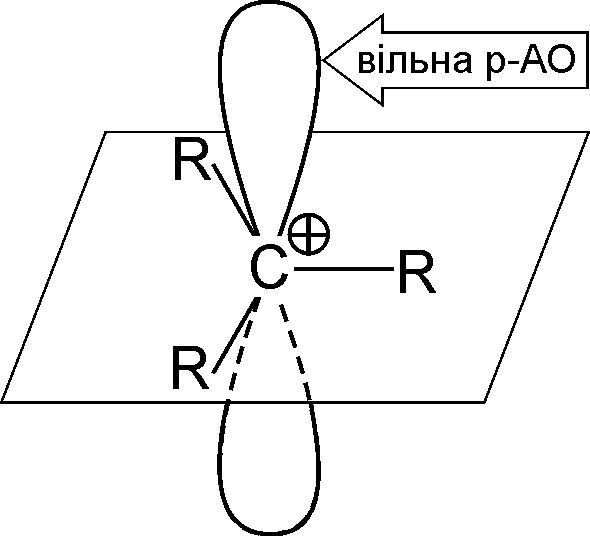
карбокатіон |
карбокатіон має позитивно заряджений атом карбону, який знаходиться в sp2-гібридному стані: три його -зв’язки розташовані в одній площині, а р-обріталь є вакантною (вільною); |
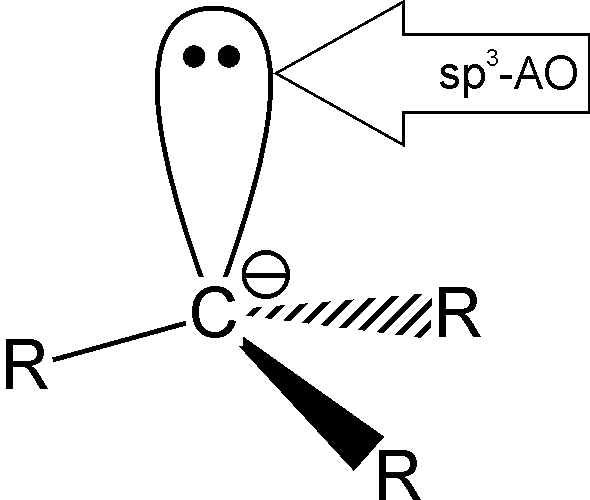
карбоаніон |
у випадку карбоаніонів ряду алканів неподілена пара електронів знаходиться на sp3-гібридизованій атомній орбіталі | |
|
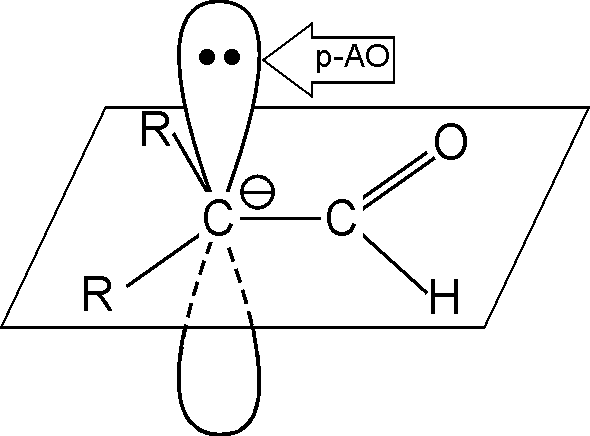
карбоаніон |
карбоаніонмає негативно заряджений атом карбону (заселену р-АО двома електронами). У сполуках, де неподілена пара електронів супряжена з кратним зв’язком, ця пара знаходиться на р-АО; | |||
Для гетеролітичних реакцій є характерним:
прискорення в присутності кислот або основ (кислотно-основний каталіз);
проходження взаємодії в розчинах;
відсутність впливу акцепторів (інгібіторів) вільних радикалів на швидкість реакції;
критична залежність швидкості реакції від типу розчинника;
реакції є моно- та бімолекулярними. Якщо в елементарній стадії реакції (послідовності взаємодії) бере участь одна молекула або частинка, то така реакція називається мономолекулярною, а якщо дві – то бімолекулярною. Молекулярність визначається тільки для окремої стадії реакції;
з кінетичної точки зору, реакції бувають 1го та 2го порядків. Порядок реакції визначається сумарним показником ступенів концентрацій реагуючих речовин в рівнянні, яка визначає загальну швидкість реакції. Якщо швидкість реакції залежить від концентрації лише одного компонента, то ми маємо реакцію 1го порядку, якщо від концентрації двох реагуючих речовин – то маємо реакцію 2го порядку.