
Пособие-репетитор по химии
ЗАНЯТИЕ 8 10-й класс (первый год обучения)
Растворы План
1.
Определение понятия «растворы».
2. Классификация растворов (по агрегатному состоянию, размерам частиц, природе растворителя, содержанию растворенного вещества).
3. Сущность процесса растворения.
4. Растворимость различных веществ. Зависимость растворимости от внешних факторов.
5. Способы выражения концентрации растворов (массовая доля, объемная доля, молярная концентрация и др.).
6. Значение растворов.
7. Понятие о коллоидах.
Растворы – это гомогенные системы, состоящие из двух или более компонентов и продуктов их взаимодействия. Один из этих компонентов является растворителем, остальные – растворенными веществами.
По агрегатному состоянию можно выделить твердые, жидкие и газообразные растворы. Среди них наиболее распространены жидкие растворы, которые в свою очередь могут быть трех видов: твердое в жидкости (раствор сахара в воде), жидкость в жидкости (раствор серной кислоты в воде) и газ в жидкости (раствор кислорода в воде).
По размерам частиц растворенного вещества растворы подразделяют на истинные (размер частиц < 1•10–9 м) и коллоидные (размер частиц от 1•10–9 до 1•10–7 м). Отдельно выделяют суспензии, в которых размер частиц растворенного вещества > 1•10–7 м.
В зависимости от природы растворителя выделяют водные растворы (растворитель – вода) и неводные растворы (растворители – бензин, эфир, бензол, толуол и т.д.).
По количеству растворенного вещества растворы подразделяют на ненасыщенные, насыщенные и пересыщенные. В ненасыщенном растворе при данных условиях может раствориться еще какое-то количество вещества; в насыщенном растворе содержится ровно столько вещества, сколько его может раствориться при данных условиях; пересыщенный раствор (в нем содержание растворенного вещества выше растворимости) готовят путем охлаждения насыщенного раствора. Пересыщенные растворы неустойчивы, при их хранении избыток растворенного вещества выпадает в осадок, и раствор становится насыщенным.
Растворение – сложный физико-химический процесс. Физическая его часть – это разрушение структуры растворяемого вещества и распределение его частиц между молекулами растворителя. Химическая сторона процесса растворения – взаимодействие молекул растворителя с частицами растворенного вещества. В результате этого взаимодействия образуются сольваты – продукты переменного состава.
Частный случай сольватов – гидраты (если растворителем является вода). Процесс образования сольватов называется сольватацией, процесс образования гидратов – гидратацией.
Гидраты некоторых веществ можно выделить в кристаллическом виде при выпаривании растворов. Кристаллические вещества, содержащие молекулы воды, называют кристаллогидратами: СuSО4•5H2О (медный купорос), FeSО4•7Н2О (железный купорос), Nа2SO4•10H2О (глауберова соль), Nа2CO3•10H2О (кристаллическая сода).
Впервые идею о химическом характере процесса растворения высказал Д.И.Менделеев в разработанной им химической (гидратной) теории растворов (1887). Доказательством физико-химического характера процесса растворения являются тепловые эффекты при растворении (выделение или поглощение теплоты). Тепловой эффект растворения равен сумме тепловых эффектов физического и химического процессов. Физический процесс протекает с поглощением теплоты, химический – с выделением. Если в результате сольватации выделяется больше теплоты, чем ее поглощается при разрушении структуры вещества, то растворение – экзотермический процесс (растворение NаОН, АgNО3, Н2SО4). Если при сольватации выделяется меньше теплоты, чем ее поглощается при разрушении структуры вещества, то растворение – эндотермический процесс (растворение NаNО3, КCl, NН4Сl).
Растворимость – величина, показывающая, сколько граммов вещества может раствориться в 100 г растворителя при данных условиях (или в 1000 мл растворителя). По растворимости в воде все вещества делятся на хорошо растворимые (более 10 г вещества на 1 л воды), малорастворимые (от 0,01 г до 10 г вещества на 1 л воды) и практически нерастворимые (менее 0,01 г вещества на 1 л воды). Растворимость веществ зависит от природы растворителя, природы растворенного вещества, температуры и давления (для газов). Растворимость большинства твердых веществ при повышении температуры увеличивается. Растворимость газов при повышении температуры уменьшается, а при повышении давления увеличивается.
Зная растворимость вещества при данных условиях, легко рассчитать его массовую долю в растворе, и наоборот.
Пример 1. Растворимость KNO3 при 30 °С составляет 450 г в 100 г воды. Отсюда массовая доля равна:
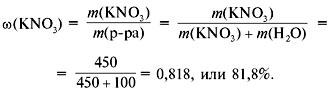
Пример
2.
При 30 °C ![]() (KNO3)
= 81,8%. Следовательно, в 100 г раствора
содержится 81,8 г KNO3 и
18,2 г H2O.
Составим пропорцию:
(KNO3)
= 81,8%. Следовательно, в 100 г раствора
содержится 81,8 г KNO3 и
18,2 г H2O.
Составим пропорцию:
81,8 г KNO3 – 18,2 г Н2О,
х г KNO3 – 10 г Н2О.
Отсюда растворимость соли KNO3 х = 450 г в 100 г H2O.
К основным типам выражения концентрации растворов можно отнести массовую долю, объемную долю и молярную концентрацию.
Массовой
долей ![]() растворенного
вещества называется отношение массы
растворенного вещества к массе раствора:
растворенного
вещества называется отношение массы
растворенного вещества к массе раствора:
![]()
Объемной долей j растворенного вещества называется отношение объема вещества к объему всего раствора:
![]()
Молярной концентрацией с называется отношение количества растворенного вещества (в моль) к объему раствора (в л):
![]()
Помимо перечисленных основных типов выражения концентрации растворов существуют и другие.
Мольная доля N – отношение количества растворенного вещества к сумме количеств всех веществ, находящихся в растворе:
![]()
Моляльная концентрация, или моляльность, m – отношение количества растворенного вещества к массе растворителя:
![]()
Нормальность н. или эквивалентная концентрация сн – отношение числа эквивалентов Э растворенного вещества к объему раствора:
![]()
Массовая
концентрация ![]() –
отношение массы растворенного вещества
к объему раствора:
–
отношение массы растворенного вещества
к объему раствора:
![]()
Титр раствора Т – масса растворенного вещества (г), содержащаяся в 1 мл раствора:
![]()
Растворы имеют огромное биологическое значение, поскольку являются средой для протекания сложных физико-химических процессов в живых организмах. Растворами являются физиологические жидкости – плазма крови, лимфа, желудочный сок и др. В медицине применяют водные растворы солей, которые по составу соответствуют плазме крови (физиологический раствор). Многие медицинские препараты являются растворами различных веществ в воде или спирте.
|
|
|
Желе, кисель, сироп – коллоидные растворы |
Велико также значение растворов в быту, промышленности и в технике.
Коллоидный раствор – высокодисперсная двухфазная система, состоящая из дисперсионной среды и дисперсной фазы, причем линейные размеры частиц последней лежат в пределах от 1 до 100 нм. Коллоид кажется однородной системой и занимает промежуточное положение между взвесью и истинным раствором. Примерами коллоидных растворов являются желе, кисель, пена, туман.

