
Пособие-репетитор по химии занятие 23
10-й класс (первый год обучения)
Железо и его соединения
П л а н
1.
Положение в таблице Д.И.Менделеева,
строение атома.
2. Происхождение названия.
3. Физические свойства.
4. Химические свойства.
5. Нахождение в природе.
6. Основные методы получения.
7. Важнейшие соединения железа.
• Оксид и гидроксид железа(II), их свойства. • Оксид и гидроксид железа(III), их свойства. • Смешанный оксид железа и его свойства.
8. Качественные реакции на ионы двух- и трехвалентного железа.
Железо находится в побочной подгруппе VIII группы периодической системы Д.И.Менделеева. Элементы данной подгруппы образуют два семейства: семейство железа (железо, кобальт, никель) и семейство платиновых металлов. Железо относится к d-элементам; его электронная формула: 1s22s2p63s2p6d 64s2. Атом железа содержит восемь валентных электронов, что объясняет широкий спектр возможных степеней окисления в соединениях: +2, +3, +4, +5, +6 и +8, например:
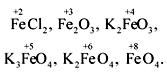
Наиболее характерные степени окисления +2 и +3.
По электроотрицательности железо занимает промежуточное значение между типичными металлами и неметаллами. Проявляет амфотерные свойства, металлические (основные) доминируют над неметаллическими (кислотными). В соединениях чаще находится в виде катиона, но может входить в состав аниона (реже), например:
Fe(NO3)2, K2FeO3.
Латинское название железа (Ferrum) связано, вероятно, с греко-латинским fars («быть твердым»), которое происходит от санскритского «меч»*.
Ф и з и ч е с к и е с в о й с т в а
Серебристо-белый,
пластичный, тугоплавкий металл, обладает
хорошей электро- и теплопроводностью,
является ферромагнетиком. Из-за большого
числа валентных электронов металлическая
связь в железе более прочная, чем в
щелочных, щелочно-земельных металлах
и в алюминии. Поэтому железо имеет более
высокие температуры кипения и плавления
по сравнению с этими металлами. Железо
относится к группе тяжелых металлов
(плотность 7,874 г/см3).
Для железа известны две аллотропные
модификации (![]() и
и ![]() ).
).
Х и м и ч е с к и е с в о й с т в а
Чистое железо химически устойчиво на воздухе и в воде, но «обычное» железо содержит примеси и во влажной атмосфере быстро ржавеет.
Железо находится в середине электрохимического ряда напряжений металлов, является металлом средней активности. Восстановительная способность железа увеличивается при нагревании; но при комнатной температуре железо не взаимодействует даже с самыми активными окислителями (галогенами, кислородом).
Н2 (–).
О2 (+):
4Fe
+ 3O2 ![]() 2Fe2O3.
2Fe2O3.
Металлы (–).
Неметаллы (+):
2Fe
+ 3Cl2 ![]() 2FeCl3,
2FeCl3,
Fe
+ S ![]() FeS,
FeS,
3Fe
+ C ![]() Fe3C,
Fe3C,
3Fe
+ 2P ![]() Fe3P2.
Fe3P2.
Н2О (+/–)** в присутствии кислорода или при очень высокой температуре:
4Fe + 3O2 + 6H2O = 4Fe(OH)3,
3Fe
+ 4H2O ![]() Fe3O4 +
4H2
Fe3O4 +
4H2![]() .
.
Основные оксиды (–).
Кислотные оксиды (–).
Основания (+/–) только при нагревании с концентрированными растворами щелочей:
2Fe
+ 6NaOH (конц.)
+ 6H2O
= 2Na3[Fe(OH)6]
+ 3H2![]() .
.
Кислоты-неокислители (+):
Fe
+ 2HCl = FeCl2 +
H2![]() .
.
Соли (+/–):
Fe + CuSO4 = Cu + FeSO4,
Fe
+ NaCl ![]() реакция
не идет.
реакция
не идет.
Кислоты-окислители (+/–):
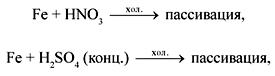
Fe
+ 6HNO3 (конц.) ![]() Fe(NO3)3 +
3NO2
Fe(NO3)3 +
3NO2![]() +
3H2O,
+
3H2O,
Fe
+ 4HNO3 (р-р) ![]() Fe(NO3)3 +
NO
Fe(NO3)3 +
NO![]() +
2H2O,
+
2H2O,
2Fe
+ 6H2SO4 (конц.)![]() Fe2(SO4)3 +
3SO2
Fe2(SO4)3 +
3SO2![]() +
6H2O.
+
6H2O.
В п р и р о д е элемент железо представлен четырьмя изотопами с массовыми числами 54, 56, 57 и 58. По распространенности в природе железо является вторым среди металлов (после алюминия) и четвертым среди всех элементов. В свободном состоянии железо встречается только в метеоритах. К наиболее важным природным соединениям железа относятся: бурый железняк (Fe2O3•3H2O), красный железняк (Fe2O3), магнитный железняк (Fe3O4), железный колчедан, или пирит (FeS2). Железо присутствует во всех живых организмах (входит в состав хлорофилла, гемоглобина, ферментов, витаминов).
О с н о в н ы е м е т о д ы п о л у ч е н и я
• Из оксида железа(III) восстановлением Н2:
![]()
• Восстановлением оксидных руд углеродом в доменных печах.
Практически все железо, получаемое в промышленности этим методом, содержит углерод, который существенно изменяет свойства железа: понижает температуру плавления, повышает твердость и хрупкость. В зависимости от содержания в железе углерода различают чугуны (> 2,06% углерода) истали (0,2% – 2,06% углерода).
Химизм доменного процесса:
а) получение восстановителя:
С
+ O2 ![]() CO2,
CO2,
СO2 +
C ![]() 2CO;
2CO;
б) восстановление руды:

FeO
+ CO ![]() Fe
+ CO2
Fe
+ CO2![]() ;
;
в) науглероживание железа – растворение углерода в железе с образованием чугуна.
Основное количество чугуна перерабатывается в сталь. Выплавка стали проводится в конвертерных или мартеновских печах. Отрасль промышленности по производству чугуна, стали и других сплавов железа называется черной металлургией.
В а ж н е й ш и е с о е д и н е н и я ж е л е з а
Оксид железа(II) – FeO. Черное кристаллическое вещество, молекула имеет ионное строение. Проявляет основные свойства (хотя взаимодействует с расплавами щелочей, проявляя слабую амфотерность). Не взаимодействует с водой при обычных условиях, но в присутствии кислорода воздуха при слабом нагревании медленно реагирует с парами воды. Проявляет свойства слабого восстановителя. При нагревании разлагается, но при дальнейшем нагревании образуется снова. Взаимодействует с кислотами. Окисляется кислородом до смешанного оксида железа. Восстанавливается водородом, углеродом, угарным газом:
FeO + 2HCl = FeCl2 + H2O,
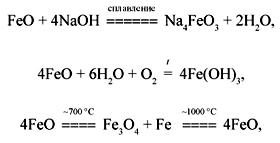
6FeO
+ O2 ![]() 2Fe3O4,
2Fe3O4,
FeO
+ H2 ![]() Fe +
H2O,
Fe +
H2O,
FeO
+ C ![]() Fe
+ CO
Fe
+ CO![]() ,
,
FeO
+ CO ![]() Fe
+ CO2
Fe
+ CO2![]() .
.
Получают FeO восстановлением смешанного оксида железа угарным газом или разложением соединений двухвалентного железа в инертной атмосфере:
Fe3O4 +
CO ![]() 3FeO
+ CO2
3FeO
+ CO2![]() ,
,
Fe(OH)2 ![]() FeO
+ H2O,
FeO
+ H2O,
FeCO3 ![]() FeO
+ CO2
FeO
+ CO2![]() .
.
Гидроксид железа(II) – Fe(OH)2. Белый порошок (иногда с голубовато-зеленоватым оттенком), связи в молекуле ковалентные. Не растворяется в воде. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Проявляет основные свойства (может взаимодействовать с концентрированными растворами щелочей, показывая слабую амфотерность). Реагирует с растворами кислот:
Fe(OH)2 ![]() FeO
+ H2O,
FeO
+ H2O,
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3,
![]()
Fe(OH)2 + 2HCl = FeCl2 + 2H2O.
Образуется гидроксид железа(II) при взаимодействии растворов соли железа(II) и щелочи:
FeCl2 +
2NaOH = Fe(OH)2![]() +
2NaCl.
+
2NaCl.
Оксид железа(III) – Fe2O3. Порошок красно-бурого цвета, молекула имеет ионное строение. Обладает слабыми амфотерными свойствами с преобладанием основных. Не реагирует с водой. Термически устойчив, при сильном нагревании превращается в смешанный оксид, а затем в оксид Fe(II). Термическая устойчивость оксидов железа повышается в ряду:
Fe2O3 ![]() Fe3O4
Fe3O4 ![]() FeO.
FeO.
Fe2O3 медленно реагирует с кислотами и щелочами, сплавляется с карбонатами. Восстанавливается до свободного металла или до других оксидов.
6Fe2O3 ![]() 4Fe3O4 +
O2
4Fe3O4 +
O2![]() ,
,
Fe2O3 + 6HCl = 2FeCl3 + 3H2O,
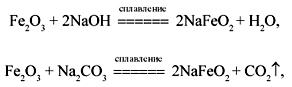
Fe2O3 +
3CO![]() 2Fe
+ 3CO2
2Fe
+ 3CO2![]() ,
,
Fe2O3 +
CO![]() 2FeO
+ CO2
2FeO
+ CO2![]() .
.
Оксид железа(III) получают окислением пирита или термическим разложением гидроксида железа(III) и нитрата железа(III):
4FeS2 +
11O2![]() 2Fe2O3 +
8SO2
2Fe2O3 +
8SO2![]() ,
,
2Fe(OH)3![]() Fe2O3 +
3H2O,
Fe2O3 +
3H2O,
4Fe(NO3)3![]() 2Fe2O3 +
12NO2
2Fe2O3 +
12NO2![]() +
3O2
+
3O2![]() .
.
Гидроксид железа(III) – Fe(OH)3. Вещество бурого цвета, выпадающее в осадок при взаимодействии растворов солей железа(III) и щелочи (или раствора аммиака).
FeCl3 +
3NH4OH
= Fe(OH)3![]() +
3NH4Cl.
+
3NH4Cl.
Проявляет амфотерные свойства с преобладанием основных. Разлагается при нагревании. Легко взаимодействует с кислотами. Реакции с концентрированными растворами щелочей протекают при длительном нагревании, при этом образуются устойчивые гидроксокомплексы с координационными числами 4 и 6; возможно сплавление со щелочами, например:
2Fe(OH)3![]() Fe2O3 +
3H2O,
Fe2O3 +
3H2O,
Fe(OH)3 + 3HCl = FeCl3 + 3H2O,
Fe(OH)3 +
3NaOH (конц.)![]() Na[Fe(OH)4],
Na[Fe(OH)4],
Fe(OH)3 +
3NaOH (конц.)![]() Na3[Fe(OH)6],
Na3[Fe(OH)6],
![]()
Смешанный оксид железа – Fe3O4 (FeO•Fe2O3, железная окалина). Порошок черного цвета, молекула имеет ионное строение. Термически устойчив. Не взаимодействует с водой. Реагирует с кислотами, восстанавливается до низшего оксида или до свободного металла:
Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O,
Fe3O4 +
10HNO3 (конц.)![]() 3Fe(NO3)3 +
NO2
3Fe(NO3)3 +
NO2![]() +
5H2O,
+
5H2O,
Fe3O4 +
CO![]() 3FeO
+ CO2
3FeO
+ CO2![]() ,
,
Fe3O4 +
4CO![]() 3Fe
+ 4CO2
3Fe
+ 4CO2![]() .
.
Соединения, в состав которых входит ион железа в степени окисления +2, проявляют восстановительные свойства; соединения, содержащие ион железа в степени окисления +3, проявляют окислительные свойства, например:
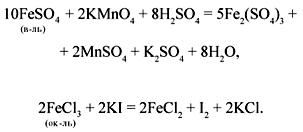
К а ч е с т в е н н ы е р е а к ц и и
Качественной реакцией на к а т и о н ж е л е з а (+2) являются реакции:
а) с гексацианоферратом(III) калия (красной кровяной солью). О присутствии ионов двухвалентного железа судят по образованию темно-синего осадка т у р н б у л е в о й с и н и:
![]()
б) с раствором щелочей (образуется белый осадок, который на воздухе буреет):
FeCl2 +
2NaOH = Fe(OH)2![]() +
2NaCl,
+
2NaCl,
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3.
Качественными реакциями на к а т и о н ж е л е з а (+3) являются реакции:
а) с гексацианоферратом(II) калия (желтой кровяной солью). Образуется темно-синий осадок б е р л и н с к о й л а з у р и:
![]()
б) с роданидом аммония; образуется роданид железа(III) кроваво-красного цвета:
FeCl3 + 3NH4CNS = Fe(CNS)3 + 3NH4Cl;
в) с растворами щелочей; образуется бурый осадок гидроксида железа(III):
FeCl3 +
3NaOH = Fe(OH)3![]() +
3NaCl.
+
3NaCl.
Соединения, которые н е о б х о д и м о з а п о м н и т ь: берлинская лазурь (Fe4[Fe(CN)6]3, железный колчедан (пирит) (FeS2), железный купорос (FeSO4•7H2O), желтая кровяная соль (K4[Fe(CN)6]), красная кровяная соль (K3[Fe(CN)6]), магнитный железняк (смешанный оксид железа) (Fe3O4).
