
Пособие-репетитор по химии занятие 27
10-й класс (первый год обучения)
Водород. Пероксид водорода
П л а н
1.
Положение в таблице Д.И.Менделеева,
строение атома, изотопы.
2. Краткая история открытия и происхождение названия.
3. Физические свойства.
4. Химические свойства.
5. Качественная реакция на водород.
6. Нахождение в природе.
7. Основные методы получения и области применения.
8. Пероксид водорода.
Водород – элемент с порядковым номером 1, имеет Аr = 1, электронная формула 1s1. Атом водорода наименьший по размерам и самый легкий из всех элементов Периодической системы. Условно водород размещают в Ia и в VIIa группах. Подобно щелочным металлам, атом водорода способен отдавать 1 электрон, превращаясь при этом в положительно заряженный ион (протон). В то же время атом водорода может принимать 1 электрон для завершения своего внешнего уровня, превращаясь в отрицательно заряженный гидрид-ион Н– (аналогично галогенам). По электроотрицательности водород занимает промежуточное положение между типичными металлами и типичными неметаллами. В соединениях водород проявляет степень окисления +1, реже –1, и может входить как в состав катионов, так и в состав анионов:
![]()
Природный
водород содержит три изотопа: ![]() протий
,
протий
, ![]() дейтерий
,
дейтерий
, ![]() тритий
. Протий и дейтерий являются стабильными
изотопами, тритий – радиоактивный
(период его полураспада составляет
12,26 года), на Земле его содержится около
300 кг. Водород – единственный химический
элемент, изотопы которого получили свои
персональные названия. Поскольку в
естественной смеси изотопов преобладает
протий, можно утверждать, что свойства
природного водорода обусловлены в
основном его свойствами.
тритий
. Протий и дейтерий являются стабильными
изотопами, тритий – радиоактивный
(период его полураспада составляет
12,26 года), на Земле его содержится около
300 кг. Водород – единственный химический
элемент, изотопы которого получили свои
персональные названия. Поскольку в
естественной смеси изотопов преобладает
протий, можно утверждать, что свойства
природного водорода обусловлены в
основном его свойствами.
Первооткрывателем водорода считается Г.Кавендиш. В 1766 г. он собрал и исследовал газ, выделяющийся при действии кислот на металлы, и назвал его «горючий воздух». В 1787 г. А.Лавуазье определил «горючий воздух» как новый химический элемент и дал ему современное название, которое в переводе с греческого означает «рождающий воду».
Ф и з и ч е с к и е с в о й с т в а
Молекула водорода двухатомна, образована за счет ковалентной неполярной одноцентровой связи (Н–Н). Водород – бесцветный, очень легкий (плотность равна 0,09 г/л – самое легкое вещество на Земле), термически устойчивый газ (переходит в атомарное состояние при 2000 °С). Мало растворим в воде и в органических растворителях, не имеет запаха. При высоких температурах проявляет уникальное физическое свойство – растворяется во многих металлах (никель, платина, палладий). Такая отличительная черта обусловлена способностью молекул водорода диффундировать через кристаллическую решетку металла. Наибольшая растворимость отмечена для палладия (850 объемов водорода на один объем металла).
Смесь 2-х объемов водорода и 1-го объема кислорода получила название «гремучий газ». Водород обладает высокой теплопроводностью (в семь раз больше, чем у воздуха), т.к. его легкие молекулы движутся с огромной скоростью.
Х и м и ч е с к и е с в о й с т в а
Из-за высокой прочности ковалентной неполярной связи молекулярный водород химически малоактивен. При обычной температуре водород реагирует только со фтором и, при освещении, с хлором. Но реакционная способность водорода значительно повышается при нагревании, а также в присутствии таких катализаторов, как никель, платина или палладий (растворяясь в этих металлах, молекулы водорода распадаются на атомы, а атомарный водород обладает значительной химической активностью). Кроме того, большой химической активностью обладает атомарный водород в момент выделения. В реакциях водород чаще всего выступает в роли восстановителя, реже окислителя.
Н2 (–).
О2 (+):
2H2 +
O2 ![]() 2H2O.
2H2O.
Металлы (+/–):*
2Na
+ H2 ![]() 2NaН,
2NaН,
Ca
+ H2 ![]() CaH2,
CaH2,
Cu
+ H2 ![]() реакция
не идет.
реакция
не идет.
Неметаллы (+/–):
H2 + F2 = 2HF (и с другими галогенами при разных условиях),

Н2О (–).
С оксидами водород вступает в реакции восстановления.
Основные оксиды (+/–):
CuO
+ H2 ![]() Cu
+ H2O,
Cu
+ H2O,
Na2O
+ H2 ![]() реакция
не идет.
реакция
не идет.
Кислотные оксиды (–/+):
СO2 +
H2 ![]() СO
+ H2O.
СO
+ H2O.
Основания (–).
Кислоты (–).
Соли (–).
К а ч е с т в е н н о й р е а к ц и е й на водород является его сгорание с характерным «хлопком». Горит водород бесцветным пламенем.
По данным современной космохимии, водород – наиболее распространенный элемент Вселенной (в состав космической материи входит 63% водорода, 36% гелия и 1% всех остальных элементов). На Земле водород встречается в основном в связанном виде (вода, нефть, уголь, минералы, живые организмы). В виде простого вещества водород находится в незначительных количествах в верхних слоях атмосферы.
О с н о в н ы е м е т о д ы п о л у ч е н и я и о б л а с т и п р и м е н е н и я
Лабораторные методы получения водорода:
взаимодействие металлов, стоящих в ряду напряжения до водорода, с растворами кислот-неокислителей:
Zn
+ 2HCl = ZnCl2 +
H2![]() ;
;
взаимодействие амфотерных металлов и кремния с растворами щелочей:
2Al
+ 2NaOH + 6H2O
= 2Na[Al(OH)4]
+ 3H2![]() ,
,
Si
+ 2NaOH + H2O
= Na2SiO3 +
2H2![]() ;
;
взаимодействие щелочных и щелочно-земельных металлов с водой:
2Na
+ 2H2O
= 2NaOH + H2![]() ,
,
Ca
+ 2H2O
= Сa(OH)2 +
H2![]() ;
;
взаимодействие гидридов активных металлов с водой:
NaH
+ H2O
= NaOH + H2![]() .
.
В промышленности водород получают, используя следующие методы:
электролиз разбавленных растворов щелочей, серной кислоты, хлоридов щелочных металлов:
2H2O ![]() 2H2
2H2![]() +
O2
+
O2![]() ,
,
2NaCl
+ 2H2O ![]() H2
H2![]() +
Cl2
+
Cl2![]() +
2NaOH;
+
2NaOH;
восстановление водяного пара металлами (магний, цинк, железо):
![]()
восстановление водяного пара раскаленным коксом:

конверсия метана:
![]()
крекинг углеводородов:
![]()
Области применения водорода:
• в химической отрасли промышленности – сырье для производства аммиака, хлороводорода, метанола;
• в пищевой отрасли промышленности для гидрогенизации растительных масел при производстве маргарина;
• в металлургии для восстановления металлов из их оксидов;
• для заполнения аэростатов, воздушных шаров, зондов;
• использование «водородной горелки» для сварки и резки металлов;
• жидкий водород – один из наиболее эффективных видов ракетного топлива;
• большую актуальность в настоящее время имеет вопрос о применении водорода как экологически чистого топлива.
К важнейшим соединениям водорода относятся вода и пероксид водорода.
П е р о к с и д в о д о р о д а – тяжелая, взрывоопасная жидкость голубоватого цвета. В лабораторной практике и в быту обычно используют 30%-й раствор пероксида водорода (пергидроль) или его 3%-й раствор (перекись). Получают пероксид водорода при взаимодействии пероксидов активных металлов с сильными кислотами:
BaO2 +
H2SO4 =
BaSO4![]() +
H2O2.
+
H2O2.
Раствор пероксида водорода имеет кислую реакцию среды, т.е. пероксид водорода можно рассматривать как слабую двухосновную кислоту H–O–O–H:
![]()
Взаимодействует с основаниями (реакция протекает без изменения пероксидной группировки):
H2O2 + Ba(OH)2 = BaO2 + 2H2O.
Разлагается на свету и под действием катализаторов (катализатор – диоксид марганца или ферменты крови):
![]()
В реакциях пероксид водорода проявляет окислительно-восстановительную двойственность за счет иона кислорода (О–):
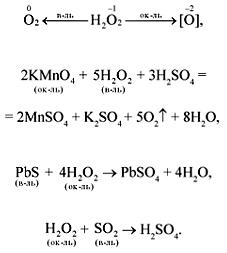
Пероксид водорода применяется в основном для получения антисептических средств, а также для реставрации живописи на основе свинцовых белил. Практическое применение нашли пероксиды щелочных металлов – их используют для получения кислорода на космических кораблях и подводных лодках.
