
Розділ 1. Молекулярна фізика
Тема 1. Основи молекулярно-кінетичної теорії Заняття 17 Основи молекулярно-кінетичної теорії будови речовини
Мета: сформулювати основні положення молекулярно-кінетичної теорії будови речовини; усвідомити поняття про кількість, масу і розмір молекул, розкрити наукове значення броунівського руху та його значення для світогляду; дати характеристику силі притягання і силі відштовхування між молекулами; розглянути особливості будови та властивості газоподібних, рідких і твердих тіл с точки зору МКТ; сформувати поняття ідеального газу, тиску газу; вивести залежність тиску газу від середньої кінетичної енергії його молекул - основне рівняння МКТ.
Основні положення молекулярно-кінетичної теорії будови речовини.
Розміри і маса молекул. Кількість речовини. Атомна одиниця маси. Гіпотеза Авогадро.
Броунівський рух.
Взаємодія атомів и молекул речовин в різних агрегатних станах.
Ідеальний газ. Дослід Штерну.
Основне рівняння МКТ ідеального газу.
Ключові слова: молекулярна фізика, МКТ, кількість речовини, моль речовини, число Авогадро, атомна одиниця маси, густина речовини, дифузія, осмос, броунівський рух, сублімація, ідеальний газ, розріджений газ.
Теоретичні відомості
Основні положення молекулярно-кінетичної теорії будови речовини.
В попередніх курсах ви знайомились с механікою Ньютона та розглядали механічний рух макроскопічних тіл, тобто переміщення одних тіл відносно інших протягом часу.
Макроскопічними тілами називають великі тіла, що складаються з великої кількості молекул.
Механіка не пояснює, чому існують тверді, рідкі та газоподібні тіла і чому ці тіла переходять з одного агрегатного стану в інших. Механіка також не досліджує внутрішні властивості тіл. Вона говорить про сили як про причини зміни швидкостей тіл, але природа цих сил, їх походження не з’ясовується. Чому при стисканні тіл з’являються сили пружності, чому виникає тертя і т.п.? На ці питання механіка не дає відповідей.
Молекулярна фізика є наукою про будову, фізичні властивості та агрегатні стани речовини, яка розглядається як сукупність великої кількості молекул, що взаємодіють між собою і знаходяться в тепловому русі.
Макроскопічні властивості речовини, які описує молекулярна фізика, вважаються незалежними від внутрішньої будови молекул, але залежної від кількості, розміру молекул, від їх взаємодії між собою і т.п.
Молекулою називається найменша стійка частинка речовини, що зберігає всі її хімічні властивості. Молекула може складатися з одного чи декількох атомів однакових чи різних хімічних елементів. Молекула електрично нейтральна, так як містить рівну кількість додатно та відємно заряджених часток. Атом - найменша хімічно нероздільна частка речовини.
На малий розмір молекул вказує такий факт: якщо б населення земної кулі дорівнювало кількості молекул у 1 см3 повітря (271018 молекул), то на кожний квадратний метр поверхні приходилося би 50 000 чоловік. А на велику кількість молекул вказує такий факт: якщо помітити всі молекули в склянці води, а потім вилити її в океани, ретельно розмішати воду в океанах, морях, ріках і озерах та знову зачерпнути склянку води, то в ній виявилося б близько 100 помічених молекул.
Явища, що пов’язані з нагрівом або охолодженням тіл, зі зміною їх температури, називаються тепловими. Нагрів або охолодження тіла може змінити його до не впізнавання. Молекулярна фізика роз’ясняє зміни в тілах, коли самі тіла нерухливі, і коли з точки зору механіки з ними не відбувається нічого суттєвого. Молекулярна фізика описує особливий вид руху матерії - тепловий рух, притаманний всім макроскопічним тілам незалежно від того, переміщуються вони в просторі чи ні. Теплові явища відбуваються всередині тіла й цілком визначаються рухом атомів чи молекул.
Тепловим рухом молекул називають їх хаотичний рух, тобто неперервний непідпорядкований рух, що не має будь-якого переважного напряму. Інтенсивність хаотичного руху молекул залежить від температури тіла.
Однією з основних теорій молекулярної фізики є молекулярно-кінетична теорія будови речовин (МКТ). Ціллю МКТ є роз’яснення властивостей макроскопічних тіл і теплових процесів, що протікають в них на основі уявлень про те, що всі тіла будуються з окремих частинок, які рухаються не підпорядковано.
Основними задачами МКТ являються:
дослідження будови речовини та її зміни завдяки зовнішнім впливам;
вивчення явищ переносу - дифузії, теплопровідності, внутрішнього тертя;
вивчення фазових перетворень - випаровування та конденсації, плавлення та кристалізації;
дослідження критичних станів речовини;
дослідження поверхневих явищ на межі розділу фаз.
В основі МКТ будови речовини лежать три твердження:
речовина складається з часток;
ці частки рухаються неперервно та хаотично;
частки взаємодіють одна з одною.
Все ці твердження доведені дослідами.
Властивості та поведінка всіх тіл визначаються рухом взаємодіючих між собою частинок: молекул, атомів або малих утворень.
Молекулярна фізика оперує рядком термінів та визначень. Наведемо деякі з них.
Густиною називається маса речовини в одиниці об’єму
![]() ,
одиниця виміру []
= кг/м3.
,
одиниця виміру []
= кг/м3.
Відносною
молекулярною масою
Мr
речовини називається безрозмірна
величина, що дорівнює відношенню маси
її молекули до 1/12 маси атома карбону
(вуглецю)
![]() .
Маса, що дорівнює 1/12 маси ядра атома
.
Маса, що дорівнює 1/12 маси ядра атома![]() ,
називаєтьсяатомною
одиницею маси
(а.о.м.).
,
називаєтьсяатомною
одиницею маси
(а.о.м.).
1 а.о.м. = 1,6605655(86)10-27 кг, в свою чергу 1 кг = 6,0220451026 а.о.м.
Кількість речовини,
що містить стільки атомів (молекул),
скільки їх міститься в 12 г ізотопу
карбону
![]() ,
називаєтьсямолем.
Згідно гіпотезі
Авогадро:
в одному молі будь-якої речовини міститься
однакове число молекул. Це число
називається
числом
Авогадро
(NA):
,
називаєтьсямолем.
Згідно гіпотезі
Авогадро:
в одному молі будь-якої речовини міститься
однакове число молекул. Це число
називається
числом
Авогадро
(NA):
NA = 6,022045(31)1023 моль-1
Маса одного моля називається молярною масою (або М). Її одиниці виміру - кг/моль:
= NAMr1 а.о.м. = NAmo, де mo - маса однієї молекули речовини вираженої в кг.
Відносна молекулярна маса Мr виражена в кілограмах, чисельно дорівнює молярній масі .
= 0,001Мr кг/моль = Мr г/моль.
Наприклад, відносна молекулярна маса оксигену О2: Мr(О2) = 32, а молярна маса = 0,032 кг/моль.
Моль являється основною одиницею кількості речовини системи СІ, що використовується в молекулярній фізиці. Так як окремі молекули різних речовин мають різну масу, то маса в даному випадку не є мірою кількості речовини. Так, наприклад, в 1 кг оксигену число молей менше, ніж в 1 кг гідрогену.
Об’єм одного моля
називається молярним
об’ємом:
![]() ,
де
- густина речовини. Одиниця виміру [V]
= м3/моль.
Для газів молярний об’єм дорівнює 22, 4
л/ моль. (Нагадаємо, що 1 л = 103
см3
= 10-3
м3)
,
де
- густина речовини. Одиниця виміру [V]
= м3/моль.
Для газів молярний об’єм дорівнює 22, 4
л/ моль. (Нагадаємо, що 1 л = 103
см3
= 10-3
м3)
Число молей речовини в масі m може бути визначено по формулі:
![]()
Маємо ряд формул:
маса речовини: m = Nmo = ;
число молекул речовини в масі m N = NA;
молярна маса:
=V
=
![]() .
.
Дифузія. Дифузія це самовільне проникнення молекул однієї речовини серед молекул іншої.
Осмос - одностороння дифузія.
Броунівський рух - це тепловий рух завислих в рідині (або газі) часток.
Англійський ботанік Р.Броун (1773-1858) в 1827 г вперше спостерігав це явище.
Броунівський рух хаотичний і неперервний. Зі зміною температури змінюється його інтенсивність. Причина броунівського руху часток полягає в тому, що удари молекул рідини (або газу) об частку не компенсують один одного.
Взаємодія між молекулами має електромагнітний характер.
 Графік
залежності сили
Графік
залежності сили
молекулярної взаємодії Fr
від відстані між молекулами
для найпростіших молекул.
Найпростіші молекули це 1-3 атомні молекули, які можна представити як шарики певного діаметру dM 10-10 м






 При
r = ro
= dM
молекули знаходяться в рівновазі.
При
r = ro
= dM
молекули знаходяться в рівновазі.
При r < ro переважають сили відштовхування.
При r > ro переважають сили притягання.
При r 10ro сили притягання замалі, тому ними можна знехтувати. Відповідно, сфера молекулярної дії 10-9м.
Газ не зберігає ні форму, ні об’єм
l
ro
молекулами молекул
Рідина - зберігає об’єм, не зберігає форму
l
ro
Тверде тіло - зберігає об’єм і форму
l
ro
в кристалічній гратці молекули (або атоми) розташовані строго впорядковано
Молекули рідини виконують коливання біля положення рівноваги, а також мають змогу час від часу змінювати своє взаємне розташування. Час «осілого життя» ( 10-8 с) >> часу одного коливання (10-12-10-13 с). Рідина «тече», змінює свою форму, якщо тривалість дії постійної зовнішньої сили >> часу «осілого життя». Якщо тривалість дії сили спів вимірювана з часом «осілого життя», то рідина веде себе як тверде тіло.
Всі речовини можуть переходити з одного агрегатного стану в інший
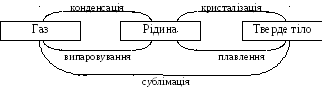
Більшість законів МКТ приведено для ідеального газу. Ідеальний газ - це газ, взаємодія між молекулами якого така мала, що нею можна знехтувати. В ідеальному газі відстань між молекулами набагато більше розмірів молекул, тому потенційною енергією молекул в ньому нехтують.
Розріджений газ - це газ, в якому відстань між молекулами в багато разів перевищує їх розміри. В цьому випадку взаємодія між молекулами дуже мала, і кінетична енергія молекул значно більша потенційної енергії взаємодії.
В реальному газі між молекулами діють складні сили взаємодії. На відміну від реального газу в ідеальному газі молекули можна розглядати як дуже маленькі тверді шарики.
Кожна молекула газу, коли ударяється об стінку, протягом малого проміжку часу діє на неї з певною силою. В результаті хаотичних ударів об стінку тиск швидко змінюється. Незважаючи на невеликі зміни тиску, середнє значення тиску практично має певну величину, тому що ударів об стінку дуже багато, а маси молекул дуже малі. Нагадаємо, що тиск р називають нормальну складову сили, що приходиться на одиницю площі поверхні, на яку ця сила діє.
![]() .
Одиниця виміру [p] = Па = Н/м2.
.
Одиниця виміру [p] = Па = Н/м2.
Одночасно за рухом
всіх молекул прослідкувати неможна.
Швидкість вільної молекули в будь-який
момент часу може виявитись як дуже
великою, так і дуже малою. Напрямок руху
молекул також весь час змінюється.
Швидкості окремих молекул можуть бути
будь-якими, однак, середнє значення
модуля цих швидкостей має певне значення.
В МКТ використовують не середнє значення
швидкості, а квадрат швидкості, так як
від цієї величини залежить середня
кінетична енергія молекул. Але квадрат
модуля будь-якого вектора дорівнює сумі
квадратів його проекцій на осі координат:
![]() ,
середнє значення
,
середнє значення![]() .
Так як напрям OX, OY, OZ рівноправні, то
.
Так як напрям OX, OY, OZ рівноправні, то![]() ,
тоді квадрат проекції швидкості
,
тоді квадрат проекції швидкості![]() .
.
Обчислимо тиск
газу на стінку сосуду площею S. Молекула
масою mo ,
що підлітає до стінки зі швидкістю
![]() ,
проекція якої на ось ОХ дорівнює Vx,
передає стінці при ударі імпульс moVx.
Молекула відскакує від стінки з тією ж
по модулю швидкістю, знову передає
імпульс moVx.
Всього за час зіткнення 1 молекула
передає стінці імпульс 2moVx..
За секунду молекули передадуть стінці
імпульс 2moVxZ,
де Z - число зіткнень всіх молекул зі
стінкою в одиницю часу. Число Z прямо
пропорційно концентрації молекул, тобто
числу молекул в одиниці об’єму
,
проекція якої на ось ОХ дорівнює Vx,
передає стінці при ударі імпульс moVx.
Молекула відскакує від стінки з тією ж
по модулю швидкістю, знову передає
імпульс moVx.
Всього за час зіткнення 1 молекула
передає стінці імпульс 2moVx..
За секунду молекули передадуть стінці
імпульс 2moVxZ,
де Z - число зіткнень всіх молекул зі
стінкою в одиницю часу. Число Z прямо
пропорційно концентрації молекул, тобто
числу молекул в одиниці об’єму
![]() .
Крім того воно прямо пропорційно
швидкості молекул, чим більше швидкість,
тим більше молекул за 1 сек встигне
зіштовхнутися зі стінкою. Крім того,
число зіткнень прямо пропорційно S площі
поверхні стінки. Z
nVxS.
Треба враховувати, що в середині тільки
половина всіх молекул рухається до
стінки. Друга половина рухається в
протилежну сторону. Тому Z=
.
Крім того воно прямо пропорційно
швидкості молекул, чим більше швидкість,
тим більше молекул за 1 сек встигне
зіштовхнутися зі стінкою. Крім того,
число зіткнень прямо пропорційно S площі
поверхні стінки. Z
nVxS.
Треба враховувати, що в середині тільки
половина всіх молекул рухається до
стінки. Друга половина рухається в
протилежну сторону. Тому Z=
![]() nVxS
і повний імпульс, що був переданий стінці
за 1 с, 2moVxZ
= monVx2S.
nVxS
і повний імпульс, що був переданий стінці
за 1 с, 2moVxZ
= monVx2S.
Згідно з другим
законом Ньютона зміна імпульсу будь-якого
тіла за одиниця часу рівна діючої на
нього силі F. Врахуємо, що не всі молекули
мають Vx,
в дійсності
![]()
![]() .
.
Тиск газу на стінку
дорівнює
![]() .
Це рівняння називаєтьсяосновним
рівнянням МКТ.
Воно зв’язує
макроскопічну величину - тиск, з
мікроскопічними величинами, що
характеризують молекули.
.
Це рівняння називаєтьсяосновним
рівнянням МКТ.
Воно зв’язує
макроскопічну величину - тиск, з
мікроскопічними величинами, що
характеризують молекули.
Середня кінетична
енергія поступального руху молекули
![]() .
Тиск пов’язаний з середньою кінетичною
енергією поступального руху рівнянням
.
Тиск пов’язаний з середньою кінетичною
енергією поступального руху рівнянням![]()
Домашній конспект: Дослід Штерну
Експериментальне визначення швидкостей молекул. Досліди з визначення швидкостей молекул довели правильність формули (2.12). Один з дослідів запропонував О. Штерн у 1920 р.
Прилад Штерна складається з двох коаксіальних циліндрів А і В, жорстко зв'язаних один з одним (мал. 22, а). Циліндри можуть обертатися зі сталою кутовою швидкістю. Вздовж осі малого циліндра натягнуто тонку платинову дротинку С, вкриту шаром срібла. По дротинці пропускають електричний струм. У стінці цього циліндра є вузька щілина О. Повітря з циліндрів викачано. Циліндр В має кімнатну температуру.
Спочатку прилад нерухомий. Коли по дротинці проходить струм, шар срібла випаровується і внутрішній циліндр заповнюється газом з атомів срібла. Деякі атоми пролітають крізь щілину О і, долетівши до внутрішньої поверхні циліндра Б, відкладаються на ній. У результаті прямо проти щілини утворюється вузька смужка срібла О (мал. 22, б).
Потім
циліндри починають обертати з великою
кутовою
швидкістю
(до 1500
![]() ).
Тепер за часt,
потрібний атому для
проходження
шляху, що дорівнює різниці радіусів
циліндрів Rв
—
RА
,
циліндри повернуться на якийсь кут
.
Через це атоми,
що рухаються зі сталою швидкістю,
потрапляють на
внутрішню поверхню великого циліндра
не напроти щілини
О
(мал.
23, а), а на якійсь відстані S
від кінця радіуса, що проходить через
середину щілини О
(мал.
23, б):
адже
атоми рухаються
прямолінійно.
).
Тепер за часt,
потрібний атому для
проходження
шляху, що дорівнює різниці радіусів
циліндрів Rв
—
RА
,
циліндри повернуться на якийсь кут
.
Через це атоми,
що рухаються зі сталою швидкістю,
потрапляють на
внутрішню поверхню великого циліндра
не напроти щілини
О
(мал.
23, а), а на якійсь відстані S
від кінця радіуса, що проходить через
середину щілини О
(мал.
23, б):
адже
атоми рухаються
прямолінійно.
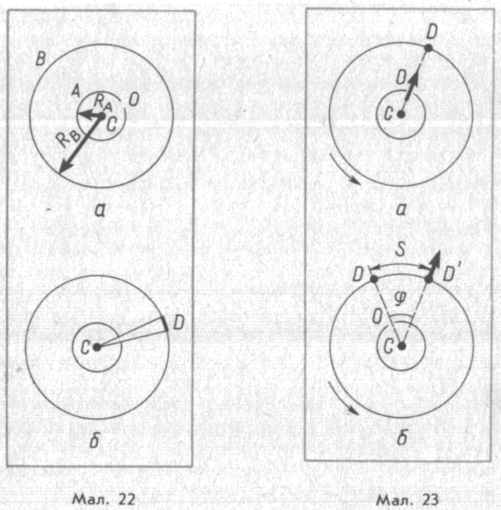
Якщо через В позначити модуль швидкості обертання точок поверхні зовнішнього циліндра, то s = Bt = 2nRBt.
Насправді,
не всі атоми срібла мають однакову
швидкість Тому
відстань S
для різних атомів буде різною. Під S
треба розуміти
відстань між ділянками на смужках О
і О’ з
найбільшою
концентрацією атомів срібла. Цій відстані
відповідатиме
середня швидкість атомів, яка дорівнює:
![]() .
.
Підставивши
в цю формулу значення t
з попереднього виразу, дістанемо:
![]() .
.
Знаючи n, RА і Rв та виміривши середнє зміщення смужки срібла, спричинене обертанням приладу, знаходимо середню швидкість атомів срібла.
Модулі швидкостей, визначені з досліду, збігаються з теоретичним значенням середньої квадратичної швидкості. Це є експериментальним доказом правильності формули (2.12), а отже, і (2.9), згідно з якою середня кінетична енергія молекули прямо пропорційна абсолютній температурі.
???1. Чому товщина шару смужки срібла на поверхні зовнішнього обертового циліндра в досліді Штерна неоднакова по ширині смужки? 2. Як зміниться середня квадратична швидкість руху молекул при підвищенні температури в 4 рази? 3. Які молекули в атмосфері рухаються швидше: молекули азоту чи молекули кисню?
