
- •Заняття 3 Рівняння стану ідеального газу. Ізопроцеси
- •Теоретичні відомості
- •Приклади рішення задач
- •Контрольні питання
- •Якісні задачі
- •Задачі для закріплення матеріалу
- •Домашній конспект
- •§ 10. Визначення температури
- •§ 11. Абсолютна температура. Температура — міра середньої кінетичної енергії молекул
Заняття 3 Рівняння стану ідеального газу. Ізопроцеси
Ціль: встановити співвідношення між температурою та середньою кінетичною енергією хаотичного руху молекул; встановити залежність між параметрами, що визначаються стан газу; вивести рівняння Менделєєва-Клапейрона, ознайомитись з ізопроцесами
Енергія теплового руху молекул
Температура та шкали температур.
Рівняння стану ідеального газу.
Ізопроцеси
Ключові слова: температура, термометр, параметри стану газу, стала Больцмана, ізотермічний, ізобарний, ізохорний процеси, шкали Цельсія, Фаренгейта, Реомюра.
Теоретичні відомості
Тепловою рівновагою називається такий стан, при якому всі макроскопічні параметри скільки завгодно довго залишаються незмінними (тобто не змінюються V, p, T)
Тиск
газу прямо пропорційний середній
кінетичній енергії поступального руху
молекул:
![]() .
.
При
тепловій рівновазі p, T і V даної маси
газу фіксовані, й
![]() також повинна мати фіксоване значення
також повинна мати фіксоване значення
![]() тоді
тоді![]() ,
тобто
,
тобто![]()
кількість
молекул можна визначити
![]() ,
а p, V вимірюються безпосередньо.
,
а p, V вимірюються безпосередньо.
Для
1 моля гідрогену при Т= 0 оС
значення
![]() =
0,1 м3,
=
0,1 м3,
![]() =
2,265104
Па, N = NA.
=
2,265104
Па, N = NA.
 - це значення однакове для всіх газів
при температурі льоду, що тане.
- це значення однакове для всіх газів
при температурі льоду, що тане.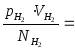
![]()
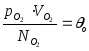
При
Т = 100 оС
![]()
100
- 0
= k (T100
- T0)
k = 1,3810-23
![]() - стала Больцмана, яка пов’язує температуру
в енергетичних одиницях з температурою
Т в Кельвінах.
- стала Больцмана, яка пов’язує температуру
в енергетичних одиницях з температурою
Т в Кельвінах.
![]()
Найнижчу температуру, при якій тиск ідеального газу перетворюється в нуль при фіксованому об’ємі, або об’єм наближається до нуля при фіксованому тиску називається абсолютним нулем температури.
![]()
![]() .
.
При
0 оС
![]()
Рівняння стану ідеального газу p = nkT,
де
n =
![]() .
.
Добуток kNA = R універсальна (молярна) газова стала.
R
= 8,31
![]() .
.
Рівняння
Менделєєва-Клапейрона:
![]() .
.
Для
даного газу даної маси виконується
рівняння Клапейрона (узагальнений
газовий закон):
![]() .
.
Для ідеального (або розрідженого) газу певної маси виконуються газові закони.
 ізотерма
ізобара ізохора
ізотерма
ізобара ізохора
![]()
![]()
![]() T1>T2
p1 <
p2
V1<V2
T1>T2
p1 <
p2
V1<V2
гипербола
![]()
![]()
![]()
закон Бойля -Маріотта закон Гей-Люссака закон Шарля
(ізотермічний) (ізобарний) (ізохорний)
Приклади рішення задач
Приклад 1. До якої температури треба нагріти при постійному тиску газ, що взяли при 0 оС, щоб його об’єм збільшився в 2 рази?
Рішення
Т 1
= 0 оС
= 273 К p = const T2
= 2273
K= 546 K = 373 oC
1
= 0 оС
= 273 К p = const T2
= 2273
K= 546 K = 373 oC
V 2
= 2V1
2
= 2V1 ![]() T2
=
T2
=
![]() =
2T1
=
2T1
T2 - ?
Відповідь: треба нагріти до 370 оС.
Приклад 2. З балону із стислим оксигеном використали стільки оксигену, що його тиск впав від значення 9,8 МПа до 7,8 МПа. Яка частина маси оксигену використана?
Р ішення
ішення
V = const Запишемо рівняння Менделєєва – Клапейрона для
T = const початкового й кінцевого стану оксигену:
р1
= 9,8 МПа= ![]()
= 9,8106 Па розв’язуючи систему рівнянь, отримаємо:
р 2
= 7,84106
Па
2
= 7,84106
Па ![]() ,
підставимо значення й отримаємо
,
підставимо значення й отримаємо
![]() -?
-? ![]() =
0,02
=
0,02
Відповідь: використано 0,02 частина оксигену або 2%.
Приклад 3. Густина деякої газоподібної речовини дорівнює 2,5 кг/м3 при температурі 10 оС й нормальному атмосферному тиску. Знайдіть молярну масу цієї речовини.
 =
2,5 кг/м3 рівняння
Менделєєва-Клапейрона
=
2,5 кг/м3 рівняння
Менделєєва-Клапейрона
Т
= 10 оС
= 283 К ![]()
Р н.у.
= 101325 Па
н.у.
= 101325 Па 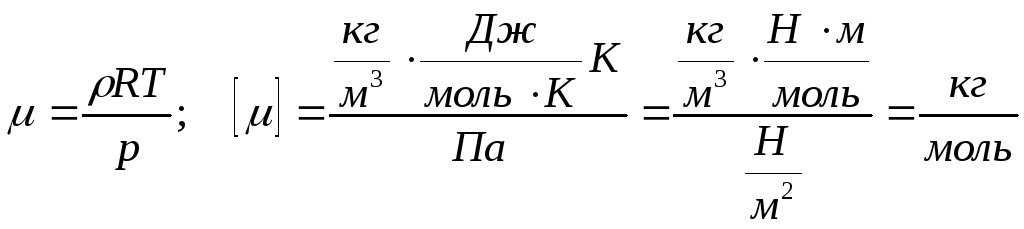
- ? = 5810-3 кг/моль.
Відповідь: молярна маса газ 0,058 кг/моль.
