Теоретическое введение « свойства и применение поверхностно-активных веществ».
Данный материал поможет Вам, как при выполнении домашнего задания, так и при подготовке к экзамену по данному спецкурсу. Обращаем Ваше внимание на то, что приведенный здесь материал затрагивает лишьнебольшую частьвопросов, входящих в экзаменационные билеты, и ориентирован, в основном, на выполнение домашнего задания. С общей программой курса Вы можете ознакомиться у преподавателя.
Каждая представленная ниже часть имеет свою нумерацию рисунков и список рекомендуемой литературы.
Часть 1 Межфазная поверхность. Методы определения межфазного натяжения.
Многие вещи из этого раздела будут Вам уже знакомы, однако, мы постараемся посмотреть на них несколько с другой стороны, учитывая то, что уже известно, и продвинуться немного далее.
Итак, ПАВы – это поверхностно-активные вещества, молекулы которых имеют дифильное строение и состоят из углеводородного радикала (одного или более) и полярной части (одной или нескольких). Схематично 1 молекула ПАВ обозначается так:

 ,
где палочка представляет собой
углеводородный радикал, а кружочек –
полярную группу.
,
где палочка представляет собой
углеводородный радикал, а кружочек –
полярную группу.
Одним из основных свойств ПАВ является их способность снижать межфазное натяжение (σ) на различных границах раздела в результате адсорбции молекул ПАВ на этих границах раздела. Чтобы установить, насколько сильно уменьшилась величина межфазного натяжения надо знать основные способы его определения. Остановимся на этом поподробнее, поскольку корректно измерить величину межфазного натяжения не так легко. Здесь необходимо напомнить о том, что существует 2 термина – межфазное и поверхностное натяжение, обозначаемые одной и той же буквой -σ. Как правило, термин «поверхностное» натяжение применяется тогда, когда речь идет о границах раздела жидкостей или твердых тел с газовой фазой (часто с воздухом). В этих случаях вводятся следующие обозначенияσж-газиσтв-газ, соответственно. Во всех остальных случаях (на границах раздела жидкость-жидкость (σж-ж), жидкость-твердое (σж-тв) и твердое-твердое (σтв-тв)) правильнее говорить о межфазном натяжении. Вообще, термин «межфазное натяжение» является наиболее полным, и для описания общих случаев пользоваться им более удобно, что и будет сделано ниже. Когда же речь пойдет непосредственно о поверхностном натяжении, об этом будет сказано дополнительно.
Существуют прямыеикосвенныеметоды определения межфазного натяжения.Прямыеметоды позволяют определять величины межфазных натяжений непосредственно из экспериментальных данных;косвенныеже методы, помимо эксперимента, требуют дополнительных расчетов и допущений.Прямыеметоды отработаны для случаев определенияσж-газ иσж-ж. Жидкая поверхность раздела отличается от твердой поверхности раздела тем, что она является 1) подвижной; 2) энергетически эквивалентной и 3) идеально гладкой. Поэтому в любой точке жидкостиσж-газиσж-ж являются величинами постоянными и независящими от формы сосуда, в которых они находятся.
Рассмотрим жидкуюграницу раздела фаз поподробнее, в частности, чистую жидкость на границе с воздухом. Как известно, возникновение поверхностного натяжения в данном случае есть результат несбалансированности межмолекулярных сил на поверхности раздела жидкость-воздух. Чем полярнее жидкость, тем выше величина ее поверхностного натяжения.
Вспомните из общего курса коллоидной химии – какая жидкость имеет самое высокое поверхностное натяжение?
При обсуждении этой темы возникает вопрос – какова глубина поверхностного слоя или этой области заметно несбалансированных сил? Прежде всего, эта область зависит от радиуса действия межмолекулярных сил. Если на поверхности жидкостине присутствуют ионы, взаимодействие между молекулами обусловлено, в основном, силами Ван-дер-Ваальса. Эти силы ослабевают пропорционально седьмой степени расстояния между молекулами, и, следовательно, для данной молекулы имеет значение только взаимодействие с 1-2 слоями ближайших соседей. Таким образом, силы, действующие на молекулу, симметричны уже на расстоянии нескольких молекулярных диаметров от поверхности. Толщина поверхностного слоя имеет тот же порядок.
Следует также помнить, что тонкий поверхностный слой находится в турбулентном состоянии. Поскольку жидкость равновесна со своим паром, то существует двусторонний сбалансированный перенос молекул из газовой фазы на поверхность и последующая конденсация, так и обратно – испарение. В частности, для воды это составляет около 1,21022 молекул/см2с, т.е. на каждом квадратном сантиметре поверхности воды ежесекундно принимается и отдается 1,21022 молекул. На площадку в 10 Å2, соответствующую площади, занимаемой 1 молекулой воды, за одну секунду падает 1,2107молекул, и, следовательно, время жизни молекулы на поверхности должно быть порядка десятой доли микросекунды.
Рассмотрим жидкость, находящуюся в равновесии с ее паром. На границе раздела объемные фазы жидкости (фаза α) и пара (фазаβ) переходят друг в друга не резко, а постепенно, как показано нарисунке 1. Поскольку межфазный слой не имеет четко определенных границ, при математическом анализе целесообразно ввести некоторую условную разделяющую поверхность. Принимая, что объемные фазы остаются однородными вплоть до разделяющей поверхности, можно определить экстенсивные параметры, такие какG– энергию Гиббса,S- энтропию,U- внутреннюю энергию и т.д.
|
|
Рисунок 1. Схема образования разделяющей поверхности.
Тогда:
V=Vα+Vβ
U=Uα+Uβ+Uσ
S=Sα+Sβ+Sσ
и т.д.
Верхний индекс σиспользован для обозначения поверхностных величин, рассчитанных при условии, что объемные фазы остаются неизменными вплоть до выбранной математической разделяющей поверхности.
Для внутренней энергии обобщенное уравнение 1 и 2 начал термодинамики может быть записано так:
dU=TdS+idni - PαdVα - PβdVβ+σds+C1dc1+C2dc2,
где c1 иc2– две кривизны разделяющей поверхности, аC1 иC2– некоторые константы. Очень часто принимают, чтоC1 +C2= 0; в таком случае разделяющую поверхность называютповерхностью натяжения.
Рассмотрим некоторые прямые методы определения конкретные межфазных натяжений.
Жидкая граница раздела фаз.
Методы капиллярного поднятия и максимального давления в пузырьке.
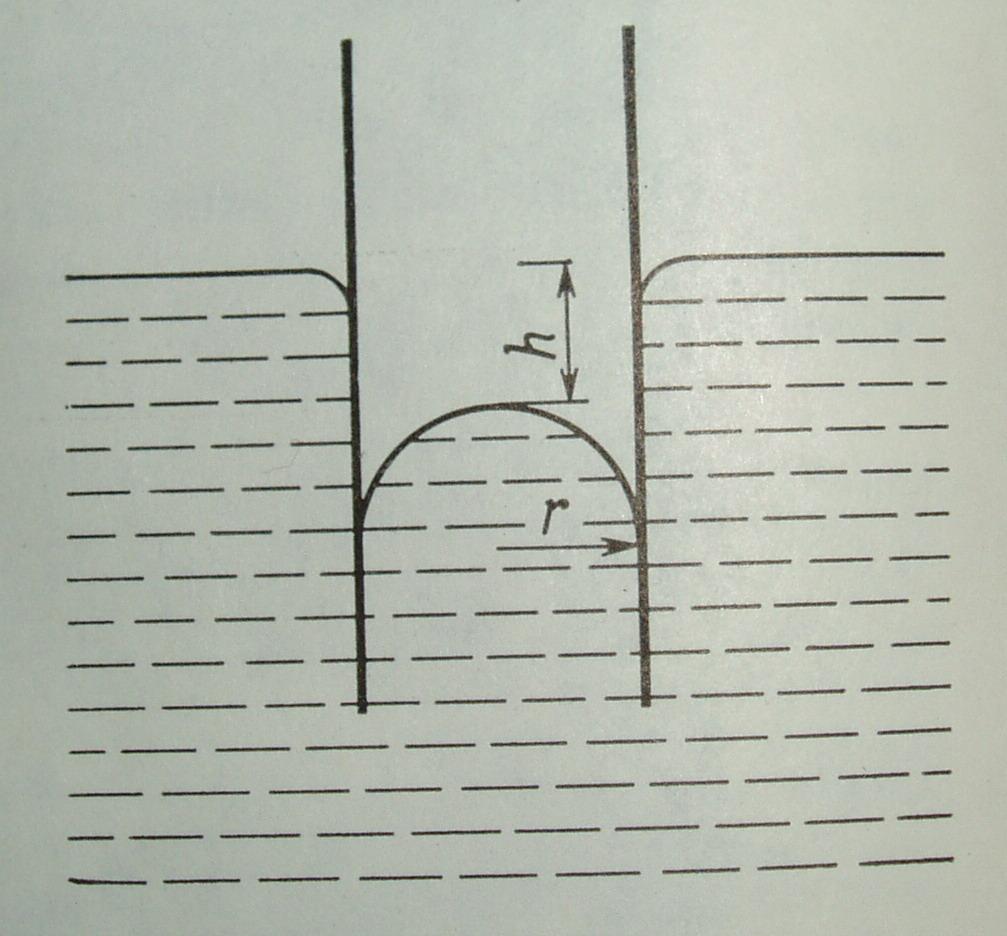
Метод капиллярного поднятия.
Данный метод позволяет экспериментально определять поверхностное натяжение жидкостей - σж-газ.
Метод капиллярного поднятия базируется на известном уравнении Лапласа:
P=σ![]() ,
где
,
где
σ– межфазное натяжение,
![]() - кривизна поверхности. Жидкость в
капилляре образует сферический мениск
(вогнутый или выпуклый в зависимости
от смачивания или не смачивания,
соответственно). Тогда уравнение Лапласа
принимает следующий вид:
- кривизна поверхности. Жидкость в
капилляре образует сферический мениск
(вогнутый или выпуклый в зависимости
от смачивания или не смачивания,
соответственно). Тогда уравнение Лапласа
принимает следующий вид:
P=![]()
![]() ,
гдеrм– радиус мениска. Радиус мениска связан
с радиусом капилляра (rк) через угол смачивания ():rк/
rм
= cos
,
гдеrм– радиус мениска. Радиус мениска связан
с радиусом капилляра (rк) через угол смачивания ():rк/
rм
= cos
Поднятие (или опускание) жидкости в капилляре уравновешивается гидростатическим давлением:
![]() =ρgh,
гдеh– высота капиллярного
поднятия (опускания);ρ– разность плотностей жидкой и
газообразной фаз.
=ρgh,
гдеh– высота капиллярного
поднятия (опускания);ρ– разность плотностей жидкой и
газообразной фаз.
С другой стороны
![]() ,
гдеa –
капиллярная постоянная.
,
гдеa –
капиллярная постоянная.
При точной математической трактовке капиллярного поднятия необходимо принимать во внимание отклонение формы мениска от сферической.
|
|
Рисунок 2. Схема поднятия жидкости в капилляре.
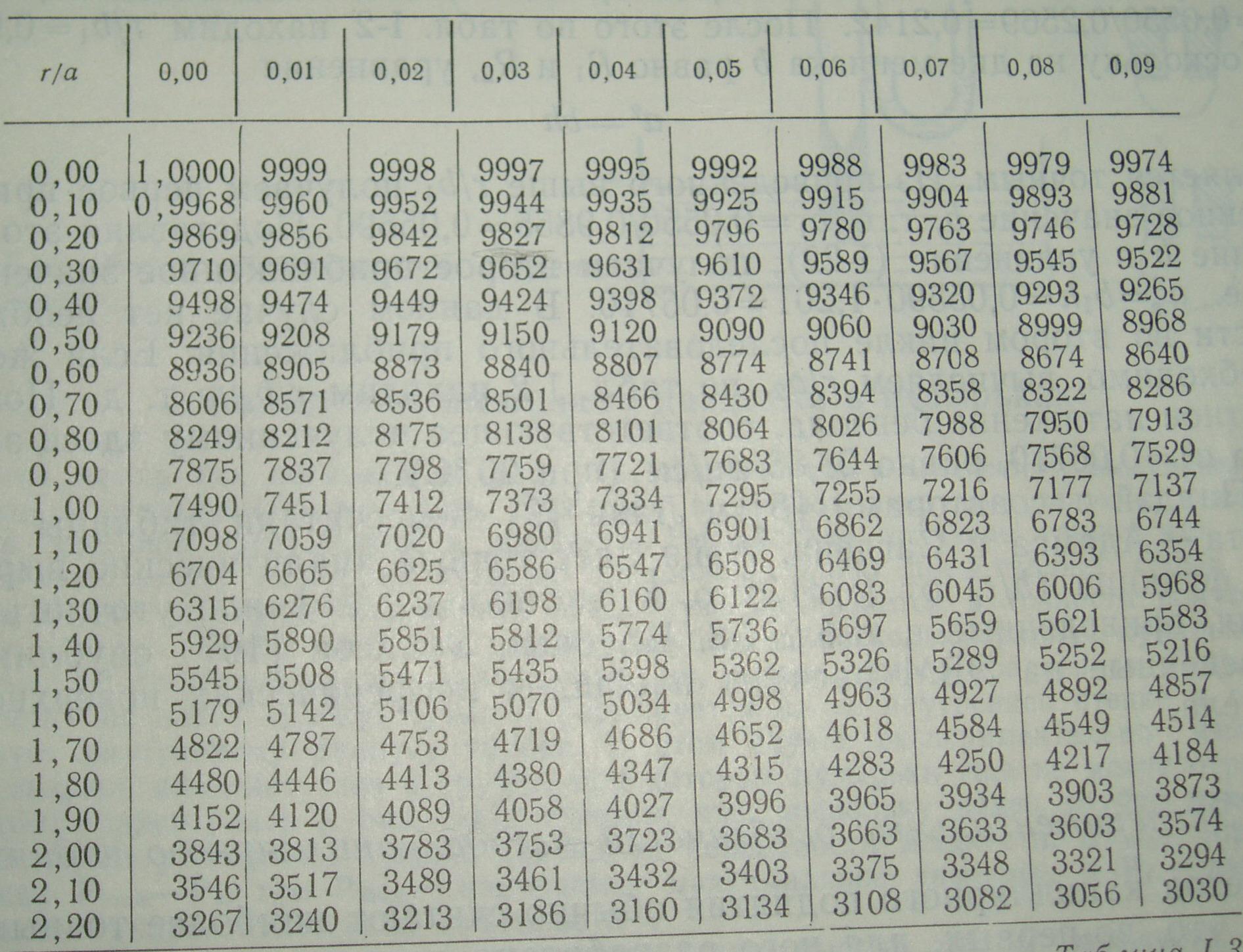
Башфорт и Адамс отработали метод, позволяющий учитывать несферичность мениска, который в дальнейшем был усовершенствован Сагденом. Обозначив за радиус кривизны величину b, Сагден ввел безразмерный параметрβ, определяемый соотношением:
β=Δρgb2/σ= 2b2/a2
При идеальном смачивании и равенстве угла = 0, радиусы мениска и капилляра совпадают и равны r. Учесть отклонение мениска от сферического позволяет таблица 1 , составленная Сагденом, и показывающая взаимосвязь между r/b и r/а.
Как пользоваться данной таблицей будет показано на конкретном примере в конце лекции 1.
Метод капиллярного поднятия имеет определенные достоинства. Его считают наиболее достоверным потому, что для его описания разработана довольно точная теория, и его можно осуществить экспериментально с контролируемой погрешностью. Для получения наиболее точных результатов необходимо соблюдать следующие условия:
жидкость должна полностью смачивать капилляр; как правило, в большинстве случаев используются стеклянные капилляры, которые хорошо смачиваются большинством известных жидкостей;
капилляр следует устанавливать строго вертикально; его радиус должен быть постоянен по всей длине, сечение капилляра может отклоняться от круга не более чем на несколько процентов;
при использовании стеклянных капилляров щелочность жидкости не должна превышать некоторого предельного значения (чтобы не происходило выщелачивание стекла).
Таблица 1.
Поправочные коэффициенты на несферичность капли.
|
|
При соблюдении всех указанных условий погрешность метода составляет всего несколько сотых процента.
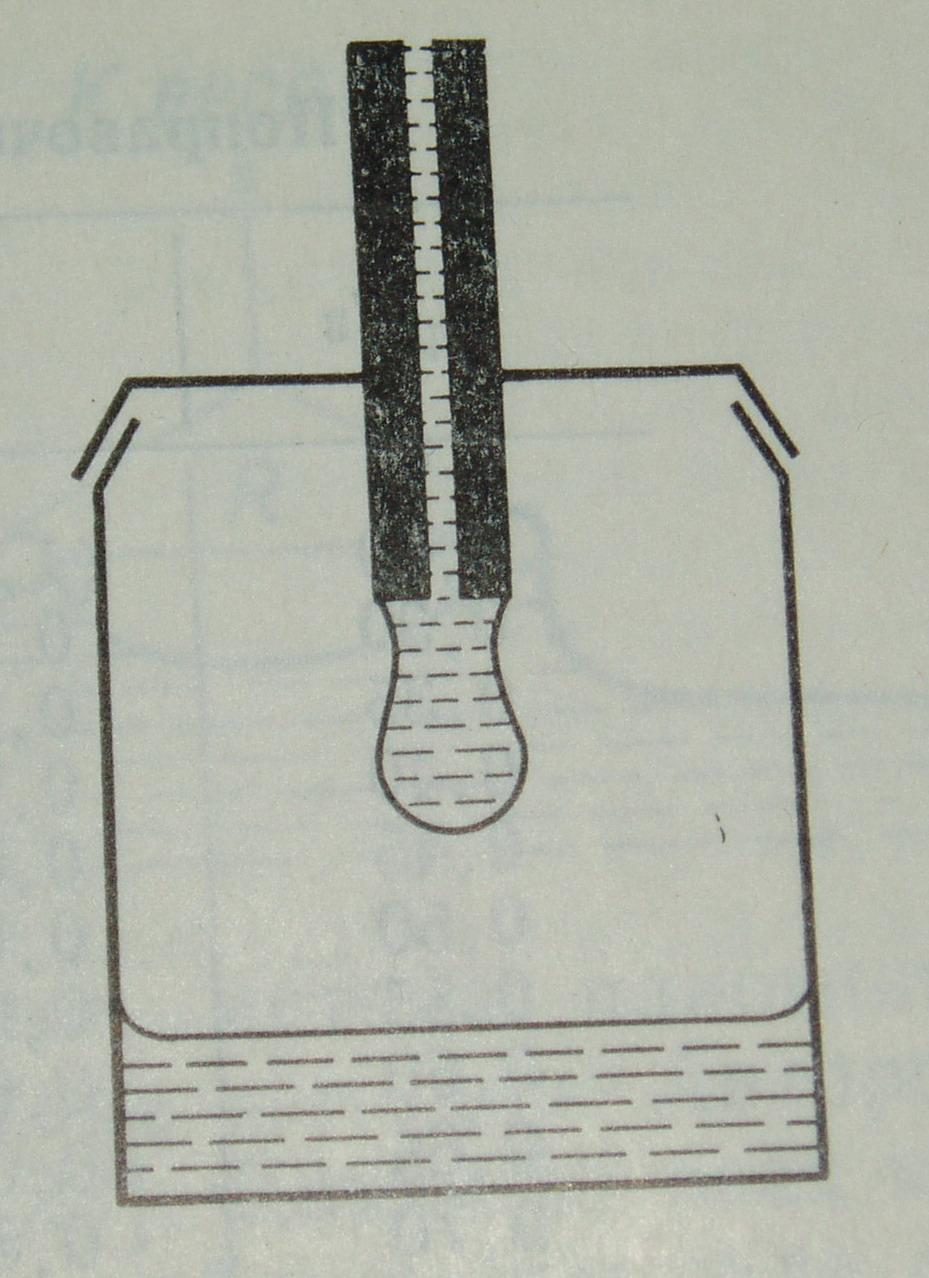
Метод максимального давления в пузырьке.
Данный метод также позволяет определять поверхностное натяжение жидкостей σж-газ и заключается в медленном выдувании пузырьков в исследуемую жидкость(рисунок 3). Пузырьки выдувают инертным газом с помощью трубки, частично погруженным в жидкость. Как видно из рисунка, если радиус трубки не велик, то растущий пузырек представляет собой часть сферы. В данном случае также применимо уравнение Лапласа:
P=![]()
![]() ,
гдеr– радиус пузырька.
,
гдеr– радиус пузырька.
|
|
Рисунок 3. Схема прибора для максимального давления в пузырьке.
Радиус пузырька минимален, когда пузырек является точно полусферическим. В этот момент он равен радиусу трубки, и поскольку радиус пузырька минимален, то Pдостигает своего максимального значения. Такой вариант возможен только для очень узких трубок, значительные погрешности определенияσнаблюдаются приr/а, равном 0,05.
Как и в случае капиллярного поднятия, Сагден рассчитал и протабулировал поправочные коэффициенты для данного метода, введя некоторую постоянную Х = a2/h. Любому данному значениюr/a соответствует значениеr/X (таблица 2).
Таблица 2.
Поправочные коэффициенты на несферичность для метода максимального давления в пузырьке.
|
r/a |
X/r |
r/a |
X/r |
|
0,0 |
1,0 |
0,05 |
0,9984 |
|
0,1 |
0,9934 |
0,15 |
0,9851 |
|
0,2 |
0,9937 |
0,25 |
0,9592 |
|
0,4 |
0,9000 |
0,45 |
0,875 |
|
0,6 |
0,792 |
0,65 |
0,7619 |
|
0,8 |
0,6719 |
0,85 |
0,6438 |
|
1,0 |
0,5703 |
1,05 |
0,5489 |
|
1,2 |
0,4928 |
1,25 |
0,4765 |
|
1,4 |
0,4733 |
1,45 |
0,4206 |
Как пользоваться данной таблицей будет показано на конкретном примере в конце лекции.
Точность определения по методу максимального давления в пузырьках достигает нескольких десятых процента. Скорость роста пузырьков должна составлять около 1/с. Таким образом, данный метод является квазидинамическим и характеризует натяжение свежеобразованных поверхностей жидкость-газ. Для стареющих поверхностей данный метод использовать нецелесообразно.
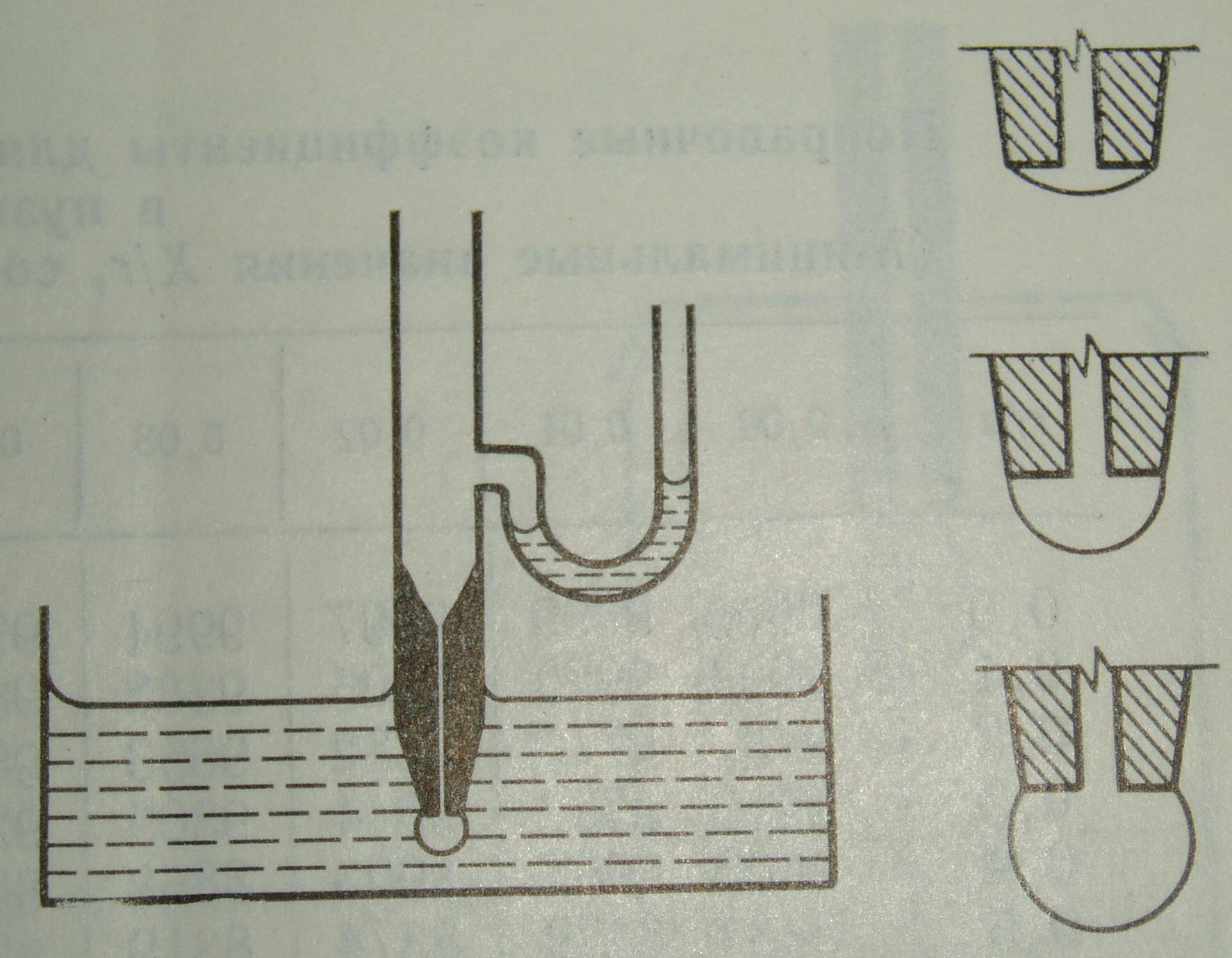
Метод взвешивания капель.
Это довольно точный и наиболее распространенный лабораторный метод измерения межфазных натяжений на границах раздела σж-газ иσж-ж. Методика измерения заключается в следующем: на конце капилляра формируют капли жидкости, капающие в контейнер, заполненный другой жидкостью (в случае определенияσж-ж) или в пустой контейнер (в случае определенияσж-газ). Собирают и считают капающие капли до тех пор, пока можно будет достаточно точно определить их вес. Зная количество капель и их общую массу, можно определить объем и радиус одной капли.
Остановимся подробнее на более сложном варианте – измерении σж-ж (рисунок 4).
|
|
Рисунок 4. Схема установки для метода веса-объема капли.
Для дальнейшего расчета необходимо знать плотности жидкостей, а также радиус капилляра. При этом необходимо учитывать то, что если жидкость в капилляре, смачивает его, то при расчете используется внешний радиус капилляра, если нет – внутренний. При подготовке эксперимента надо помнить о том, что в капилляре должна находиться жидкость с более высокой плотностью, а в контейнере-сборнике – жидкость с меньшей плотностью.
При расчетах используют уравнение Тэйта, известное с 1864 года и называемое законом Тэйта:
W= 2πr, где
где 2πr– длина окружности кончика капилляра,- межфазное натяжение,W– вес капли.
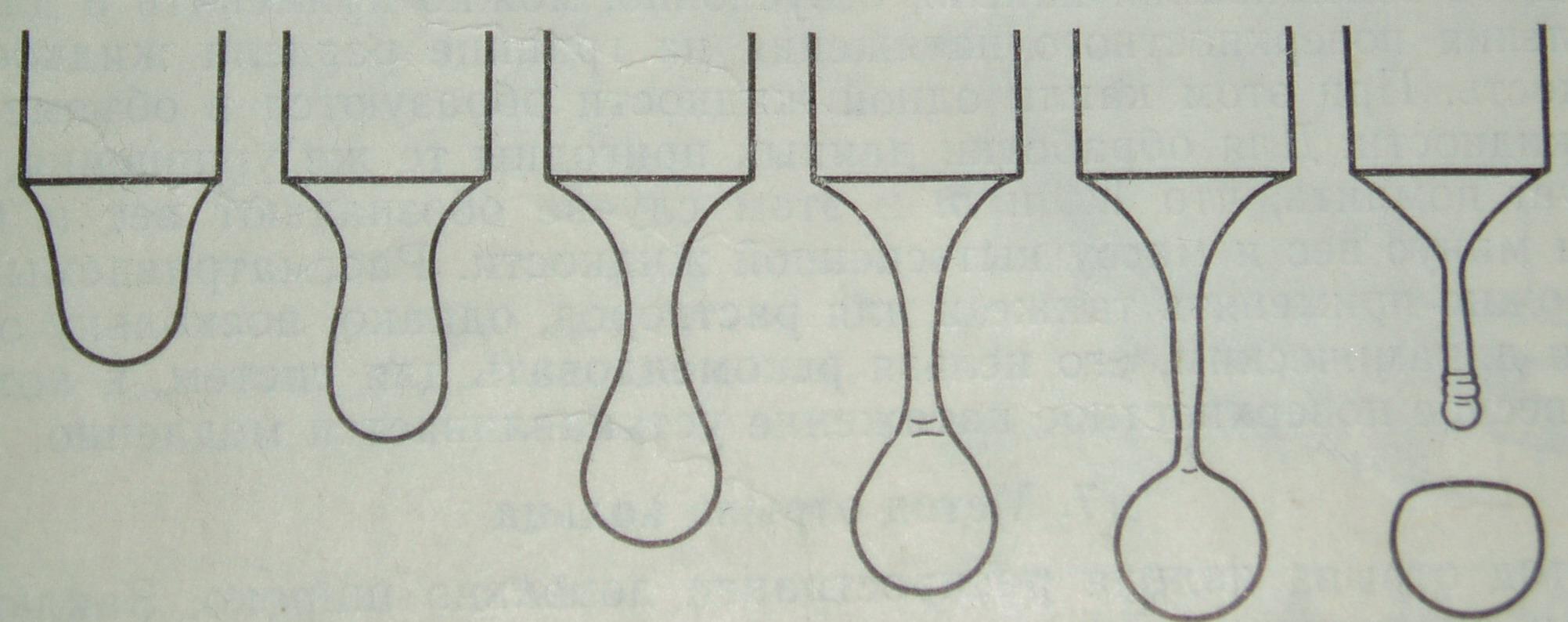
Закон Тэйта базируется на концепции о том, что максимальная сила, удерживающая каплю на кончике капилляра, равна межфазному (поверхностному) натяжению, умноженному на длину окружности кончика трубки. Фактически же на практике получают вес капли W’ , который меньше идеального рассчитанного. Причина этого становится понятной при помощирисунка 5. Вследствие механической нестабильности образующейся цилиндрической шейки капли фактически падает только часть капли, достигшая точки нестабильности, до 40% жидкости остается в капилляре.
|
|
Рисунок 5. Деформация капли в методе веса-объема капли.
Учитывая это, Гаркинс и Браун пришли к выводу, что фактический вес капли W’ можно рассчитать как:
W’ = 2πrf, где
f- некоторый поправочный коэффициент, являющийся функцией от соотношения радиуса капилляра и объема капли, т.е.f=Ψ(r/V1/3). Значения поправочного коэффициента в зависимости от указанного соотношения приведены втаблице 3.
Таблица 3.
Поправочные коэффициенты в методе веса-объема капли.
|
|
Как пользоваться данной таблицей будет показано на конкретном примере в конце лекции.
Измерения рекомендуется проводить при значениях r/V1/3 от 0,6 до 1,2, когда коэффициент f меняется наиболее медленно. При использовании данного метода важно применять трубки с полированными концами, не содержащими каких-либо трещин и зазубрин. Капли должны формироваться медленно, если длительность роста капли составляет 1 мин, ошибка эксперимента близка к 0,2%. В целом, точность определения этим методом составляет от 0,1 до 0,3%.
Метод отрыва кольца.
Данный метод позволяет определять поверхностное натяжение жидкостей σж-газ. Его автором считают дю Ноя. Заключается он в следующем: определяется сила отрыва кольца или петли из проволоки от поверхности жидкости (рисунок 6). При этом предполагается, что сила отрыва равна поверхностному натяжению, умноженному на периметр поверхности отрыва. Таким образом, для кольца, показанного на рисунке 6, можно записать:
|
|
Рисунок 6. Схема прибора в методе отрыва кольца.
Wобщ = Wк + 4πR,
где Wк – вес кольца.
Гаркинс и Джордэн показали, что это уравнение дает большую погрешность, и ввели коэффициент f, определяемый соотношением:
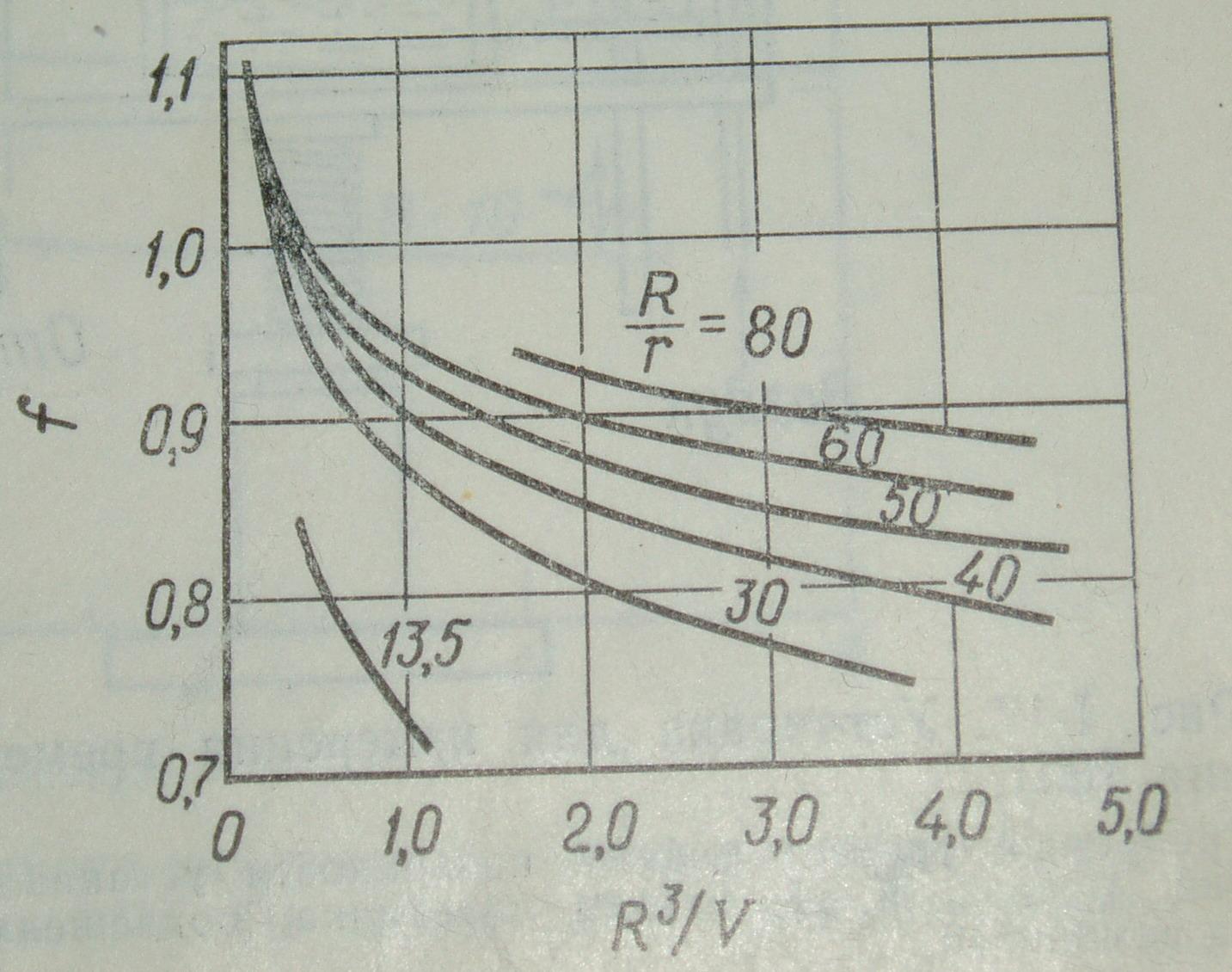
f = /p = ψ (R3/V, R/r), где
p – идеальное поверхностное натяжение, рассчитанное по вышеприведенному уравнению без поправок, а V – объем мениска. Поправочные кривые для определения коэффициента f приведены на рисунке 7.
Точность данного метода может быть достаточно высокой. Экспериментатор должен обратить внимание на следующие моменты. Перед опытом необходимо определять вес сухого кольца, обычно изготавливаемого из платины. Кольцо должно поддерживаться в горизонтальном положении (установлено, что отклонение от горизонтали на 1 дает погрешность в 0,5%, а при отклонении на 2,1 погрешность составляет 1,6%). Необходимо применять специальные меры предосторожности, чтобы исключить возмущение поверхности вблизи критической точки отрыва. Для удаления поверхностных загрязнений перед опытом кольцо прокаливают на горелке. Чтобы обеспечить чистоту исследуемой поверхности, рекомендуется заполнять кювету доверху и затем сливать часть жидкости через край кюветы. Желательно, чтобы краевой угол был близок к нулю, иначе результаты окажутся заниженными. В некоторых случаях вместо платиновых можно использовать тефлоновые или полиэтиленовые кольца.
|
|
Рисунок 7. Поправочные кривые для метода отрыва кольца.
Рассмотрением данного метода мы завершаем изучение жидкой поверхности раздела, однако нельзя забывать, что здесь рассмотрена только часть используемых на практике методов определения σж-газ иσж-ж; существует еще множество других методов, описанных в специальной литературе.
Теперь рассмотрим два метода, позволяющих определять межфазные натяжения на границе σж-тв и поверхностные натяжения некоторых твердых телσтв-газ.
Определение межфазного натяжения σж-тв .
Из общего курса коллоидной химии известно, что дисперсность существенно влияет на растворимость плохо растворимых частиц в различных растворителях. Это может быть описано с помощью известного также из общего курса коллоидной химии уравнения Кельвина:
ln![]() ,
,
где sr и s∞ - растворимость сферических микрочастиц и растворимость сферических макрочастиц, соответственно; rr – радиус микрочастицы. Из последнего уравнения видно, что с увеличением дисперсности растворимость растет, т.е. чем меньше частица, тем больше ее растворимость. Это уравнение лежит в основе метода определения межфазного натяжения на границе твердое – раствор (σж-тв). Экспериментально определяют растворимость твердых частиц в зависимости от дисперсности вещества и рассчитывают межфазное натяжение. Недостатки метода заключаются в сложности получения нескольких частиц одинакового размера, а также в том, что метод не позволяет учесть то, что у анизотропных кристаллических тел каждая грань имеет свое межфазное натяжение.
Определение поверхностного натяжения твердых тел (метод Цисманна).
Как уже говорилось ранее, экспериментальное определение межфазных натяжений на жидкой границе раздела фаз не вызывает особых затруднений. Достаточно надежных методов определения поверхностного натяжения твердых тел нет. Для оценки этой величины используются расчетные или экспериментальные косвенные методы. В частности, для полимеров, одним из наиболее распространенных косвенных методов является метод, предложенный Цисманном.
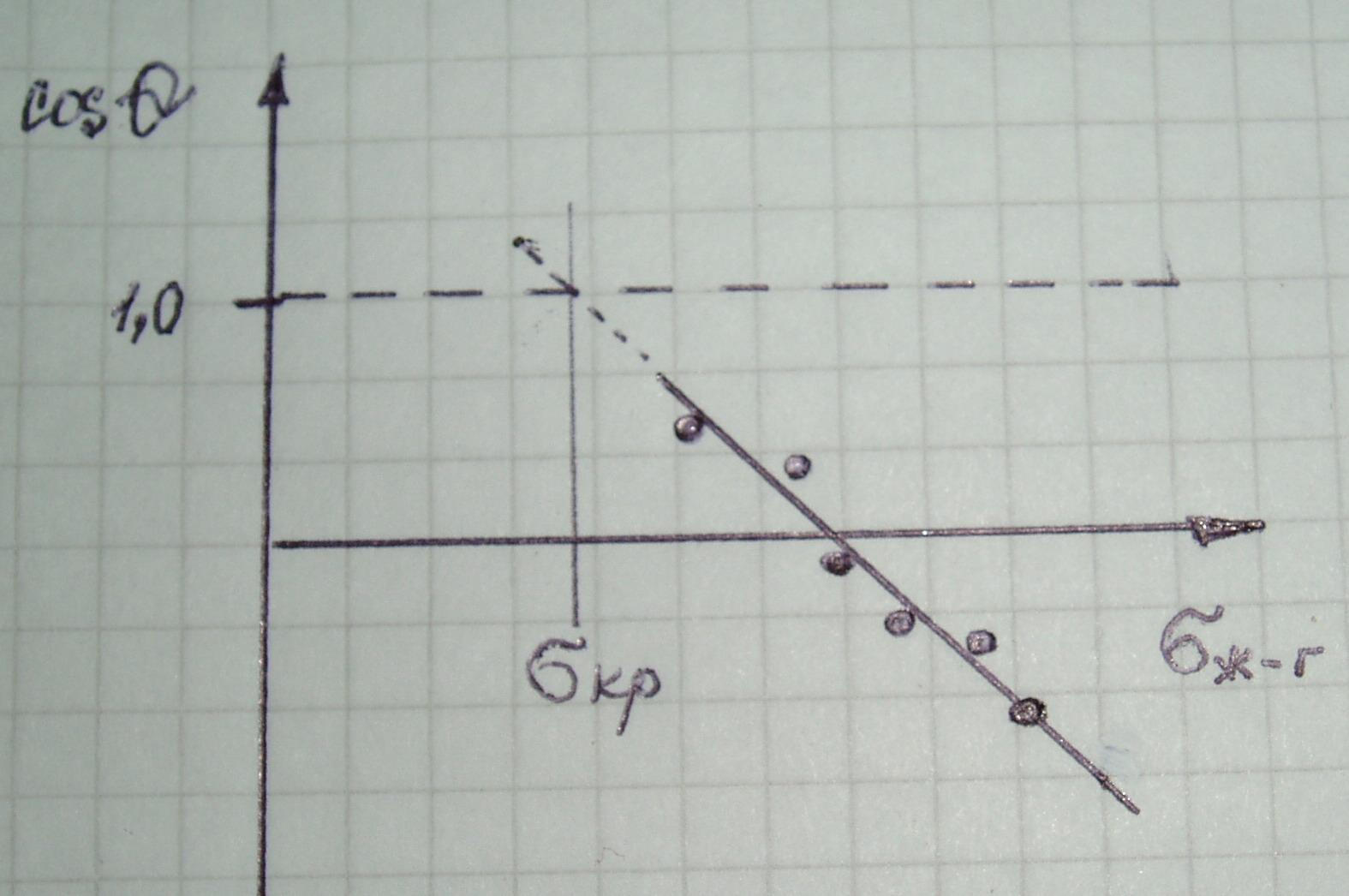
Суть данного метода заключается в определении критического поверхностного натяжения смачивания σкр. Эту величину находят по зависимости косинусов краевых углов натекания (cos Θнт) от поверхностного натяжения жидкости (σж-газ). В качестве жидкости используются либо гомологи с различными величинами поверхностного натяжения (спирты, кислоты и пр.), либо растворы одного вещества с различными концентрациями и, соответственно, различными значениямиσж-газ. Для многих твердых низкоэнергетических поверхностей при уменьшении поверхностного натяженияσж-газ, значения cos Θнт линейно возрастают. Это позволяет определить значение σж-газ, при котором происходит полное смачивание твердой поверхности, экстраполируя зависимость cos Θнт = f (σж-газ) до значенияcos Θнт =1. Это значение σж-гази называют критическим натяжением смачивания (рисунок 8).
|
|
Рисунок 8. Определение σкрметодом Цисманна.
Величина σкрпрактически не зависит от природы и свойств наносимых жидкостей и, в основном, определяется свойствами смачиваемого твердого материала. Поэтому можно принять, что величинаσкр соответствует его поверхностному натяжениюσтв-газ. То, чтоσкр≈σтв-газ , можно доказать, используя правило Антонова, согласно которому, межфазное натяжение на границе двух несмешивающихся жидкостей равно разности поверхностных натяжений их взаимно насыщенных растворов.
Применяя это правило для случая взаимодействия жидкости с твердой поверхностью, когда она полностью смачивается, получаем:
σж-тв=σж-газ-σтв-газ
Из уравнения Юнга (cos Θнт = (σтв-газ-σж-тв)/σж-газ)) при условии полного смачивания твердой поверхности (cos Θнт =1) имеем:
σж-тв=σтв-газ-σж-газ
Следовательно, при полном смачивании твердого тела σтв-газ=σж-газ иσкр=σтв-газ. Необходимо отметить, что последнее равенство выполняется не всегда, так как для его соблюдения необходимо, чтобы межфазное натяжениеσж-твбыло равно нулю, или хотя бы величиныσтв-газиσж-газзначительно превышали значениеσж-тв. Как правило, эти условия реализуется лишь в случае низкоэнергетических подложек, а для высокоэнергетических поверхностей не выполняется. Поэтому для последних данный метод использовать нецелесообразно. Таким образом, мы рассмотрели основные методы определения межфазных натяжений. Конечно, существует еще много методов определенияσ, о которых Вы можете прочитать в специальной литературе. В заключении рассмотрим конкретные примеры решения типовых задач.
Примеры решения типовых задач.
Задача 1. Рассчитайте поверхностное натяжение водного раствора ПАВ, если усилие отрыва от его поверхности платиновой пластинки составляет 25,56 мН. Размеры пластинки: 1,20,11,0 см; плотность платины – 21,5 г/см3; плотность водного раствора ПАВ - 1,0 г/см3.
Решение:
По аналогии с уравнением, приведенным для метода отрыва кольца, для пластинки можно записать:
F=P+ Пσ, где
F– сила отрыва платины;P– вес пластины; П – периметр основания пластины, касающийся поверхности жидкости.
П = 2(a+b) = 2(0,1+1,2) 10-2 = 0,026 (м)
Р = mg=Vρg= 0,110-21,210-2 1,010-221,51039,8 = 0,0252 (Н)
(при расчете веса кольца плотностью жидкости можно пренебречь)
σ=![]() (Н/м
= Дж/м2) = 13,8 мДж/м2
(Н/м
= Дж/м2) = 13,8 мДж/м2
Задача 2. Рассчитайте межфазное натяжение на границе вода-масло, если масса 20 капель четыреххлористого углерода, собранных в контейнере, наполненным водой, оказалась равна 0,84 г. ПлотностьCCl4= 1,6 г/см3, плотностьH2O= 1,0 г/см3. Эксперименты проводились с использованием метода веса-объема капли, причем внутренний радиус стеклянного капилляра составлял 0,3 см; внешний – 0,4 см. При расчетах учтите неполный отрыв капли, а также то, что органическая жидкость плохо смачивает стекло.
Решение:
Согласно закону Тэйта, вес одной капли четыреххлористого углерода рассчитывается по уравнению:
W= 2πrили
mg= 2πr, тогда без учета поправок на неполный отрыв капли
=
![]()
Объем одной капли CCl4легко рассчитать, зная общую массу капель и их количество:
V=
![]() м3.
м3.
И тогда без поправок:
=
![]()
![]() Дж/м2= 8,1 мДж/м2
Дж/м2= 8,1 мДж/м2
(поскольку органическая жидкость не смачивает стекло, то при расчетах берут внутренний радиус капилляра)
Для того, чтобы учесть неполный отрыв капли от капилляра, необходимо вычислить соотношение r/V1/3.
r/V1/3
=
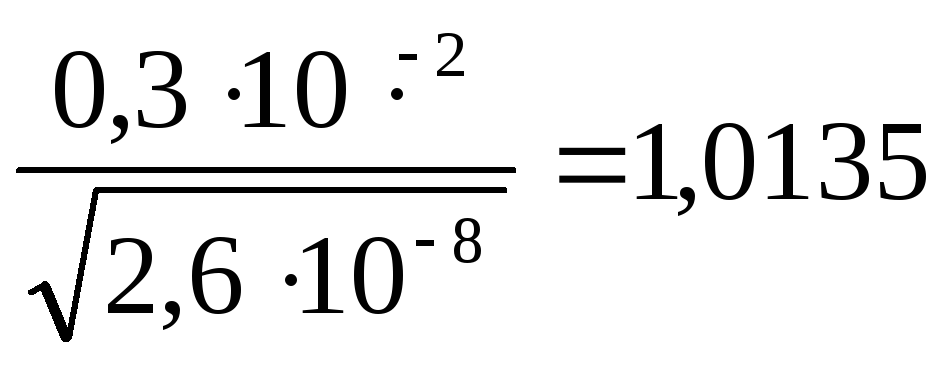
Данному значению соответствует величина F= 0,6160 (см. таблицу 3 поправочных коэффициентов и используя метод интерполяции).
Тогда с учетом поправки:
=
![]() Дж/м2= 13 мДж/м2
Дж/м2= 13 мДж/м2
Сравните значения рассчитанных межфазных натяжений и убедитесь в необходимости поправки на неполный отрыв капли от капилляра.
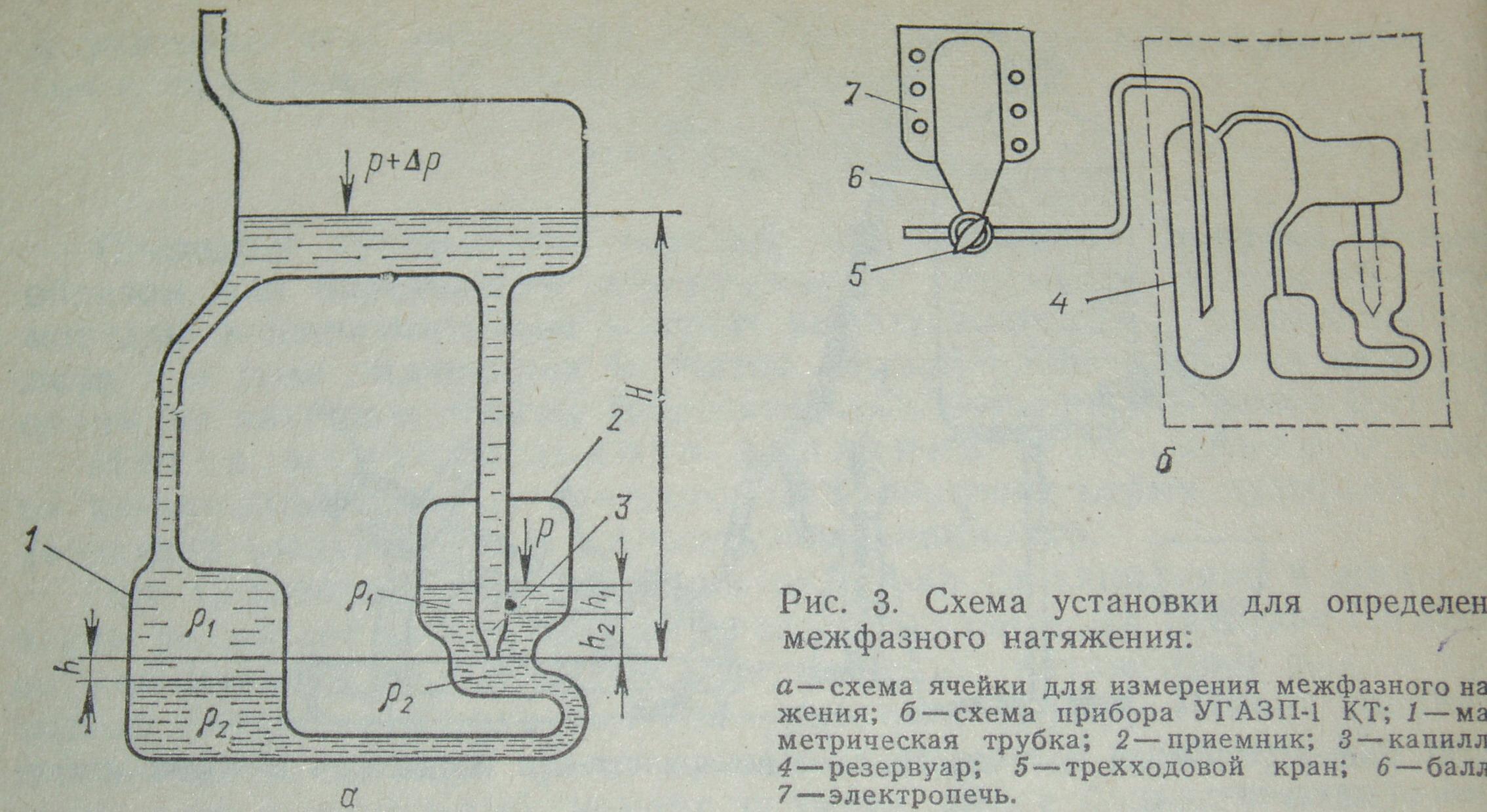
Задача 3. Рассчитайте межфазное натяжение на границе жидкость-жидкость, разность плотностей которых составляет Δρ = 0,2 г/см3. Расстояние между концом капилляра и границей раздела фаз на приборе Пугачевича (см. рисунок9) составляетh= 1,2 см. Радиус капилляра – 0,2 см. При расчете учтите несферичность капли.
|
|
Рисунок 9. Схема установки Пугачевича.
Решение:
В момент достижения максимального избыточного давления ΔРmax условия механического равновесия на срезе капилляра 3 радиуса r и на границе раздела фаз в манометрической трубке 1 могут быть выражены соответствующими уравнениями:
p+ΔРmax
+ gρ1H
= p+gρ1h1
+ gρ2h2
+
![]()
p+ΔРmax + gρ1(H+h) = p+gρ1h1 + gρ2(h2+h), где
все обозначения соответствуют рисунку и условию задачи. Из совместного решения этих уравнений получаем выражение для расчета межфазного натяжения:
σ
ж-ж
=
![]()
Преимуществом прибора Пугачевича является то, что в полученное расчетное уравнение не входит краевой угол.
Без учета поправки можно рассчитать σ ж-ж :
σ ж-ж = 0,59,80,21031,210-20,210-2 = 0,0235 Дж/м2= 23,5 мДж/м2
Для учета несферичности капли рассчитаем первую капиллярную постоянную а1:
а12 = 2σ/Δρg = rh = 0,21,2 = 0,24 (см2).
а1
=![]() =
0,49
=
0,49
![]()
Этому соотношению r/a в таблице 2 поправочных коэффициентов соответствует значение X/r, равное 0,889 (рассчитанное методом интерполяции). Тогда значение Х1, соответствующее 1 капиллярной постоянной будет равно:
Х1 = 0,20,889 = 0,18 (см)
Это значение соответствует новому значению радиуса капилляра с учетом несферичности капли, т.е. при расчетах предполагается, что меняется только значение радиуса капилляра, а величина h остается постоянной.
Значение второй капиллярной постоянной с учетом нового значения радиуса будет равно:
a22 = X1 h = 1,20,18 = 0,216 (см2)
a2 = 0,46
Тогда
![]() Этому значению соответствуетХ2/r
= 0,904 и
Этому значению соответствуетХ2/r
= 0,904 и
Х2 будет равно 0,9040,18 = 0,162 (см)
Далее аналогично рассчитывают значения следующих капиллярных постоянных до тех пор, пока значения предыдущей и последующей капиллярной постоянной не будут близки. В частности, в данном случае а3 ≈ а4 (0,442≈0,448)
Тогда с учетом последнего значения капиллярной постоянной рассчитывают значение межфазного натяжения:
σ
ж-ж
=
![]() Дж/м2= 19,7 мДж/м2
Дж/м2= 19,7 мДж/м2
Сравните значения рассчитанных межфазных натяжений и убедитесь в необходимости поправки на несферичность капли.
Рекомендуемая литература:
А. Адамсон. Физическая химия поверхностей. М., Мир, 1979
Лабораторные работы и задачи по коллоидной химии. Ред. Ю.Г. Фролова и А.С. Гродского, М., Химия, 1986
Практикум по технологии косметических средств. Коллоидная химия поверхностно-активных веществ и полимеров. Ред. В. Кима и А.С. Гродского. М., Изд-во Топ-книга, 2003.
Фролов Ю.Г. Курс коллоидной химии: поверхностные явления и дисперсные системы. М.: Химия, 1982, ( 3 изд. - 2004).