
АВТОНОМНАЯ НЕКОММЕРЧЕСКАЯ ОРГАНИЗАЦИЯ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
ЦЕНТРОСОЮЗА РОССИЙСКОЙ ФЕДЕРАЦИИ
«РОССИЙСКИЙ УНИВЕРСИТЕТ КООПЕРАЦИИ»
Казанский кооперативный институт (филиал) тестовые задания
А.Ю.Аликин
ХИМИЯ
специальность 100101 «Сервис»
Казань
2010
F1: ХИМИЯ
V1: Строение атома
I:
S:Атомы изотопов имеют разное число:
-: протонов
+: нейтронов
-: электронов
-: нет правильного ответа.
I:
S:Энергетический уровень характеризуется квантовым числом:
+: главным;
-: орбитальным;
-: магнитным;
-: спиновым.
I:
S:Энергия подуровня характеризуется квантовым числом:
-: главным;
+: орбитальным;
-: магнитным;
-: спиновым
I:
S: Собственное вращательное движение электрона характеризует квантовое число:
-: главное;
-: орбитальное;
-: магнитное;
+: спиновое
I:
S: Какое положение указывает, что распределение электронов в невозбужденном атоме происходит так, чтобы их суммарная энергия была минимальна:
+: принцип минимума энергии;
-: принцип Паули;
-: правило Гунда
-: нет правильного ответа
I:
S: Какое положение утверждает, что в атоме не может быть двух электронов с одинаковым набором значений всех четырех квантовых чисел:
-: принцип минимума энергии;
+: принцип Паули;
-: правило Гунда
-: нет правильного ответа
I:
S:Какое положение доказывает, что в невозбужденных атомах электроны в пределах данного подуровня занимают максимальное число свободных орбиталей, при этом суммарное спиновое число максимально:
-: принцип минимума энергии;
-: принцип Паули;
+: правило Гунда
-: нет правильного ответа
I:
S:В периодической системе элементы, имеющие одинаковое строение внешнего электронного слоя, объединены в
-: периоды;
+: группы;
-: подгруппы
-: нет правильного ответа
I:
S:Последовательным рядом элементов, атомы которых имеют одинаковое число энергетических уровней, является:
+: период;
-: группа;
-: подгруппа
-: нет правильного ответа
I:
S: В группах атомные радиусы:
+: возрастают сверху вниз;
-: возрастают снизу вверх;
-: отличаются незначительно
-: нет правильного ответа
I:
S:Энергия отрыва электрона от атома элемента с образованием катиона — это:
+: энергия ионизации;
-: энергия сродства к электрону;
-: относительная электроотрицательность
-: нет правильного ответа
I:
S: Энергия присоединения электрона атомом элемента с образованием аниона — это:
-: энергия ионизации;
+: энергия сродства к электрону;
-: относительная электроотрицательность
-: нет правильного ответа
I:
S: Величина, характеризующая способность атома элемента притягивать к себе общие электроны в молекуле — это:
-: энергия ионизации;
-: энергия сродства к электрону;
+: относительная электроотрицательность
-: нет правильного ответа
I:
S: В периоде слева направо:
-: увеличиваются металлические свойства;
+: возрастает энергия ионизации;
-: уменьшается энергия ионизации;
-: среди ответов нет верного
I:
S: С увеличением порядкового номера от натрия к хлору у элементов
-: металлические свойства усиливаются;
-: неметаллические свойства уменьшаются;
-: валентность в кислородных соединениях
уменьшается;
+: металлические свойства уменьшаются, а неметаллические — усиливаются
I:
S:В группе сверху вниз
-: усиливаются металлические свойства;
+: усиливаются восстановительные свойства;
-: уменьшается атомный радиус;
-: среди ответов нет верного
I:
S: Сродство к электрону в периоде слева направо
-: уменьшается;
+: увеличивается;
-: не меняется
-: нет правильного ответа
I:
S: В периоде слева направо относительная электроотрицательность
-: уменьшается;
+: увеличивается;
-: не меняется
-: нет правильного ответа
I:
S:Электроны, находящиеся на орбитали шарообразной формы, это
-: d-электроны;
+: s-электроны;
-: f-электроны;
-: p-электроны .
I:
S: Форма орбитали p-электронов
-: шарообразная;
+: гантелеобразная;
-: несимметричная гантель;
-: четыре листа цветка.
I:
S: Четвертый энергетический уровень максимально содержит
-: 8 электронов;
-: 16 электронов;
-: 32 электрона;
+: 36 электронов.
I:
S: С повышением порядкового номера элементов от лития до неона число электронов на втором энергетическом уровне
-: изменяется от 9 до 18;
-: изменяется четным числом;
-: остается неизменным;
+: изменяется от 1 до 8.
I:
S: Число неподеленных электронных пар на валентном энергетическом уровне атома азота в основном состоянии равно
+: 1
-: 2
-: 3
-: 0
I:
S: Неспаренные электроны в основном состоянии содержит частица
-:
![]()
-:
![]()
+:
![]()
I:
S: Иону Sc3+ соответствует электронная конфигурация
-: 1s22s22p63s23p64s23d3
-: 1s22s22p63s23p64s24p3
+: 1s22s22p63s23p6
-: 1s22s22p63s23p64s23d0
I:
S: Формула водородного соединения элемента с электронной конфигурацией атома в основном состоянии 1s22s22p63s23p4 имеет вид
+:
![]()
-:
![]()
-:
![]()
-:
![]()
I:
S: Формула высшего оксида элемента, электронная конфигурация атома которого 1s22s22p63s23p64s13d5, имеет вид …
+:
![]()
-:
![]()
-:
![]()
-:
![]()
I:
S: В периоде с увеличением порядкового номера элементов металлические свойства:
-: изменяются неоднозначно
-: усиливаются
+: ослабевают
-: не изменяются
I:
S: На d-орбиталях одного энергетического уровня максимально могут располагаться ____ электронов
+: 10
-: 6
-: 18
-: 8
I:
S: Наибольшей массой обладает …
-: фотон
-: электрон
-: позитрон
+: нейтрон
I:
S: Общий запас энергии электрона в атоме характеризует квантовое число…
-: l
-: ml
-: ms
+: n
I:
S: Максимальное число неспаренных электронов на p-орбиталях составляет…
-: 6
-: 4
-: 7
+: 3.
V1: Химическая связь
I:
S: В узлах кристаллической решетки фторида натрия находятся …
-: молекулы NaF
-: атомы натрия и молекулы фтора
+: ионы натрия и фтора
-: атомы натрия и фтора
I:
S: Молекула метана имеет ……. строение
пирамидальное
-: угловое
+: тетраэдрическое
-: линейное
I:
S: Наибольшей степенью ионности характеризуется химическая связь в соединении
-:
![]()
+:
![]()
-:
![]()
-:
![]()
I:
S:
В ряду
![]() прочность связи в молекулах …
прочность связи в молекулах …
-: не изменяется
-: изменяется периодически
+: уменьшается
-: увеличивается
I:
S: Тетраэдрическое строение имеет молекула…
+:
![]()
-:
![]()
-:
![]()
-:
![]()
I:
S: Химическая связь, осуществляемая за счет одной или нескольких электронных пар, сильно взаимодействующих с ядрами обоих соединяемых атомов, это
+: ковалентная связь;
-: ионная связь;
-: металлическая связь
-: нет правильного ответа
I:
S: Химическая связь, для которой характерно сильное взаимодействие общей электронной пары с ядром только одного из соединяемых атомов, это
-: ковалентная связь;
+: ионная связь;
-: металлическая связь
-: нет правильного ответа
I:
S: Химическая связь, характеризующаяся слабым взаимодействием общих электронов с ядрами соединяемых атомов и полной делокализацией этих электронов между всеми атомами, это
-: ковалентная связь;
-: ионная связь;
+: металлическая связь
-: нет правильного ответа
I:
S: Вещества с ионной связью
+: хорошо растворяются в воде, их растворы и расплавы хорошо проводят электрический ток;
-: плохо проводят электрический ток,
имеют низкую температуру кипения;
-: плохо проводят электрический ток, плохо растворяются в воде;
-: их растворы и расплавы хорошо проводят электрический ток, плохо растворяются в воде
I:
S: Ионная связь характеризуется
-: направленностью;
+: электростатическим взаимодействием
положительных и отрицательных ионов;
-: насыщаемостью;
-: перекрыванием электронных облаков
I:
S: В молекулах ионных соединений присутствуют элементы
+: с низкой энергией ионизации и большим
сродством к электрону;
-: с высокой энергией ионизации и низким
сродством к электрону;
-: с низкой энергией ионизации;
-: с низким значением электроотрицательности
I:
S: Из перечисленных рядов выбрать тот, где присутствуют только вещества с ионной связью
-:
![]()
+:
![]()
-:
![]()
-:
![]()
I:
S: Веществам с неполярной ковалентной связью присуща
-: направленность;
+: насыщаемость;
-: нерастворимость в воде;
-: все ответы правильны
I:
S: Ковалентная связь образуется
+: перекрыванием атомных орбиталей;
-: электростатическим взаимодействием
положительных и отрицательных ионов;
-: в молекулах металлов;
-: в атомах с низкой энергией ионизации
I:
S: Из перечисленных рядов выбрать тот, в котором имеются вещества только с неполярной ковалентной связью
-:
![]()
-:
![]()
+:
![]()
-:
![]()
I:
S: Из ниже перечисленных рядов выбрать тот, в котором имеются вещества только с полярной ковалентной связь
+:
![]()
-:
![]()
-:
![]()
-:
![]()
I:
S: В молекуле какого соединения возможна ковалентная связь по донорно-акцепторному механизму
-: HBr;
-: H2S;
+: NH3;
-: N2
I:
S: Неодинаковость всех или некоторых физических и химических свойств вещества по разным направлениям — это
+: анизотропия;
-: полиморфизм;
-: изоморфизм
-: нет правильного ответа
I:
S: Мп+7 переходит в Мп+2 в
+: кислой среде;
-: щелочной среде;
-: нейтральной среде
-: нет правильного ответа
I:
S: Мп+7 переходит в Мп+4 в
-: кислой среде;
-: щелочной среде;
+: нейтральной среде
-: нет правильного ответа
I:
S: Мп+7 переходит в Мп+6 в
-: кислой среде;
+: щелочной среде;
-: нейтральной среде
-: нет правильного ответа
I:
S: Молекула NF3 имеет _______ пространственную конфигурацию.
-: треугольную
-: угловую
+: пирамидальную
-: линейную
I:
S: Молекула оксида углерода (IV) содержит _______ связи.
-: 2 σ и 1 π
-: 2 σ
+: 2 σ и 2 π
-: 1 σ и 1 π
I:
S: Молекула PCl3, в которой атом фосфора находится в sp3 гибридном состоянии, имеет _______ форму.
+: пирамидальную
-: линейную
-: угловую
-: плоскую
I:
S: Частицей, которая может являться донором электронной пары, является …
-: CH4
+: NH3
-: CaH2
-: BH3
I:
S: Неспаренные электроны содержатся на молекулярных орбиталях в молекуле …
-: F2
-: N2
-: Ne
+: O2
I:
S: Две π-связи имеются в молекулах…
+: CO2
-: C2H6
-: H3PO4
-: F2
I:
S: Две π -связи имеются в молекулах…
-: C2H6
-: H3PO4
+: HCN
-: F2
I:
S: Водородные связи образуются между молекулами веществ…
-: H2S
+: H2O
-: СС4
-: CH4
I:
S: Водородные связи образуются между молекулами веществ…
-: H2S
-: CH4
+: HF
-: CH4
I:
S: Угловое строение имеют молекулы…
-: CH4
+: H2O
-: CO2
-: СС14
I:
S: Угловое строение имеют молекулы…
-: CH4
-: СС14
-: CO2
+: H2S
I:
S: Центральный атом имеет sp3-гибридизацию в частицах…
+: CH4
-: CO2
-: NO3-
-: РС15
I:
S: Центральный атом имеет sp3-гибридизацию в частицах…
-: РС15
-: CO2
-: NO3-
+: NH4+
I:
S: Ковалентная полярная связь осуществляется в соединениях…
-: H2Se
-: C12
+: CaO
-: F2
I:
S: Ковалентная полярная связь осуществляется в соединениях…
-: H2Se
-: F2
-: C12
+: SO2
V1: Химическая термодинамика и термодинамические функции
I:
S: Термодинамика изучает законы, которые описывают энергетические превращения, сопровождающие:
-: физические процессы;
-: химические процессы;
-: биологические процессы;
+: физические, химические и биологические процессы
I:
S: Однородная система, в которой нет частей, различающихся по свойствам и разделенных поверхностями раздела, называется
+: гомогенной;
-: гетерогенной;
-: закрытой
-: среди ответов нет верного
I:
S: Система, характеризующаяся отсутствием обмена энергией и веществом с окружающей средой, называется
+: изолированной;
-: закрытой;
-: открытой
-: среди ответов нет верного
I:
S: Система, которая обменивается с окружающей средой энергией, а обмен веществом исключен, это
-: изолированная система;
+: закрытой;
-: открытая система
-: среди ответов нет верного
I:
S: Система, обменивающаяся и энергией, и веществом с окружающей средой, называется
-: изолированной;
-: закрытой;
+: открытой
-: среди ответов нет верного
I:
S: Состояние системы, характеризующееся постоянством всех свойств во времени в любой точке системы и отсутствием потоков вещества и энергии в системе, это
+: термодинамическое равновесное состояние;
-: стационарное состояние системы;
-: переходное состояние системы
-: среди ответов нет верного
I:
S: Состояние системы, характеризующееся постоянством свойств во времени, которое поддерживается за счет непрерывного обмена веществом, энергией и информацией между системой и окружающей средой, это
-: термодинамическое равновесное состояние;
+: стационарное состояние системы;
-: переходное состояние системы
-: среди ответов нет верного
I:
S: Состояние системы, характеризующееся изменением свойств системы во времени, это
-: термодинамическое равновесное состояние;
-: стационарное состояние системы;
+: переходное состояние системы
-: среди ответов нет верного
I:
S: Для живого организма характерно
-: термодинамическое равновесное состояние;
+: стационарное состояние системы;
-: переходное состояние системы
-: среди ответов нет верного
I:
S: Процесс как переход системы из одного состояния в другое сопровождается изменением хотя бы одного параметра, характеризующего данную систему
+: необратимый или обратимый;
-: необратимый;
-: обратимый
-: среди ответов нет верного
I:
S: Количественная мера интенсивности различных форм перемещения и взаимодействия частиц в системе, включая перемещение системы в целом и ее взаимодействие с окружающей средой, — это:
-: внутренняя энергия;
+: энергия;
-: Энтальпия
-: среди ответов нет верного
I:
S: Сумма потенциальной и кинетической энергии всех частиц системы, в том числе на молекулярном, атомном и субатомном уровнях, называется
+: внутренней энергией;
-: энергией;
-: работа
-: среди ответов нет верного
I:
S: Энергетическая мера направленных форм движения частиц в процессе взаимодействия системы с окружающей средой — это
+: работа;
-: энергия;
-: внутренней энергией;
-: теплота
I:
S: Энергетическая мера хаотических форм движения частиц в процессе взаимодействия системы с окружающей средой — это
+: работа;
-: энергия;
-: теплота
-: среди ответов нет верного
I:
S: Термодинамическая функция, характеризующая меру неупорядоченности системы, это
-: энтальпия;
+: энтропия;
-: информация
-: среди ответов нет верного
I:
S: Мерой организованности системы является:
-: энтальпия;
-: энтропия;
+: информация
-: среди ответов нет верного
V1: Введение в предмет органической химии
V2: Основные понятия
I:
S: Атомы в молекулах соединены с друг другом химическими связями в соответствии с их:
+: валентностью;
-: природой;
-: строением;
-: среди ответов нет верного
I:
S: Свойства органических соединений зависят от:
-: числа и природы входящих в их состав атомов;
-: от химического строения молекул;
+: от числа и природы входящих в их состав атомов и от химического строения молекул;
-: среди ответов нет верного.
I:
S: Атомы в молекулах органических веществ оказывают влияние на:
-: связанные с ними атомы;
-: не связанные с ними атомы;
+: связанные и не связанные с ними атомы;
-: среди ответов нет верного.
I:
S: Структурная формула-это:
+: изображение последовательности связей в молекуле;
-: изображение качественного состава молекулы;
-: изображение количественного состава молекулы
-: среди ответов нет верного.
I:
S: Систематическая номенклатура IUPAC включает в себя:
-: радикально-функцианальную номенклатуру;
-: заместительную номенклатуру;
+: радикально-функцианальную и заместительную номенклатуру, а также тривиальные названия;
-: среди ответов нет правильного.
I:
S: Структурная формула CH3-CH(OH)-COOH отражает строение:
-: гидроксипропановой кислоты;
+: 2-гидроксипропановой кислоты;
-: 2-карбоксиэтанола;
-: среди ответов нет верного.
V2: Изомерия
I:
S: Изомеры-это вещества:
-: имеющие одинаковый качественный состав, но разное строение;
+: имеющие одинаковый качественный и количественный состав ,но разное строение
-: имеющие одинаковый количественный состав ,но разное строение;
-: среди ответов нет верного.
I:
S: Геометрическая изомерия характерна для соединения …
+: С6Н5-СН = СН-СН3
-: С6Н5-СН = СН2
-: С6Н5-С(СН = СН2
-: С6Н5-С(С6Н = СН-СН3
I:
S: Число изомерных соединений алифатического строения состава С3Н8О равно …
-: 5
-: 4
-: 6
+: 3
I:
S: Оптическая изомерия характерна для …
-: пропановой кислоты
+: 2-аминопропановой кислоты
-: гексена
-: толуола
I:
S: Алкины и алкадиены имеют одинаковую общую формулу CnH2n-2-это изомерия:
+: межклассовая;
-: структурная;
-: пространственная;
-: среди ответов нет верного.
I:
S: Существование цис- и транс- изомеров- это изомерия:
межклассовая;
-: структурная;
+: пространственная;
-: среди ответов нет верного.
I:
S: Изомером бутадиена-1,3 является …
+: бутин-2
-: бутен-2
-: 2-метилпропен
-: циклопентадиен
I:
S: Вещество, формула которого
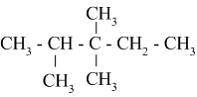 ,
,
называется...
-: 3,3,4 - триметилпентан
-: 2,2,3 - триметилпентан
-: 3,4,4 - триметилпентан
+: 2,3,3 - триметилпентан
V2: Взаимное влияние функциональных групп в молекуле
I:
S: Смещение электронной плотности по цепи σ –связей называется
+: индуктивным эффектом;
-: электронным эффектом;
-: мезомерным эффектом;
-: среди ответов нет верного.
I:
S: Положительный индуктивный эффект способны проявлять:
электроноакцепторные заместители;
+: электронодонорные заместители;
-: и электроноакцепторные заместители, и электоронодонорные заместители;
-: среди ответов нет верного.
I:
S: Отрицательный индуктивный эффект способны проявлять:
+: электроноакцепторные заместители;
-: электронодонорные заместители;
-: и электроноакцепторные заместители, и электоронодонорные заместители;
-: среди ответов нет верного.
I:
S: Влияние заместителя, передающееся по цепи π -связей,называется:
-: индуктивным эффектом;
-: электронным эффектом;
+: мезомерным эффектом;
-: среди ответов нет верного.
I:
S: Положительный мезомерный эффект способны проявлять:
-: электроноакцепторные заместители;
+: электронодонорные заместители;
-: и электроноакцепторные заместители, и электоронодонорные заместители;
-: среди ответов нет верного.
I:
S: Электронодонорные заместители в сопряженной системе:
+: повышают электронную плотность;
-: понижают электронную плотность;
-: не влияют на электронную плотность;
-: среди ответов нет верного.
I:
S: Электроакцепторные заместители в сопряженной системе:
-: повышают электронную плотность;
+: понижают электронную плотность;
-: не влияют на электронную плотность;
-: среди ответов нет верного.
I:
S: Отрицательный мезомерный эффект способны проявлять:
+: электроноакцепторные заместители;
-: электронодонорные заместители;
-: и электроноакцепторные заместители, и электоронодонорные заместители;
-: среди ответов нет верного.
I:
S: В соответствии с теорией химического строения А.М Бутлерова:
+: атомы в молекулах соединены друг с другом химическими связями в соответствии с их валентностью;
-: атомы в молекулах соединены с друг другом химическими связями;
-: свойства органических соединений зависят только от числа и природы входящих в их ---состав атомов;
-: свойства органических соединений зависят только от химического строения молекул;
I:
S: В соответствии с теорией химического строения А.М Бутлерова:
-: атомы в молекулах соединены с друг другом химическими связями;
+: атомы в молекулах органических веществ соединяются между собой в определенной последовательности, что обуславливает химическое строение молекулы;
-: свойства органических соединений зависят только от числа и природы входящих в их -состав атомов;
-: свойства органических соединений зависят только от химического строения молекул;
I:
S: В соответствии с теорией химического строения А.М Бутлерова:
-: атомы в молекулах соединены с друг другом химическими связями;
-: свойства органических соединений зависят только от числа и природы входящих в их состав атомов;
-: свойства органических соединений зависят только от химического строения молекул;
+: свойства органических соединений зависят не только от числа и природы входящих в их состав атомов, но и от химического строения молекул;
I:
S: Согласно теории химического строения А.М Бутлерова:
+: в молекулах существует взаимное влияние атомов как связанных, так и непосредственно
друг с другом связанных;
-: важным ее следствием является то, что органическое соединение может иметь не одну химическую формулу, отражающую его строение;
-: химическое строение вещества нельзя определить в результате изучения его химических превращений и, наоборот, по строению вещества сложно характеризовать его свойства;
-: в молекулах существует взаимное влияние атомов, только непосредственно связанных с друг другом;
I:
S: Согласно теории химического строения А.М Бутлерова:
-: важным ее следствием является то, что органическое соединение может иметь не одну химическую формулу, отражающую его строение;
-: химическое строение вещества нельзя определить в результате изучения его химических превращений и, наоборот, по строению вещества сложно характеризовать его свойства;
+: химическое строение вещества можно определить в результате изучения его химических превращений и, наоборот, по строению вещества можно характеризовать его свойства;
-: в молекулах существует взаимное влияние атомов, только непосредственно связанных с друг другом;
I:
S: Согласно теории химического строения А.М Бутлерова:
-: важным ее следствием является то, что органическое соединение может иметь не одну химическую формулу, отражающую его строение;
-: химическое строение вещества нельзя определить в результате изучения его химических превращений и, наоборот, по строению вещества сложно характеризовать его свойства;
-: в молекулах существует взаимное влияние атомов, только непосредственно связанных с друг другом;
+: важным ее следствием является то, что каждое органическое соединение должно иметь одну химическую формулу, отражающую его строение.
V2: Механизмы реакций в органической химии
I:
S: Группа атомов, определяющая характерные свойства определенного класса органических соединений, называется ...
-: структурным звеном
+: функциональной
-: гомологической
-: радикалом
I:
S: Для ионных реакций органических соединений характерно:
+: это процессы, идущие с гетеролитическим разрывом ковалентных связей, когда оба электрона связи остаются с одной из ранее связанных частиц;
-: это процессы, идущие с гомолитическим разрывом ковалентной связи;
в результате гомолитического разрыва образуются свободные радикалы;
-: пара электронов, образующая связь, делится таким образом, что каждая из -образующихся частиц получает по одному электрону;
I:
S: Для ионных реакций органических соединений характерно:
-: это процессы, идущие с гомолитическим разрывом ковалентной связи;
-: в результате гомолитического разрыва образуются свободные радикалы;
-: пара электронов, образующая связь, делится таким образом, что каждая из образующихся частиц получает по одному электрону;
+: в результате гетеролитического разрыва связи получаются заряженные частицы: нуклеофильная и элктрофильная;
I:
S: Для ионных реакций органических соединений характерно:
-: это процессы, идущие с гомолитическим разрывом ковалентной связи;
-: в результате гомолитического разрыва образуются свободные радикалы;
пара электронов, образующая связь, делится таким образом, что каждая из образующихся частиц получает по одному электрону;
+: образующаяся нуклеофильная частица(нуклеофил) имеет пару электронов на внешнем энергетическом уровне, а электрофильная частица (электрофил) имеет незаполенный валентный электронный уровень.
I:
S: Для радикальных реакций органических соединений характерно:
-: это процессы, идущие с гетеролитическим разрывом ковалентных связей, когда оба электрона связи остаются с одной из ранее связанных частиц;
+: это процессы, идущие с гомолитическим разрывом ковалентной связи;
-: в результате гетеролитического разрыва связи получаются заряженные частицы: нуклеофильная и электрофильная;
-: образующаяся нуклеофильная частица(нуклеофил) имеет пару электронов на внешнем энергетическом уровне, а электрофильная частица (электрофил) имеет незаполенный валентный электронный уровень.
I:
S: Для радикальных реакций органических соединений характерно:
это процессы, идущие с гетеролитическим разрывом ковалентных связей, когда оба электрона связи остаются с одной из ранее связанных частиц;
+: в результате гомолитического разрыва образуются свободные радикалы;
-: в результате гетеролитического разрыва связи получаются заряженные частицы: нуклеофильная и электрофильная;
-: образующаяся нуклеофильная частица(нуклеофил) имеет пару электронов на внешнем энергетическом уровне, а электрофильная частица (электрофил) имеет незаполенный валентный электронный уровень.
I:
S: Для радикальных реакций органических соединений характерно:
это процессы, идущие с гетеролитическим разрывом ковалентных связей, когда оба электрона связи остаются с одной из ранее связанных частиц;
+: пара электронов,образующая связь, делится таким образом, что каждая из образующихся частиц получает по одному электрону;
-: в результате гетеролитического разрыва связи получаются заряженные частицы: нуклеофильная и электрофильная;
-: образующаяся нуклеофильная частица(нуклеофил) имеет пару электронов на внешнем энергетическом уровне, а электрофильная частица (электрофил) имеет незаполенный валентный электронный уровень.
I:
S: При нитровании бензойной кислоты преимущественно образуется ________________кислота.
-: 5-нитробензойная
+: 3-нитробензойная
-: 2-нитробензойная
-: 4-нитробензойная
I:
S: При хлорировании бутадиена-1,3 в среде инертного растворителя при повышении температуры преимущественно образуется …
-: 1,2-дихлорбутен-2
+: 1,4-дихлорбутен-2
-: 2,3-дихлорбутен-2
-: 1,4-дихлорбутан
I:
S: Механизм реакции взаимодействия метана с хлором при облучении называется …
-: ионным
-: нуклеофильным
+: радикальным
-: электрофильным
I:
S: Хлорирование бензола на свету протекает по ________ механизму.
-: нуклеофильному
-: молекулярному
-: донорно-акцепторному
+: радикальному
I:
S: Присоединение галогеноводородов к алкенам протекает по правилу ...
-: Вернера
+: Марковникова
-: Вант-Гоффа
-: Зайцева
I:
S: Этиловый спирт имеет t кип=78°С, а диметиловый эфир-t кип= -24С. Вместе с тем общая формула этих соединении одинаковая- С2H6O. С чем это связано?
+: между молекулами этанола образуется межмолекулярная водородная связь
-: между молекулами этанола образуется внутримолекулярная водородная связь
-: между молекулами диметилового эфира образуется межмолекулярная водородная связь
-: между молекулами диметилового эфира образуется внутримолекулярная водородная связь
V1: Алифатические углеводороды: алканы, алкены, алкадиены, алкины.
V2: Номенклатура,строение и химические свойства
I:
S: Насыщенные углеводороды, молекулы которых состоят из атомов углерода и водорода, связанных между собой только σ -связями, называются:
+: алканами;
-: алкенами;
-: алкинами;
-: среди ответов нет верного.
I:
S: Общая формула алканов:
+: CnH2n+2;
-: СnH2n;
-: CnH2n-2;
-: среди ответов нет верного.
I:
S: Атомы углерода в этане находятся в состоянии:
+: sp3-гибридизации;
-: sp2- гибридизации;
-: sp- гибридизации;
-: среди ответов нет верного.
I:
S: Алканы участвуют в реакциях:
-: полимеризации;
-: присоединения;
+: замещения;
-: среди ответов нет верного.
I:
S: Ненасыщенные углеводороды, в молекулах которых имеется одна двойная связь , называются:
-: алканами;
+: алкенами;
-: алкинами;
-: среди ответов нет верного.
I:
S: Общая формула алкенов:
-: CnH2n+2;
+: СnH2n;
-: CnH2n-2;
-: среди ответов нет верного.
I:
S: Атомы углерода в этилене находятся в состоянии:
-: sp3-гибридизации;
+: sp2- гибридизации;
-: sp- гибридизации;
-: среди ответов нет верного.
I:
S: В соответствии с правилом Марковникова, при присоединении молекул типа HX к несимметричным алкенам водород присоединяется к:
+: более гидрогенизируемому атому С двойной связи;
-: менее гидрогенизируемому атому С двойной связи;
-: различным атомам С двойной связи в зависимости от условий;
-: среди ответов нет верного.
I:
S: Выберите продукт, который образуется при присоединении бромоводорода к пропену:
-: 1-бромпропан;
+: 2-бромпропан;
-: 3-бромпропан;
-: среди ответов нет верного.
I:
S: Натуральный каучук представляет собой:
-: полипропилен;
+: полиизопрен;
-: полибутадиен-1,3;
-: среди ответов нет верного.
I:
S: Ненасыщенные углеводороды, содержащие в молекуле одну тройную связь, называются:
-: алканами
-: алкенами;
+: алкинами;
-: среди ответов нет верного.
I:
S: Общая формула алкинов:
-: CnH2n+2;
-: СnH2n;
+: CnH2n-2;
-: среди ответов нет верного.
I:
S:
Структурная формула
![]() соответствует:
соответствует:
-: бутену;
+: бутину-1;
-: бутину-2
-: среди ответов нет верного.
I:
S: Атомы углерода в этине находятся в состоянии:
-: sp3-гибридизации;
-: sp2- гибридизации;
+: sp- гибридизации;
-: среди ответов нет верного.
I:
S:
Структурная формула
![]() соответствует:
соответствует:
-: бутену;
-: бутину-1;
+: бутину-2
-: среди ответов нет верного.
I:
S: Для алканов характерны реакции:
-: гидрирования;
+: галогенирования по механизму свободно-радикального замещения;
-: гидратции;
-: гидрогалогенирования.
I:
S: Для алканов характерны реакции:
-: гидрирования;
-: гидратции;
+: нитрования по механизму свободно-радикального замещения;
-: гидрогалогенирования.
I:
S: Для алканов характерны реакции:
-: гидрирования;
-: гидратции;
+: окисления;
-: гидрогалогенирования.
I:
S: Для алкенов характерны реакции:
-: гидрогалогенирования по механизму свободно-радикального замещения;
-: нитрования по механизму свободно-радикально замещения;
-: галогенирования по механизму свободно-радикального замещения;
+: гидрогалогенирования по механизму электрофильного присоединения.
I:
S: Для алкенов характерны реакции:
-: гидрогалогенирования по механизму свободно-радикального замещения;
+: галогенирования по механизму электрофильного присоединения;
-: нитрования по механизму свободно-радикально замещения;
-: галогенирования по механизму свободно-радикального замещения;
I:
S: Для алкенов характерны реакции:
-: гидрогалогенирования по механизму свободно-радикального замещения;
+: гидрации по механизму электрофильного присоединения;
-: нитрования по механизму свободно-радикально замещения;
-: галогенирования по механизму свободно-радикального замещения;
I:
S: Для алкинов характерны реакции:
-: гидрогалогенирования по механизму свободно-радикального замещения;
+: галогенирования по механизму электрофильного присоединения;
-: нитрования по механизму свободно-радикально замещения;
-: галогенирования по механизму свободно-радикального замещения;
I:
S: Для алкинов характерны реакции:
-: гидрогалогенирования по механизму свободно-радикального замещения;
+: гидрации по механизму электрофильного присоединения;
-: нитрования по механизму свободно-радикально замещения;
-: галогенирования по механизму свободно-радикального замещения;
I:
S: Для алкинов характерны реакции:
-: гидрогалогенирования по механизму свободно-радикального замещения;
-: нитрования по механизму свободно-радикально замещения;
-: галогенирования по механизму свободно-радикального замещения;
+: гидрогалогенирования по механизму электрофильного присоединения.
I:
S: С бромной водой взаимодействуют ...
+: этен и пропен
-: метан и этен
-: пропан и этен
-: этан и пропен
I:
S: Бензиновая фракция содержит углеводороды состава…
-: С2-С4
-: С12-С20
+: С5-С8
-: С12-С18
V1: Циклические углеводороды: циклоалканы, арены
I:
S: Насыщенные алициклические углеводороды называют:
-: циклоалкадиенами;
-: циклоалкенами;
+: циклоалканами;
-: среди ответов нет верного.
I:
S: Ненасыщенные алициклические углеводороды с одной двойной связью называют:
-: циклоалкадиенами;
+: циклоалкенами;
-: циклоалканами;
-: среди ответов нет верного.
I:
S: Ненасыщенные алициклические углеводороды с двумя двойными связями называют:
+: циклоалкадиенами;
-: циклоалкенами;
-: циклоалканами;
-: среди ответов нет верного.
I:
S: Углеводороды бензольного ряда-это:
-: алкены;
-: алкины;
+: арены;
-: среди ответов нет верного.
I:
S: Атомы углерода в бензоле находятся в состоянии:
-: sp3-гибридизации;
+: sp2- гибридизации;
-: sp- гибридизации;
-: среди ответов нет верного.
I:
S: Согласно правилу Хюккеля, ароматические молекулы должны иметь:
+: плоский циклический σ -скелет и число обобщенных π -электронов, равное 4n+2;
-: плоский циклический σ -скелет и число обобщенных π -электронов, равное 2n+2;
-: плоский циклический σ -скелет и число обобщенных π -электронов, равное 4n
-: среди ответов нет верного.
I:
S: Химические свойства ароматических углеводородов определяются в первую очередь наличием в их молекулах:
-: заместителей;
+: сопряженной системы;
-: заместителей и сопряженной системы;
-: среди ответов нет верного.
I:
S: Арены склонны к реакциям:
-: присоединения;
-: окисления;
+: замещения;
-: среди ответов нет верного.
I:
S: Для Аренов характерно:
они склонны к таким реакциям, в результате которых нарушается ароматичность;
+: реакции электофильного замещения в ароматическом ядре;
-: реакции свободно-радикального замещения в ароматическом ядре;
-: реакции окисления;
I:
S: Для Аренов характерно:
-: они склонны к таким реакциям, в результате которых нарушается ароматичность;
-: реакции свободно-радикального замещения в ароматическом ядре;
-: реакции окисления;
+: химические свойства определяются в первую очередь наличием в их молекулах сопряженной системы- они склонны к таким реакциям , в результате которых сохраняется ароматичность.
I:
S: Для ароматических углеводородов, в отличие от алкенов, более характерны реакции …
-: присоединения
+: замещения
-: гидрогалогенирования
-: гидратации
V1: Галогенопроизводные углеводородов
I:
S: Галогенопроизводные алканов относятся к галогенопроизводным:
+: алифатическим;
-: алицикличесеким;
-: ароматическим;
-: среди ответов нет верного.
