
Домашняя контрольная работа 3 - Егорова - 2009
.pdf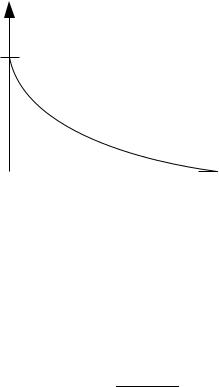
1. Изложите суть вариационного принципа.
Вариационный принцип утверждает, что среднее значение энергии Еi любого из возможных i-х состояний системы, вычисленное с приближённой волновой функцией, не может быть меньше нижнего собственного значения E0 оператора
H.
Его суть следующая: если мы имеем точное решение уравнения Шрёдингера, т.е. набор собственных функций ψj и спектр собственных значений Еj, то, вставляя в это уравнение любую нормированную функциию ψi, мы получим нижнее значение энергии Ei не меньшее (а как правило, намного большее), чем самое нижнее из спектра Ej.
Таким образом, чтобы решить уравнение Шрёдингера (или приблизиться к решению), нужно минимизировать выражение для энергии E = <ψ|H|ψ>, то есть подобрать такие волновые функции, для которых энергия будет минимальна, что можно сделать, если волновая функция включает некоторые переменные параметры, изменяя которые, можно обеспечить минимум.
2. Что такое узлы атомной радиальной функции? Как сосчитать их число?
Узлы атомной радиальной функции — это точки, в которых она обращается в нуль, при этом меняется её знак.
Число узлов радиальной функции равно n - l - 1, где n и l — главное и орбитальное квантовые числа соответственно.
3. Приведите зависимость интеграла перекрывания Sij от межъядерного расстояния для связи типа σ(s, s).
Sij
1
0
 Rij
Rij
4. Почему нельзя получить точное решение уравнения Шрёдингера для систем, содержащих больше одного электрона?
Каждый из электронов в таких системах движется не только в поле ядер, но и в поле, создаваемом остальными электронами, соответственно в оператор полной энергии системы необходимо вводить оператор потенциальной энергии межэлектронного отталкивания:
VЭЭ r = ∑i ∑j 4 e20 rij ; i≠ j
Втаком случае переменные ri и rj в гамильтониане разделить невозможно (по
крайней мере, при современном уровне развития аналитических методов решения дифференциальных уравнений), и, соответственно, нахождение точного решения уравнения Шрёдингера не представляется возможным.
