
- •3.1. Система уравнений математического описания
- •3.3. Информационная матрица
- •§1. Принципы построения компьютерных моделей гомогенных химических реакторов с мешалкой.
- •1.1. Микрокинетика сложной химической реакции
- •1.2. Выбор ключевых компонентов химической реакции.
- •3.3. Информационная матрица.
- •3.4. Блок-схема алгоритма расчёта.
Вернуться к списку лекций
Тема 04: Построение компьютерных моделей гомогенных химических реакторов с мешалкой.
Содержание
§1. Принципы построения компьютерных моделей гомогенных химических реакторов с мешалкой.
1.1. Микрокинетика сложной химической реакции
1.2. Выбор ключевых компонентов химической реакции
§2. Реактор с мешалкой в стационарном состоянии.
2.1. Основные допущения
2.2. Уравнения балансов для основного и вспомогательного (теплового) потоков
2.3. Система уравнений математического описания
2.4. Информационная матрица
2.5. Блок – схема алгоритма
§3. Реактор с мешалкой – динамическая модель.
3.1. Система уравнений математического описания
3.2. Непрерывные и периодические процессы
3.3. Информационная матрица
3.4. Блок-схема алгоритма расчёта
Задания для самопроверки
Содержание
§1. Принципы построения компьютерных моделей гомогенных химических реакторов с мешалкой.
МО + МА → ММ
Макрокинетические уравнения – уравнения балансов, записанные с учётом гидродинамической модели движения потока (уравнения покомпонентного баланса, общего баланса массы, энергетический (тепловой) баланс), которые включают в виде слагаемых выражения для интенсивности источников (скоростей) различных «элементарных» процессов, как например, химических превращений, массо- и теплопередачи, фазовых переходов и т.д.
Микрокинетические уравнения – записываются для элементарного объёма, вне зависимости от того, в каком потоке протекает процесс (например, уравнения скорости протекания химических реакций для каждого компонента, уравнения скорости выделения и поглощения тепла за счёт химической реакции). Эти уравнения скоростей называются интенсивностями источников компонентов или локальными интенсивностями источников тепла и включаются в уравнения покомпонентного баланса, уравнение общего баланса массы, а также в уравнения теплового баланса.
Содержание
1.1. Микрокинетика сложной химической реакции
Скорость химической реакции по каждому компоненту:
n – компонентов, m –стадий, реакция в жидкой фазе
![]()
Локальная (отнесённая к единице объёма) скорость выделения или поглощения тепла в химической реакции:
![]()
I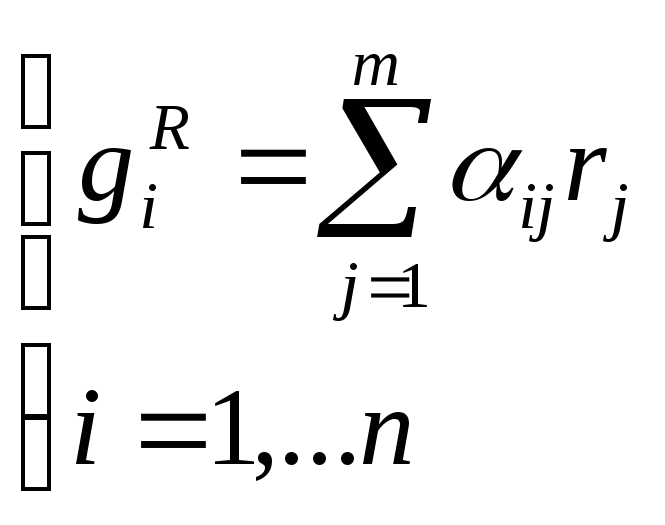 )
)
rj – скорость j – ой стадии химической реакции, определяемая по закону действующих масс.
αij – стехиометрический коэффициент i – го компонента на j – ой стадии.
αij > 0 i = п - продукт на j – ой стадии;
αij < 0 i = р - реагент на j – ой стадии;
αij = 0 i - отсутствует.
![]() > 0
- компонент
i
образуется;
> 0
- компонент
i
образуется;
![]() < 0
- компонент
i
расходуется;
< 0
- компонент
i
расходуется;
![]()
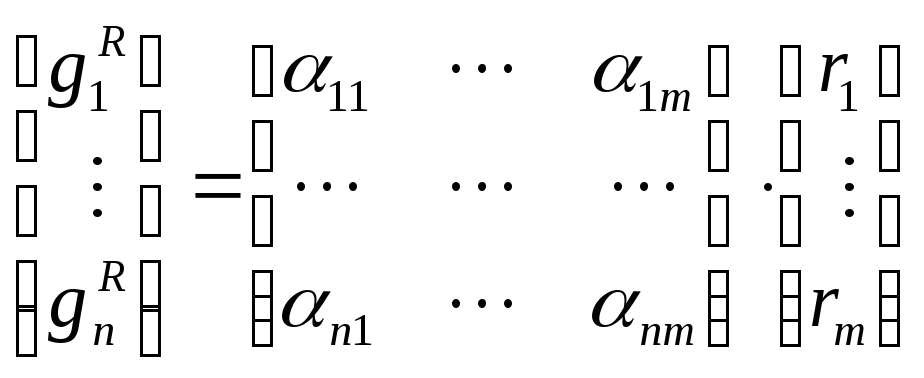

n = 4, m = 3
![]()
П - произведение
![]() если i
- реагент
если i
- реагент
![]() если i
- продукт или отсутствует
если i
- продукт или отсутствует
( j = 1,…m )
Для рассматриваемого уравнения реакции:
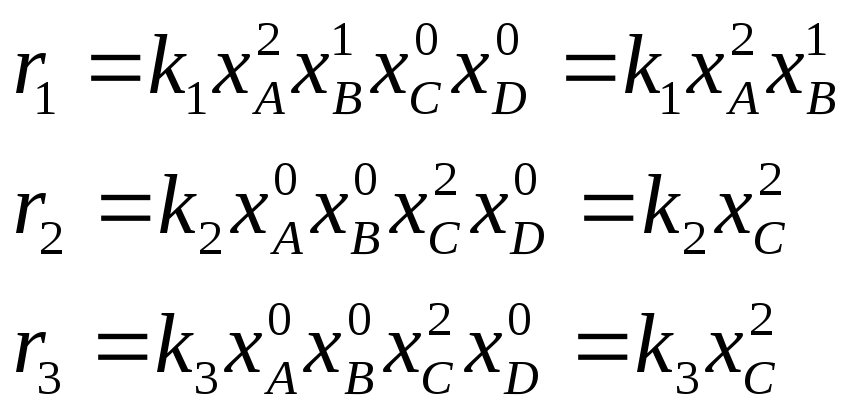

Содержание
1.2. Выбор ключевых компонентов химической реакции.
Компоненты химической реакции бывают ключевыми и не ключевыми.
Ключевые компоненты – это компоненты, задание которых однозначно характеризует состояние процесса, сопровождаемого химической реакцией, в любой момент времени. Уравнения МО с учётом гидродинамических условий и микрокинетических закономерностей записываются только для ключевых компонентов, в то время как остальные (не ключевые) компоненты определяются из стехиометрических соотношений.
Процедура выбора ключевых компонентов сложной химической реакции связана с понятием ранга матрицы стехиометрических коэффициентов, который характеризует максимальное число линейно независимых строк или столбцов этой – в общем случае прямоугольной – матрицы.
Для прямоугольной матрицы стехиометрических коэффициентов размера n х m определитель квадратной подматрицы s-го порядка называется минором s-го порядка матрицы стехиометрических коэффициентов. Рангом матрицы называется максимальный порядок её минора, отличного от нуля. Если матрица стехиометрических коэффициентов имеет минор порядка s, который отличен от нуля, а любой другой минор порядка s+1 и выше равен нулю, то ранг матрицы равен s. Очевидно, что ранг матрицы может быть определён как для квадратной, так и для прямоугольной матриц.
Ранг матрицы стехиометрических коэффициентов равен числу ключевых компонентов химической реакции.
Для математической модели нужна скорость реакции по каждому компоненту. Если удаётся выразить скорости образования одних компонентов через скорости образования других – ключевых компонентов – сокращается количество сложных, в общем случае нелинейных кинетических уравнений, необходимых для описания всего процесса. В результате по концентрациям ключевых компонентов через стехиометрические соотношения можно рассчитать состав всей реагирующей смеси в любой момент времени.
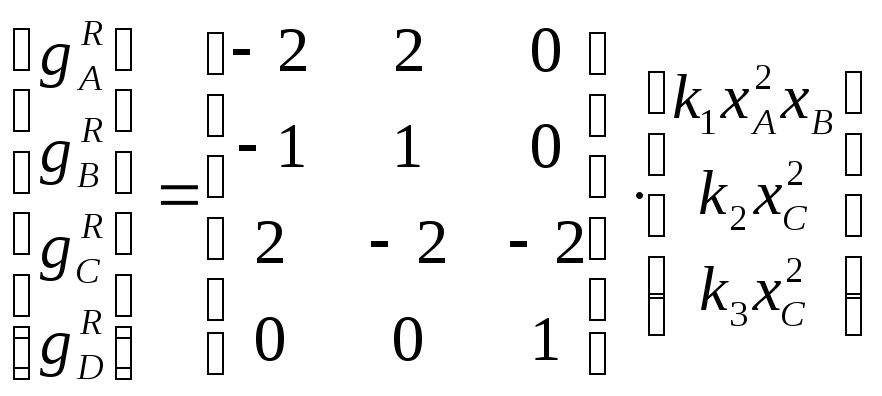
Матрица стехиометрических коэффициентов для рассматриваемого уравнения имеет вид:
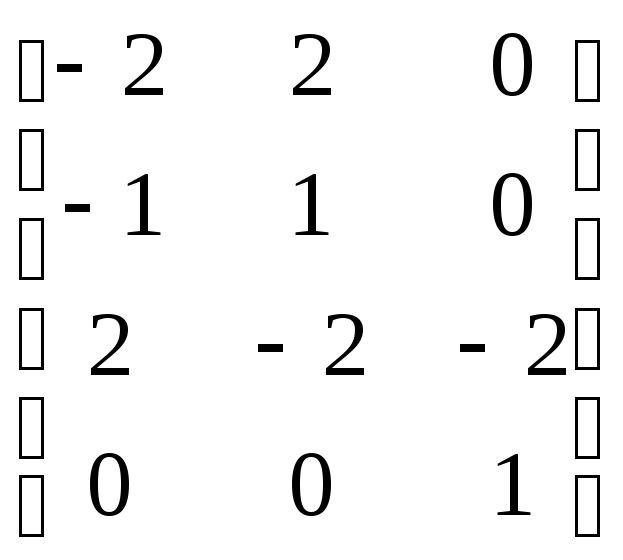
Задача выбора ключевых компонентов реакции сводится к нахождению ранга матрицы стехиометрических коэффициентов. Ранг матрицы, число и наименование ключевых компонентов определяют методами матричного исчисления.
Определим ранг матрицы стехиометрических коэффициентов:
Миноры матриц 3Х3 = 0:

Для матриц 2Х2 есть миноры не равные 0, наивысший порядок минора =2. Ранг матрицы коэффициентов = 2.
Имеем 2 ключевых компонента.
Для скоростей химической реакции по компонентам будет справедливо:
![]()
В результате в качестве ключевых выбираем компоненты А и С:
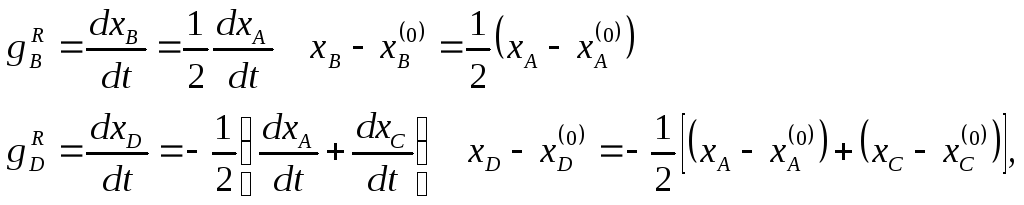
Таким образом, окончательный вид системы уравнений для описания скоростей химической реакции по компонентам включает два кинетических уравнения (вместо первоначальных четырёх) и может быть представлен:
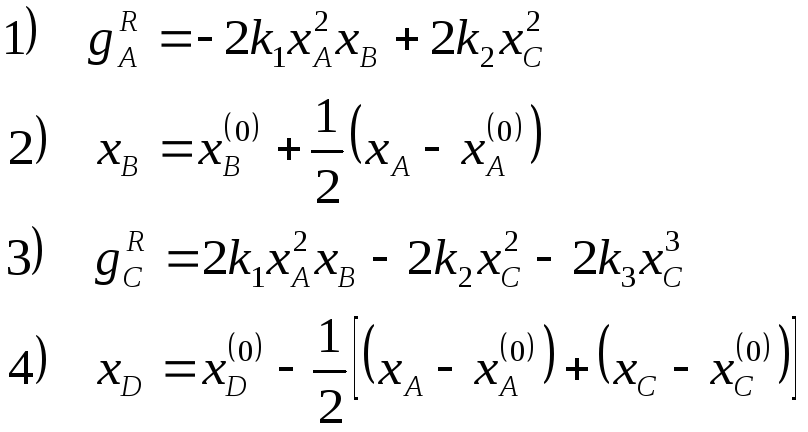
При этом константы скоростей стадий в соответствии с законом Аррениуса выражаются:

![]() - тепловой эффект
j-
стадии, отнесённый к 1 молю продукта р.
- тепловой эффект
j-
стадии, отнесённый к 1 молю продукта р.
Содержание
§2. Реактор с мешалкой в стационарном состоянии.

Содержание
2.1. Основные допущения:
-
В реакторе МИС.
-
В рубашке МИС.
-
Уравнения математической модели записываются для стационарного режима.
-
Реакции в реакторе гомогенные, нет фазовых переходов; все
-
процессы в жидкой фазе, все реакции протекают одновременно.
-
Теплопередача, теплоизлучение отсутствуют.
Содержание
2.2. Уравнения балансов для основного и вспомогательного (теплового) потоков


![]() - интенсивность
локальной теплопередачи через поверхность
F
- интенсивность
локальной теплопередачи через поверхность
F
![]() - интенсивность
локального источника тепла химической
реакции в объёме V
- интенсивность
локального источника тепла химической
реакции в объёме V
![]() - интенсивность
локального источника компонента за
счёт химической реакции.
- интенсивность
локального источника компонента за
счёт химической реакции.
Содержание
2.3. Система уравнений математического описания:

Содержание
2.4. Информационная матрица
Содержание
2.5. Блок – схема алгоритма

Содержание
§3. Реактор с мешалкой – динамическая модель.
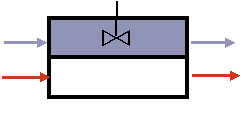
Содержание
3.1. Система уравнений математического описания:
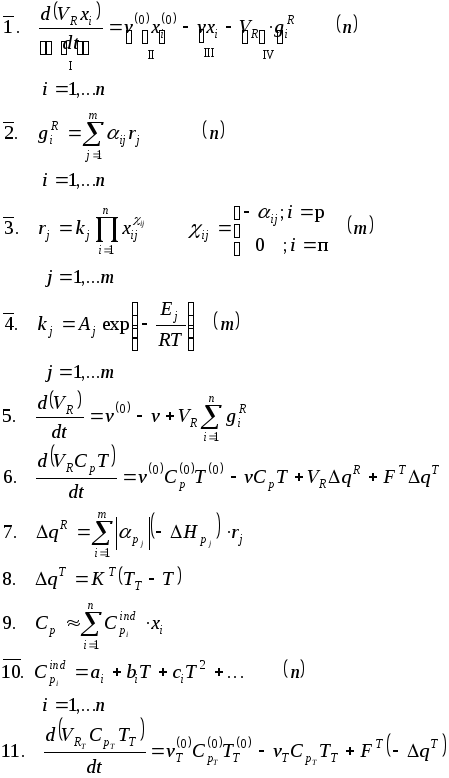
Содержание
3.2. Непрерывные и периодические процессы.
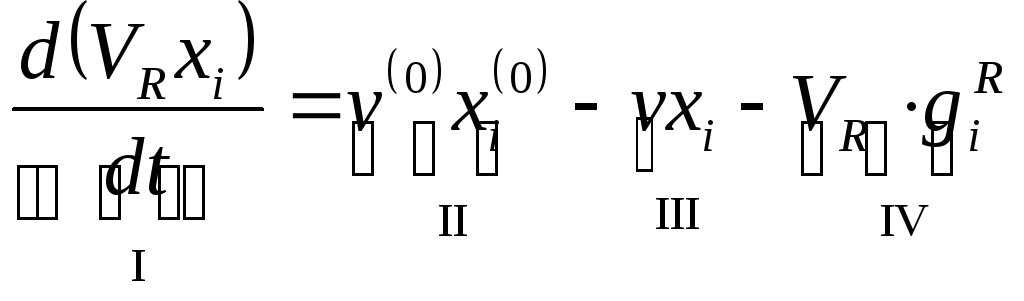
Процесс будет периодическим, если члены II и III равны 0.
Процесс будет полупериодическим или полунепериодическим, если либо II либо III равны 0.Если присутствуют все члены уравнения – это непрерывный, динамический (нестационарный) процесс.Если I равен нулю, то мы имеем непрерывный статический (стационарный) процесс.
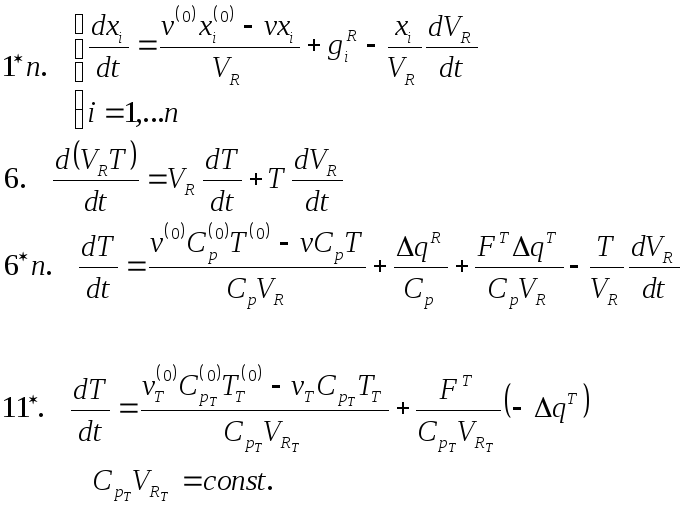
Нужно задать дополнительные условия (решаем задачу Коши – получения частного решения)
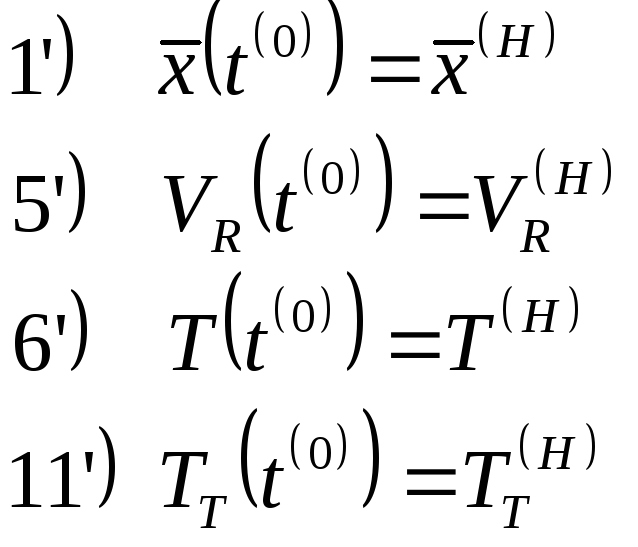
Содержание
