
- •Развитие производства благородных металлов
- •Производство серебра
- •Применение благородных металлов
- •Поведение благородных металлов в различных средах
- •Азотно-кислые среды
- •Солянокислая среда
- •Аммиачные системы
- •Нитритные системы
- •Гидроксиды пм
- •Руды и минералы Au, Ag. Формы нахождения Au, Ag в рудах
- •Формы нахождения
- •Пробность
- •Схемы переработки кварцевых руд
- •Блок-схема переработки кварцево-сульфидных руд
- •Механическая подготовка руды
- •I. Метод амальгамации
- •II. Плавка золотой головки
- •III. Гидрометаллургичесие методы
- •Цианирование золотосодержащих руд
- •Химизм процесса
- •Термодинамика процесса
- •Кинетика процесса
- •Факторы, влияющие на процесс цианирования
- •III. Влияние температуры
- •Практика цианирования
- •Схемы цианирования
- •II. Метод кучного выщелачивания
- •Хвостывосты
- •Пачуки. Рисунок 17.
- •Разделение золотосодержащих пульп
- •Цементация Zn
- •Электрохимическая природа цементации
- •Влияние примесей на процесс
- •Практика цементации
- •Переработка Au-Zn осадков (цианшламов)
- •Методы переработки
- •Свойства смол-сорбентов
- •Свойства смол. К смолам предъявляются следующие требования :
- •Закономерности сорбционного выщелачивания
- •Кинетика и механизм сорбции
- •Практика сорбционного выщелачивания
- •Параметры сорбционного выщелачивания
- •Аппаратура сорбционного цианирования
- •Регенерация смолы
- •Электролитическое выделение Au из тиомочевинного элюата
- •Устройство электролизной ванны
- •Сорбция на активированных углях
- •Особенности углеродистых сорбентов
- •Области применения активированных углей
- •Обезвреживание сточных вод зиф
- •Аффинаж золота и серебра
- •Хлорный процесс
- •Ag выделяют двумя способами:
- •Поведение примесей
- •Аппаратурное оформление
- •Ванны с горизонтальным расположением электродов
- •Электролитическое рафинирование Au
- •Поведение примесей
- •Аппаратура
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ»
ИНСТИТУТ ЦВЕТНЫХ МЕТАЛЛОВ ИЗОЛОТА
Авторы: Перфильева Надежда Сергеевна
Рюмин Анатолий Иннокентьевич
Соркинова Галина Анатольевна
МЕТАЛЛУРГИЯ БЛАГОРОДНЫХ МЕТАЛЛОВ
Учебное пособие для студентов специальности «Металлургия цветных металлов»
Красноярск 2007
Общие сведения о благородных металлах. Состояние производства и потребления
К благородным металлам относят: Au, Ag; 6 металлов платиновой группы Pr, Rd, Os, Rh, Ru, Yr. Они обладают высокой устойчивостью к различного рода химических воздействий. С физико-химической точки зрения это объясняется высокими значениями потенциала ионизации и (если раствор) высоким положительным значением стандартных электродных потенциалов. Эти металлы мало распространены в земной коре:
O2 – 49,5 %; U – 5*10-4 %;
Al – 7,5 %; Au – 5*10-7 %;
Si – 25,75 %; Ag – 4*10-6 %;
Fe – 4,7 %; Pt – 2*10-5 %;
Cu – 0,01 %; Pd – 2*10-6 %;
Zn – 0,02 %; Os, Rh, Ru, Yr – 1*10-7 %.
W – 7*10-3 %;
Благородные металлы сконцентрированы в гидротермальных жилах, образуя месторождения. Промышленными считаются руды с содержанием Au 56 г/т, но перерабатывают руды с 1 2 г/м Au.
Степень обогащения материала: Ст. об >106 раз.
Процесс переработки руд благородных металлов делится на 2 производства:
1. Переработка руды с целью получения концентратов металлов с содержанием их 3 ÷ 95%;
2. Переработка концентратов с целью получения чистых металлов (аффинаж).
Развитие производства благородных металлов
В настоящее время добыто 90 тыс. тонн Au, которое получают из коренных месторождений, из россыпных месторождений и комплексных полиметаллических руд.
Крупнейшее месторождение в ЮАР: Витватерсранд (7080% от мировой добычи), (1300 1700 т /год в мире); ЮАР 900 1000 т/год; Россия 250 270 т/год ; Канада 170 т/год; США 295 т/год; Австралия 240 т/год; Бразилия 90 т/год и т.д;
В России первый рудник был открыт на Урале в 1874г.
В России добывают золото: Алтай, Енисей – 4 т; Урал – 12 т; Лен-золото 10 т;
Забайкалье 20 т; Якутия 28 т; Магадан 4045 т; Примор-золото 11т.
Производство серебра
Производство серебра осуществляется из полиметаллических руд и в меньшей степени из чисто серебряных руд.
Крупнейшие производители:
Мексика - 1500 т; США - 1300 т; Канада - 1100 т; Перу -1000 т; Боливия - 190 т; Гондурас - 120 т и т.д.
Bсего производится 800 1000 т серебра.
В России серебро получают при комплексной переработке медных и свинцово-цинковых руд. Платиновых металлов производят около 200 т.
Первые упоминания о Pt относятся к 1757г.
B 1802г. из Pt выделили Pd и Rh (при очистке Pt). В 1804г. при очистке Pt выделили Yr и Os, а в 1844г. открыли Ru.
Крупнейшим производителями ПМ является Россия (Норильск, более 100 т/год.), ЮАР, Канада, США.
Состояние рынка благородных металлов: для них характерен постоянный рост цен. Одна тройская унция = 31,1039807г.
- Au 450-480 $ за унцию;
- Pt 460-480 $ за унцию;
- Pd 190-200 $ за унцию;
- Yr 440 $ за унцию;
- Rh 420 $ за унцию;
- Ru 45 $ за унцию;
- Os 155 $ за унцию.
Применение благородных металлов
Золото:
1. Государственный резерв частные накопления;
2. Страховой и резервный фонд для получения валюты в любом банке;
3. Космическая, оборонная, электронная отрасли промышленности;
4. В качестве катализатора;
5. В ювелирной технике;
6. В медицине (противораковые препараты из солей золота).
Серебро:
1. Кино- и фототехника (высокая светочувствительность);
2. Припои, электрические сопротивления в различных приборах (высокая электропроводность);
3. Для изготовления аккумуляторов;
4. Как катализатор;
5. Медицина (бактерицидные свойства).
Платиновые металлы:
1. Для изготовления фильтров при очистке выхлопных газов;
2. Очистные сооружениях;
3. Нефтехимическая, химическая промышленность;
4. Стекольная, вискозная промышленность;
5. Электротехника;
6. Космическая техника, покрытия.
Физические и химические свойства благородных металлов
Положение металлов в периодической системе Д.И. Менделеева.
Атомные характеристики.
Au,Ag – в 1 группе.
ПМ – в 8 группе.
Атомные характеристики их приведены в таблице 1
Таблица 1
|
Параметры |
Ru |
Rh |
Pd |
Ag |
Os |
Yr |
Pt |
Au |
|
Атомный номер |
44 |
45 |
46 |
47 |
76 |
77 |
78 |
79 |
|
Атомная масса |
101,1 |
102,9 |
106,4 |
107,9 |
190,2 |
192,2 |
195,1 |
197 |
|
Атомный радиус, нМ |
0,134 |
0,134 |
0,137 |
0,144 |
0,135 |
0,163 |
0,138 |
0,144 |
|
Электронная Конфигурация |
4d75S1 |
4d85S1 |
4d105S0 |
4d105S1 |
5d66S2 |
5d76S2 |
5d96S1 |
5d106S1 |
|
Потенциал ионизации, эВ |
7,36 |
7,46 |
8033 |
7057 |
807 |
9 |
9 |
9022 |
|
Радиус иона, нМ |
0,062 |
0,065 |
0,064 |
0,113 |
0,065 |
0,065 |
0,064 |
0,137 |
|
Характерные степени окисления |
3,4,6,8, |
3 |
2,4 |
100,799 |
4,6,8 |
3,4 |
2,4 |
1,3 |
|
Нормальный электродный потенциал [МеZ+(Н2О)n]/Ме |
0,45 (III) |
0,8 |
0,987 |
0,799 |
0,85 (IV) |
1,15 (IV) |
1,2 (IV) |
1,5 (III) 1,88 (I) |
Условно все эти металлы разделяют на легкие и тяжелые. Близость атомных радиусов обуславливает легкую их сплавляемость друг с другом. Поэтому в рудах они присутствуют чаще всего в виде твердых растворов:
Os-Yr; Au-Pd; Pt-Os-Yr; Pd-Pt.
Наличие электронов на d-орбиталях позволяет относить благородные металлы к категории переходных, т.е. способных образовывать соединения в различных степенях окисления. Малые ионные радиусы и наличие незаполненных d- орбиталей обуславливает высокие комплексообразующие свойства благородных металлов, поэтому в растворах (водных средах) благородные металлы, за исключением серебра, всегда находятся в виде комплексных соединений: H[AuCl4]; H2[PtCl6].
Высокие значения потенциалов ионизации и электродных потенциалов свидетельствуют о ‘‘ благородстве ’’.
Высокая плотность БМ и присутствие их в рудах в самородном состоянии позволяет извлекать эти металлы гравитационными методами. Наиболее легкоплавкими металлами являются Au и Ag, тугоплавким металлом – Os.


 На производстве
Pd,
Ag,
Pt,
Au,
выпускают в виде слитков. Все остальные
металлы выпускают в виде порошка.
Металлы имеют высокие температуры
кипения, однако при пирометаллургической
переработке наблюдается унос Os,
Ag
в газовую фазу в виде летучих оксидов:
OsO4
, RuO4,
AgCl
. Ag,
Au
являются очень пластичными металлами
(из 0,5 г Au
или 50 г Ag
можно вытянуть 150 м проволоки толщиной
0,0001мм).
На производстве
Pd,
Ag,
Pt,
Au,
выпускают в виде слитков. Все остальные
металлы выпускают в виде порошка.
Металлы имеют высокие температуры
кипения, однако при пирометаллургической
переработке наблюдается унос Os,
Ag
в газовую фазу в виде летучих оксидов:
OsO4
, RuO4,
AgCl
. Ag,
Au
являются очень пластичными металлами
(из 0,5 г Au
или 50 г Ag
можно вытянуть 150 м проволоки толщиной
0,0001мм).
Pt и Pd поддаются механической обработке при необходимом подогреве. Ru, Rh, Os, Yr - твердые хрупкие металлы, находят применение только в виде сплавов.
ПМ, находящиеся, в виде черни (тонкодисперсный порошок) обладают высокой способностью адсорбировать газы:
1 Pd - 900 H2
1 Pt - 100 O2
Это используется при применении ПМ в качестве катализаторов.
Физические свойства металлов приведены в таблице 2
таблица 2
|
Параметр |
Ru |
Rh |
Pd |
Ag |
Os |
Yr |
Pt |
Au |
|
Плотность, г/см3 |
12,45 |
12,41 |
12,02 |
10,49 |
22,61 |
22,65 |
20,45 |
19,32 |
|
Температура плавления, 0С |
2334 |
1964 |
1554 |
960,5 |
3047 |
2434 |
1772 |
1064 |
|
Температура кипения,0С |
4030 |
3630 |
2880 |
2127 |
5030 |
4580 |
3830 |
2877 |
|
Твердость (НВ) по Бринеллю |
2000-3000 |
1000-1300 |
380-480 |
245-250 |
3000-4000 |
1700-2200 |
330-420 |
220-250 |
|
Цвет |
Матово- серый |
Серовато-белый |
Серебристо-белый |
белый |
Синевато-серый |
Серебряно-белый |
Серебристо-белый блестящий |
Желтый в компактном состоянии |
|
Способность улавливать газы |
Н2↑ |
Н2↑ |
Н2↑↑↑ |
|
|
Н2↑ |
Н2↑ О2↑↑↑ |
|
|
Пластичность |
|
|
↑↑ |
↑↑↑ |
|
|
↑↑ |
↑↑↑ |
Химические свойства
Благородные металлы (БМ) относятся к категории благородных. БM не взаимодействуют с O2, как на холоду, так и при повышенной температуре, не взаимодействуют с S2, поэтому в природе находятся не в виде сульфидов, оксидов, а в самородном виде.
С Cl взаимодействуют только при высоких температурах.
С Br взаимодействуют на холоду, с I – при нагревании.
В растворах щелочей, органических и неорганических кислот все металлы
(за исключением Ag и Pd) не растворяются. Но они растворяются во многих типах растворителей, например:
1. Царская водка (HNO3 + HCl);
2. CN-;
3. Жидко - фазное хлорирование [Cl2 + HCl (NaCl)];
4. Тиомочевина.
a) неправильный вариант:
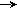 Au
+ Cl2
+ HCl
AuCl3
+…
Au
+ Cl2
+ HCl
AuCl3
+…
0Au/Au 3+ = +1.5 B;
0Cl2/Cl- = +1.36 B.
G0 < 0 ; G0= - nFE.
E= 0ок - 0восст > 0;
1.36 - 1.5 < 0.
б) правильный вариант:
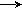 Au
+ 3/2Cl2
+ HCl
H[AuCl4]
Au
+ 3/2Cl2
+ HCl
H[AuCl4]
G0= - nFE; E0 > 0 .
E![]()
![]() 0
= 0Cl/Cl-
- 0
Au/AuCl4-
=
1.36 - ...
0
= 0Cl/Cl-
- 0
Au/AuCl4-
=
1.36 - ...
H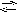 [AuCl4]
H+
+ [AuCl4]-;
[AuCl4]
H+
+ [AuCl4]-;
[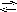
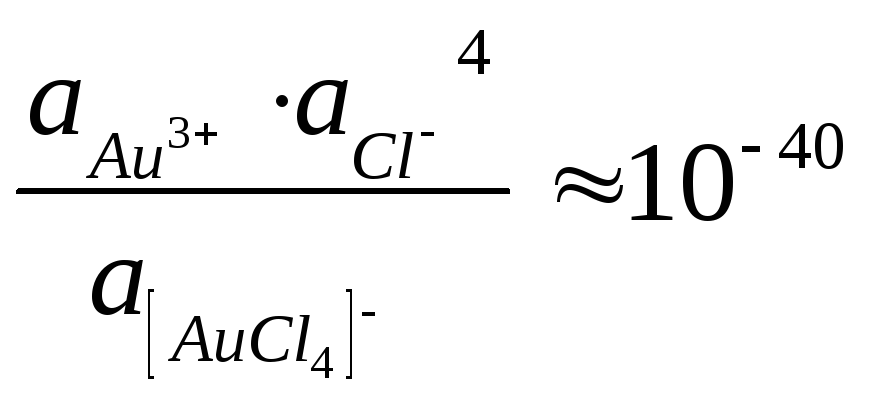 AuCl4]-
Au3+
+ 4Cl-.
AuCl4]-
Au3+
+ 4Cl-.
![]()
![]()
E0 > 0; G0 < 0.
Благородные металлы могут быть переведены в раствор различными системами. Необходимыми условиями являются:
1. Hаличие в системе окислителя с высоким электродным потенциалом;
2. Наличие иона – комплексообразователя, который способен образовывать
с металлами прочные комплексные соединения, что приводит к снижению потенциала металла в растворе его соли.
Например:
H
 NO3+HCl
= Cl2+NO*Cl+H2O.
NO3+HCl
= Cl2+NO*Cl+H2O.

 NO
+ Cl
NO
+ Cl
NO2 O2
A окислитель комплексообразователь

A
 u
+ NaCN +O2
Na[Au+(CN)2]
+ NaOH;
u
+ NaCN +O2
Na[Au+(CN)2]
+ NaOH;
A u
+Thio
+
Fe2(SO4)3
+
H2SO4
=
[Au+(Thio)2]2SO4
+
FeSO4
+…
u
+Thio
+
Fe2(SO4)3
+
H2SO4
=
[Au+(Thio)2]2SO4
+
FeSO4
+…
CNS- ; S2O3; Br2+Br -; I2 + I-.
