
asu012
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КОМИТЕТ АДМИНИСТРАЦИИ АЛТАЙСКОГО КРАЯ ПО ОБРАЗОВАНИЮ
Алтайский государственный университет Химический факультет
КРАЕВАЯ ОЛИМПИАДА ШКОЛЬНИКОВ ПО ХИМИИ
ЗАОЧНЫЙ ТУР
Задания и решения
Барнаул 2001 г.
Составители:
Базарнова Н.Г., д.х.н., профессор Богданкова Л.А., к.х.н., доцент Катраков И.Б., к.х.н. Котванова М.К., к.х.н., доцент Маркин В.И., к.х.н.
Сиянко П.И., к.х.н., доцент Стась И.Е., к.х.н., доцент
Приведены задачи, предложенные для учащихся 9–11 классов общеобразовательных школ Алтайского края на краевой олимпиаде по химии. Все задачи снабжены решениями с рекомендациями по оценке каждого этапа.
Подписано в печать 24.12.2001. Формат 60*80/16. Бумага офсетная. Печать офсетная. Усл. п.л. 1. Тираж 100 экз. Заказ
Отпечатано в типографии Некоммерческого партнерства «Азбука»: 656099, Барнаул, пр. Красноармейский, 98а, тел. 22-91-03, 22-77-25
3
9 КЛАСС
ЗАДАНИЯ
1. Х.А. Армстронг, автор статьи «Химия», помещенной в 9-м издании «Британской энциклопедии» (1878 г.), писал, что Д.И. Менделеев предложил для атомного веса урана значение 240 вместо старого значения 120, установленного Берцелиусом. При этом Армстронг отдавал предпочтение третьему значению, равному 180. Как теперь известно, прав был Менделеев. Истинная формула урановой смолки, одного из важнейших минералов урана, U3O8. Какую формулу могли бы написать для этого минерала
Берцелиус и Армстронг.
(3 балла)
2.Переместительный закон сложения гласит: «Если слагаемые по-
менять местами, значение суммы не изменяется». Это правило является верным в математике. Для химии его можно перефрази-
ровать следующим образом: «От изменения порядка введения реагентов результат химической реакции не изменяется». На-
сколько применимо подобное утверждение к химическим реакциям? Приведите примеры реакций как подтверждающие, так и опровергающие это утверждение.
(4 балла)
3.На полное взаимодействие 16,0 г железа и, возможно, продукта
его окисления пошло 174,3 мл соляной кислоты с массовой долей HCl 10,0% (плотность 1,047 г/см3), при этом объем выделившегося водорода составил 2,80 л. Определите состав исходного продукта.
(6 баллов)
4.Колбу, наполненную воздухом, взвесили вместе с пробкой. Ее масса составила 152,34 г. Масса той же колбы, наполненной углекислым газом, составляет 153,73 г, а если колбу наполнить газом Х, имеющим резкий запах, масса ее составит 151,23 г. Назовите вещество Х.
(6 баллов)
4
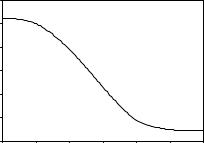
5.Навеску KClO3 массой 61,25 г подвергли разложению и по полученным экспериментальным данным (изменение массы m образца от времени τ ) построили графическую зависимость (см. рис.). Напишите уравнения реакций, соответствующих приведенным ниже условиям, и определите, какое из них отвечает представленной графической зависимости:
1) при температуре примерно 400° С;
2) в присутствии MnO2, при температуре примерно 200° С. Свой ответ обоснуйте. Вычислите значение m в точке Х.
m, г |
|
Х |
|
. |
|
τ, |
мин |
Изменение массы KClO3 при разложении |
|
(6 баллов)

|
|
|
|
|
|
5 |
|
|
|
|
|
РЕШЕНИЕ ЗАДАНИЙ |
|
|
|
|
|
|
Всего: 25 баллов |
|
Задание 1 (3 балла) |
|
|||||
1. Истинная формула урановой смолки (по Менделееву) – |
1 балл |
|||||
U3O8. |
|
|
|
|
|
|
На 240 3 = 720 г урана приходится 8 16 = 128 г ки- |
|
|||||
слорода. |
|
|
|
|
|
|
2. Если А(U) = 120 г/моль, то для формулы UхOу: |
1 балл |
|||||
х : у = |
720 |
: |
128 |
= 6 : 8 = 3 : 4 . |
|
|
|
|
|
||||
120 |
16 |
|
|
|||
Соответственно, формула урановой смолки по Берце- |
|
|||||
лиусу – U3O4. |
|
|
|
|
|
|
3. Если А(U) = 180 г/моль, то для формулы UхOу: |
1 балл |
|||||
х : у = |
720 |
|
: |
128 |
= 4 : 8 = 1 : 2 . |
|
|
|
|
|
|||
180 |
16 |
|
|
|||
Соответственно, формула урановой смолки по Арм-
сронгу – UO2.
Ответ: формула урановой смолки по Берцелиусу могла бы писаться – U3O4, по Армстронгу – UO2
Задание 2 (4 балла)
Например. При сливании растворов сильной одноос- 2 балла новной кислоты и щелочи протекает реакция нейтрализации:
NaОH + HСl = NaCl + H2O.
Например. При опускании раскаленного уголька в со- 2 балла суд с кислородом протекает реакция с образованием оксида углерода (IV):
О2 + С = СО2.
а при пропускании кислорода над раскаленным углем (русская печь) образуется и другой продукт – оксид углерода (II):
2С + О2 = 2СО.

6
Задание 3 (6 баллов)
1. Продукты окисления железа при взаимодействии с 1 балл кислотой не образуют водород. Поэтому весь водород, выделившийся при взаимодействии, образуется в реакции с железом:
|
|
|
|
|
|
|
|
|
2,80 л |
|
|
Fe |
+ |
|
2HCl |
= FeCl2 |
+ H2. |
(1) |
|
||||
1 моль |
2 моль |
|
1 моль |
|
|||||||
2. Масса кислоты, взаимодействующая с железом, равна: |
0,5 |
||||||||||
m(НСl) = |
V ρ |
ω |
= 174,3 |
см3 1,047 |
г/см3 0,100 = |
баллов |
|||||
= 18,25 г. |
|
|
|
|
|
|
|
|
|
|
|
3. í(Н2 ) = |
|
V |
|
|
= |
|
2,80 л |
= |
0,125 моль . |
1,5 |
|
|
|
|
|
баллов |
|||||||
|
Vm |
22,4 л/моль |
|||||||||
|
|
|
|
|
|
|
|||||
По уравнению реакции (1) ν (Н2) = ν (Fe) = 0,125 моль, и масса железа составляет:
m(Fe) = ν М = 0,125 моль 56 г/моль = 7,0 г.
Значит, исходная масса содержит оксиды железа и их масса равна:
m(FeхОу) = 16,0 – 7,0 = 9,0 г.
4. Согласно уравнению реакции (1) ν (Fe):ν (НСl) = 1:2 = |
0,5 |
|||||||
= 0,125 моль : 0,25 моль, тогда масса израсходованной кислоты |
баллов |
|||||||
составит: m(НСl) = 0,25 моль 36,5 г/моль = 9,125 г, т.е. по- |
|
|||||||
ловину из прибавленной. |
|
|
|
|
||||
5. Оксидами железа могут быть FeO, Fe2O3 или смешан- |
1,5 |
|||||||
ный оксид Fe3O4. В общем случае – FeхОу. |
|
баллов |
||||||
|
|
FeхОу + 2уHCl = хFeCl2у/х + уH2О. |
(2) |
|
||||
6. На 9,0 г оксида железа пошла оставшаяся масса соля- |
1 балл |
|||||||
ной кислоты – 9,125 г. Составляем уравнение и решаем: |
|
|
||||||
9,0 |
= |
|
9,125 |
; |
х = у. |
|
|
|
|
56х + 16 у |
|
у 36,5 |
|
|
|||
|
2 |
|
|
|
|
|||
Значит, в исходной смеси содержался оксид железа FeO.
Ответ: состав исходных продуктов – 7,0 г Fe и 9,0 г FeO

7
Задание 4 (6 баллов) |
|
|
2 |
||||||
1 способ. 1. По закону Авогадро: |
|||||||||
|
m(СО2 ) |
= |
|
М (СО2 ) |
, |
|
|
|
балла |
|
mвозд |
|
М возд |
|
|
|
|
||
или |
m(СО2 ) − mвозд |
= |
М (СО2 ) − Мвозд |
. |
|||||
|
|
|
|
mвозд |
|
|
Мвозд |
||
Отсюда 153,72 − 152,34 = |
44 − 29 |
и масса воздуха в |
|||||||
|
|
|
|
mвозд |
29 |
|
|
||
колбе равна: mвозд = 2,69 г.
2. Масса пустой колбы mколбы = 152,34 – 2,69 = 149,65 г. 1 балл
Масса неизвестного газа Х: m(Х) = 151,23 – 149,65 = = 1,58 г.
3. По закону Авогадро:
|
mвозд |
Мвозд , |
|
|
|
|
||
|
|
= |
|
|
|
|
|
|
|
m(Х) |
М (Х) |
|
|
|
|
|
|
отсюда |
|
|
m(Х) |
|
1,58 г |
|
||
|
М (Х) = |
М возд |
= 29 г/моль |
= 17 г/моль |
||||
|
|
2,69 г |
||||||
|
|
|
|
|
mвозд |
|
||
Значит, газ с резким неприятным запахом – это амми-
ак. M(NH3) = 17 г/моль.
2 способ (более рациональный). Изменение массы колбы при замене воздуха другим газом пропорционально разности их молярных масс:
|
М (СО2 ) − |
Мвозд |
m(СО2 ) − mвозд . |
||
|
|
= |
|
|
|
|
Мвозд − М (Х) |
mвозд − m(Х) |
|
||
Подставляем значения: |
|||||
|
44 − 29 |
153,73 − 152,34 . |
|||
|
29 − М (Х) |
= 152,34 − 151,23 |
|||
Отсюда М(Х) = 17 г/моль. Значит, газ с резким неприятным запахом – это аммиак NH3.
3
балла
6
баллов
Ответ: вещество Х – аммиак

8
Задание 5 (6 баллов) |
|
2 |
|
1. При первом условии: |
|
||
|
o |
|
балла |
4KClO3 |
400 C |
3KClO4 + KCl. |
(1) |
|
|||
Согласно закону сохранения массы веществ, изменения массы для данного уравнения нет, так как летучих продуктов не образуется. График изменения массы m от времени τ не изменится (был бы прямолинейным).
2. При втором условии: |
|
|
|
|
2 |
|
2KClO3 |
MnO2 |
2KCl + 3O2 |
|
. |
(2) |
балла |
|
||||||
o |
|
|
||||
|
200 C |
|
|
|
|
|
Уравнение (2) условию графика удовлетворяет. |
|
|
||||
3. ν (KClO ) = |
m |
= |
|
61,25 г |
= 0,500 моль |
2 |
|
|
|
|
|
балла |
|||
3 |
M |
|
122,5 г/моль |
|
|||
|
|
|
|
||||
По уравнению реакции ν (KClO3) = ν (KCl) = 0,500
моль. М(KCl) = 74,5 г/моль.
Оставшаяся масса образца m после реакции составляет: m = 0,500 моль 74,5 г/моль = 37,25 г, что соответствует значению точки Х.
Ответ: значение массы m в точке Х равно 37,25 г
9
10 КЛАСС
ЗАДАНИЯ
1. По объему производства полимеры в несколько раз превосходят цветные металлы. Однако прогресс в создании полимеров сдерживается их высокой возгораемостью. Так, теплотворная способность полиолефинов, полиметилметакрилата и др. составляет 27000–46000 кДж/кг, тогда как для древесины она равна 19000 кДж/кг. Некоторым решением вопроса явилось использование антипиренов, которые вводятся в полимеры и другие материалы для снижения их горючести. Хлорпарафины, используемые в качестве антипиренов, получаются хлорированием смеси алканов состава С20–С25. Согласно требованиям технических условий (ТУ), хлорпарафин (ХП-1100) должен содержать хлор в количестве не менее 70%. Рассчитайте, сколько атомов хлора в среднем будет входить в состав молекулы хлорпарафина С20 при 70%-ном содержании в ней хлора.
(3 балла)
2.Кристаллы металлической меди имеют кубическую элементарную ячейку, в которой находятся 4 атома меди. С помощью рентгеновских методов исследования установлено, что длина ребра этой
элементарной ячейки составляет 3,610 Å (1 Å = 1 10–10 м). Плотность меди равна 8,920 г/см3, ее относительная атомная масса – 63,54. На основании этих данных рассчитайте число Авогадро.
(4 балла)
3.При пропускании смеси N2 и NO2, средняя молярная масса которой равна 40 г/моль, через раствор NaOH образовалось 77 г смеси солей, в которой число моль каждой соли одинаково. Рассчитайте число моль каждого газа в исходной смеси.
(4 балла)
4.В химической лаборатории случайно разбили ртутный термометр. Мельчайшие капельки ртути разлетелись в разные стороны. За счет большой общей поверхности ртути интенсивность ее испарения велика. В помещении лаборатории может создаться концентрация паров ртути больше, чем предельно допустимая
10
(ПДК паров ртути составляет 0,01 мг/м3). Предложите сотрудникам лаборатории один-два достаточно простых способа демеркуризации (так называют процесс очистки за счет связывания ртути). Опишите эти способы. Составьте уравнения соответствующих реакций. Какое влияние пары ртути оказывают на организм человека?
(5 баллов)
5.Сера и алюминий, содержащиеся в смеси, прореагировали друг с другом. Продукт реакции обработали горячей водой. Часть выделившегося газа пропустили через хлорную воду, отделили выпавший осадок, а к раствору добавили избыток нитрата серебра. Образовалось 8,61 г белого творожистого осадка. Оставшуюся часть газа пропустили через 145 мл 10%-ного раствора сульфата меди (II) плотностью 1,10 г/мл, в результате чего массовая доля сульфата меди (II) в растворе понизилась до 6,09%. Напишите уравнения всех реакций. Рассчитайте массу серы, вступившей в реакцию.
(9 баллов)
