
Российский химико-технологический университет имени Д. И. Менделеева.
кафедра общей химической технологии.
Курсовая работа по ХПР.
Тема: “Исследование процесса и расчет реактора для каталитического дегидрирования этилбензола в стирол”.
Выполнил: студент Тютюнов А. А.
Группа О-42
Вариант №12
Проверил: преподаватель Игнатенков В. И.
Москва 2000-2001 г.
1. Термодинамика реакции.
Уравнение реакции:
Ошибка! Ошибка связи.
Константа равновесия реакции дегидрирования этилбензола следующим образом зависит от температуры:
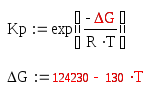
Равновесная степень превращения этилбензола в стирол (Xp) может быть рассчитана из уравнения:
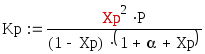 ,
,
преобразуя получим:
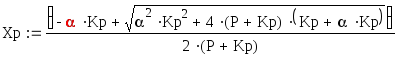
Температура процесса: 823-923 К, мольное соотношение : 0-20, давление P=1 атм.
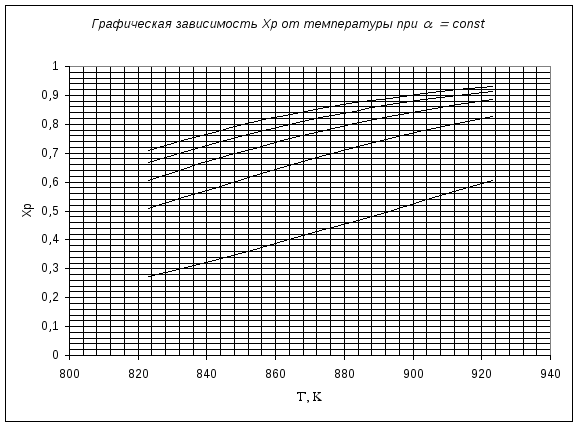
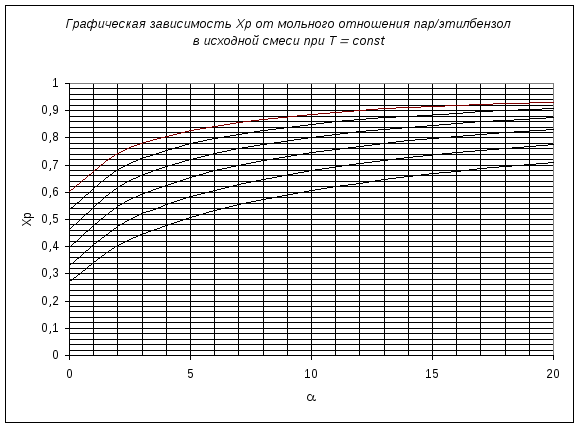
Полученные результаты Xp в зависимости от температуры и соотношения представлены в таблице и дана графическая зависимость Xp=f(T) при =const и Xp=f() при Т=const.
|
T, K |
Xp( |
Xp( |
Xp( |
Xp( |
Xp( |
|
823 |
0,273 |
0,508 |
0,606 |
0,668 |
0,711 |
|
833 |
0,302 |
0,546 |
0,644 |
0,704 |
0,745 |
|
843 |
0,332 |
0,583 |
0,68 |
0,738 |
0,776 |
|
853 |
0,364 |
0,62 |
0,714 |
0,769 |
0,805 |
|
863 |
0,397 |
0,655 |
0,746 |
0,797 |
0,831 |
|
873 |
0,431 |
0,689 |
0,776 |
0,823 |
0,854 |
|
883 |
0,465 |
0,721 |
0,803 |
0,846 |
0,874 |
|
893 |
0,5 |
0,75 |
0,827 |
0,867 |
0,891 |
|
903 |
0,536 |
0,778 |
0,849 |
0,885 |
0,907 |
|
913 |
0,57 |
0,803 |
0,868 |
0,9 |
0,92 |
|
923 |
0,604 |
0,826 |
0,885 |
0,914 |
0,931 |
![]()
|
|
Xp(T |
Xp(T |
Xp(T |
Xp(T |
Xp(T |
Xp(T6 |
|
0 |
0,273 |
0,332 |
0,397 |
0,465 |
0,536 |
0,604 |
|
2 |
0,404 |
0,475 |
0,548 |
0,618 |
0,684 |
0,743 |
|
4 |
0,479 |
0,554 |
0,626 |
0,694 |
0,754 |
0,806 |
|
6 |
0,532 |
0,608 |
0,679 |
0,742 |
0,797 |
0,843 |
|
8 |
0,573 |
0,648 |
0,717 |
0,777 |
0,827 |
0,867 |
|
10 |
0,606 |
0,68 |
0,746 |
0,803 |
0,849 |
0,885 |
|
12 |
0,634 |
0,706 |
0,77 |
0,823 |
0,866 |
0,899 |
|
14 |
0,657 |
0,728 |
0,789 |
0,839 |
0,879 |
0,91 |
|
16 |
0,677 |
0,746 |
0,805 |
0,853 |
0,89 |
0,918 |
|
18 |
0,695 |
0,762 |
0,819 |
0,864 |
0,899 |
0,925 |
|
20 |
0,711 |
0,776 |
0,831 |
0,874 |
0,907 |
0,931 |
![]()
2. Кинетика реакции.
Скорость реакции образования стирола определяется уравнением:
![]()
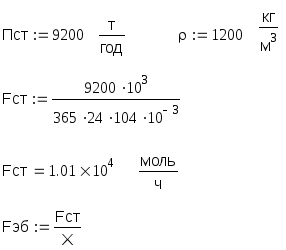
Для расчета даны следующие данные:
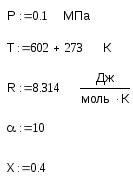
Расчет скорости образования стирола:

Скорость реакции образования побочных продуктов находится по уравнению:
![]()
Значение К1 для неселективного катализатора находим из следующих данных:

Расчет К1 для неселективного катализатора:
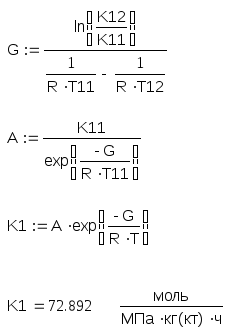
Расчет скорости образования побочных продуктов:
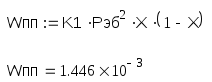
3. Селективность процесса.
Дифференциальная селективность находится из уравнения:
![]()
И она равна: S1=0,99951
Интегральная селективность находится по уравнению:
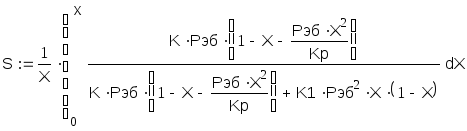
И она равна: S=0.9997585
4. Расчет реактора (модель идеального вытеснения).
Объем катализатора определяют по формуле:

Расчет объема катализатора:
![]()
5. Конструктивное оформление процесса.
Реакционный узел дегидрирования этилбензола можно выполнять разным образом. Один из вариантов – трубчатый реактор, обогреваемый топочными газами.
Его достоинства – близкий к изотермическому профиль температур, что позволяет получать повышенную степень конверсии при хорошей селективности.
Из недостатков следует указать высокие капитальные затраты и металлоемкость, а так же катализатор должен иметь высокую пропускную способность.
6. Материальный баланс.
Селективность процесса близка к единице поэтому можно пренебречь побочными продуктами.
mэб + mH2Oпар = mэб + mH2Oпар + mH2 + mст
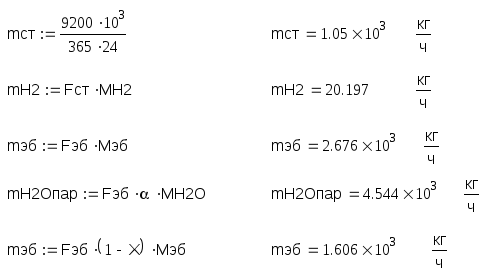
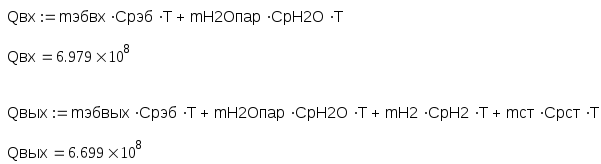
7. Тепловой баланс.
Qвх = Qвых
Теплоемкости веществ на входе и выходе при температуре реакции:

8. Выводы.
Реакция дегидрирования этилбензола в стирол обратимая и эндотермическая. Протекает с увеличением объема. Следовательно, с увеличением температуры и снижением парциального давления веществ в газовой фазе за счет разбавления реакционной смеси инертным компонентом равновесие будет смещаться в сторону продуктов реакции. Это иллюстрируется графиками Xp=f(T) и Xp=f(
Разбавление паром увеличивает равновесную степень конверсии, способствуя росту селективности.
Оптимальная температура для дегидрирования для этилбензола составляет 580 – 600 оС.
