
Курсовая работа / Производство серной кислоты контактным методом - Вариант 4424 - Сажин - Ларюшкин - 2006 / Курсовая по ОХТ Ларюшкин
.docРасчетная часть
1) Рассчитаем состав смеси перед реактором.
Пусть полный объем смеси равен 100 литрам. Перед подачей в реактор газ подваргается сушке и очистке от SO3. Определим объем добавляемого воздуха:
![]() Vair = 76.25 литра
Vair = 76.25 литра
В воздухе содержится 21%об. О2 и 79%об. N2. Определим объем кислорода и азота в 76.25 литрах воздуха:
V(O2)=![]() литров
литров
V(N2)=![]() литров
литров
Таким образом реакционная смесь перед реактором имеет следующий состав:
(SO2)=0.076=7.6%
(SO3)=0%
(H2O)=0%
(O2)=![]() =10.3%
=10.3%
(N2)=![]() =82.1%
=82.1%
Проверка:
![]() %
%
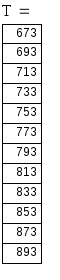
2) Рассчитаем значение равновесной степени превращения диоксида серы (Хравн) в зависимости от температуры. Диапазон температур 673 - 893 К.
Кр определим по уравнению:
[1] стр. 388
![]()
Xp определим по уравнению:
[1] стр 388

где а - объемная доля SO2, b - объемная доля
О2, Р - давление
Решим последнее уравнение численным
методом
![]()
![]()
![]()
![]()
![]()
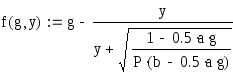
![]()
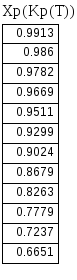
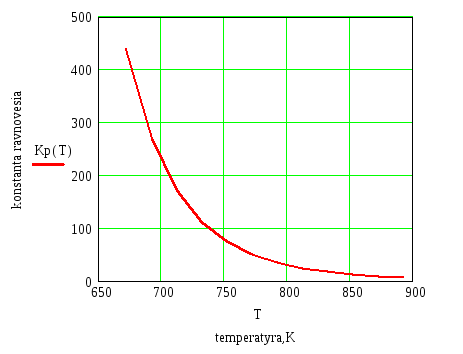
Решив уравнения, получим следующие результаты и сведем их в таблицу и по полученным данным построим график зависимости Кр=f(Т).

 3)
Определим зависимость скорости реакции
от температуры для 5 значений степени
превращения и построим оптимальную
температурную зависимость.
3)
Определим зависимость скорости реакции
от температуры для 5 значений степени
превращения и построим оптимальную
температурную зависимость.
Выберем следующие значения степени превращения: x=0.8, x=0.85, x=0.9, x=0.95, x=0.87
Воспользуемся следующим уравнением:
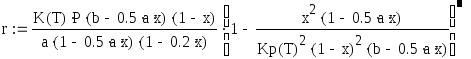
где а, b - начальные концентрации SO2 и О2 в мольных долях; Р - общее давление, атм; Kp(T) - константа равновесия; K - константа скорости реакции [1/(атм сек)], определяемая из уравнений:
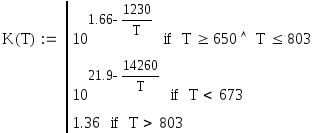
Решим это уравнение относительно Т при данных степенях превращения и сведем полученные данные в таблицу.
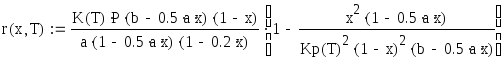
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
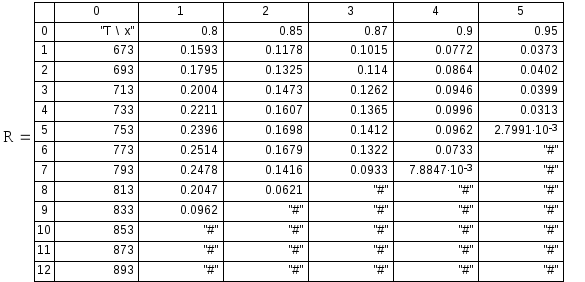
На основании данных таблицы построим график зависимости r(T) для выбранных значений степени превращения.
График зависимости скорости реакции от температуры при выбранных значениях степени превращения.
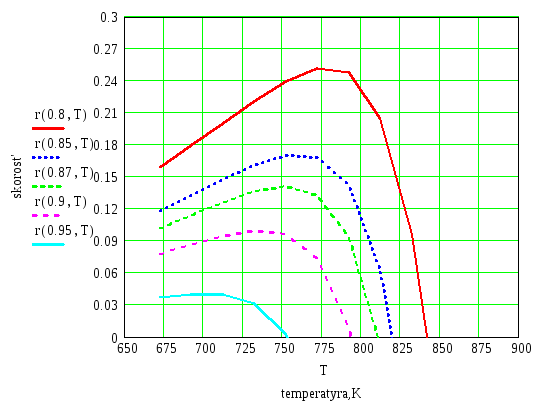
Определим температуры ( Торт), соотведствующие максимумам скорости ( r max) для каждого выбранного значения х.
Оптимальные температуры можно было бы определить из построенного графика, но для получения более точных результатов найдем их численными методами из соотведствующего уравнения зависимости.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Сведем полученные данные в таблицу.
![]()
![]()
![]()
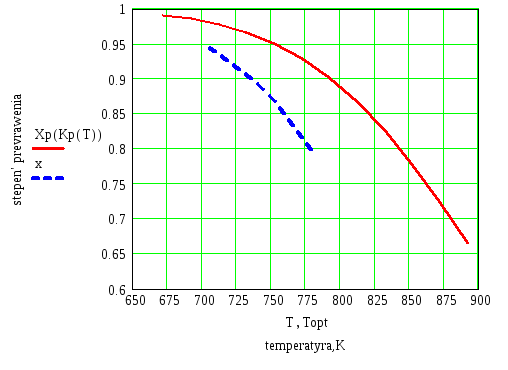
На диаграмму х - Т вместе с равновесной линией Xp(Kp(T)) нанесем найденные значения Topt и построим линию оптимальных температур.
График зависимости степени превращения от температуры
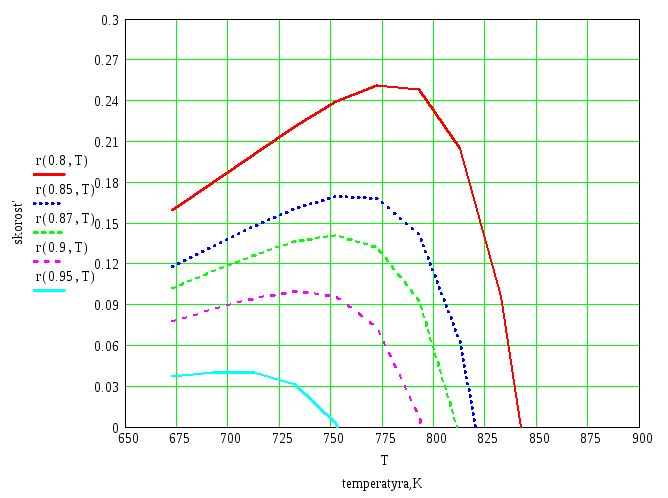
4) Ограничим область протекания процесса окисления в реакторе величиной скорости реакции r=0.8r(max) и найдем оптимальные температуры для этой скорости. Сведем полученные данные в таблицу.
|
X |
Wmax |
0.8Wmax |
Topt |
|
|
0.5 |
0.840 |
0.667 |
890 |
754 |
|
0.6 |
0.646 |
0.512 |
863 |
750 |
|
0.7 |
0.045 |
0.360 |
838 |
742 |
|
0.8 |
0.253 |
0.202 |
814 |
714 |
|
0.85 |
0.171 |
0.137 |
794 |
699 |
|
0.87 |
0.141 |
0.113 |
786 |
691 |
|
0.9 |
0.100 |
0.080 |
769 |
678 |
|
0.95 |
0.041 |
0.033 |
731 |
644 |
|
0.98 |
0.094 |
0.075 |
669 |
|
5) Определим температурный режим окисления в каталитическом реакторе.
При отсутствии теплоотвода температура возрастает с ростом степени превращения Х. Если пренебречь изменением теплоемкости газа с изменением температуры, то последняя будет связана со степенью превращения линейной зависимостью
T=Tn+λ(X-Xn)
где Tn- начальная температура при X=Xn;
λ- максимальное увеличение температуры газа (в град), отвечающее изменению степени превращения Х от 0 до 1 в адиабатических условиях.
При С(SO2)=7.6% λ=215.6 град. [2] стр. 521
(λ также можно рассчитать по формуле λ=q*a/ρ*c ,где q- тепловой эффект реакции кДж/м3; a- начальная концентрация SO2 в газе; с- теплоемкость газовой смеси, кДж/(кг*К); ρ- плотность газовой смеси, кг/м3.)
Чтобы адиабатический процесс в слое мог интенсивно развиваться, начальная температура должна быть не нижн 713 К. Ее называют "температурой закипания". Она является нижней предельной температурой. [1] стр.390. Температуру холодного газа примем равной 493 К [2] стр. 543
После ввода холодного газа во втором слое катализатора объемная доля SO2 в смеси изменится, и соответственно наклон адиабаты будет другим.
Рассчитаем объемную долю SO2 после ввода холодного газа:
Определим объем газа поступающего в контактный аппарат указанной производительностью:
![]() м3/ч
м3/ч
Температура на выходе из первого слоя катализатора равна 854 К, на входе во второй слой равна 754 К, а температура вводимого холодного газа равна 493 К. На основании этого из материального и теплового балансов определим объем газовых потоков, поступающих в аппарат на первый слой (V1) и после первого слоя катализатора (V2):
V1=166232-V2
854*V1*0.34=166232*754*0.34-493*0.34*V2
854*(166232-V2)+493*V2=166232*754
Получаем, что: V1=120184 м3/ч; V2=46048 м3/ч. Содержание SO2 в газе объемом V1 после первого слоя составляет 0.0403 %об.(т.к степень превращения после первого слоя составила 47%),а в газе объемом V2 – 0.076%об. .
Таким образом, содержание SO2 в газе объемом 166232 м3/ч составляет 0.0502%.
При C(SO2)=0.0502%, λ=145.56 град. [2] стр. 521
На диаграмме Х-Т изобразим температурный режим окисления в каталитическом реакторе (см. приложение).
6) Определим по графику значения степеней превращения и температуры на входе и на выходе каждого слоя катализатора.
|
слой |
Хн |
Хк |
Тн,К |
Тк,К |
Тау,с |
|
1 |
0 |
0.645 |
713 |
854 |
0.377 |
|
2 |
0.47 |
0.825 |
754 |
805 |
0.314 |
|
3 |
0.825 |
0.95 |
708 |
723 |
0.451 |
|
4 |
0.95 |
0.98 |
642 |
646 |
0.637 |
|
|
1.780 |
||||
Расчет времени пребывания в каждом слое катализатора и суммарное время пребывания произвели при помощи лабораторной программы на кафедре ОХТ.
7) Рассчитаем объем катализатора в каждом слое.
Используем формулу: Vкат.=V0*∫(dx/t), где V0- объемный расход м3/с.
Рассчитаем объем расход газа. При этом используем формулу из методички 3906:
 ,
где P – производительность
установки в тоннах 100% H2SO4
в сутки. P=1300 (по условию).
,
где P – производительность
установки в тоннах 100% H2SO4
в сутки. P=1300 (по условию).
![]() м3/с.
м3/с.
Теперь определим объем катализатора в каждом слое и занесем полученные данные в таблицу.
|
слой |
Тау,с |
Vк,м3 |
|
1 |
0.377 |
17.41 |
|
2 |
0.314 |
14.50 |
|
3 |
0.451 |
20.82 |
|
4 |
0.637 |
29.41 |
|
Сумма |
1.780 |
82.14 |
Суммарный объем катализатора равен 83 м3.
Список литературы:
-
Бесков В.С. Общая химическая технология: Учебник для вузов. – М.: ИКЦ «Академкнига», 2005. – 452с.
-
Справочник сернокислотчика. Под ред. Проф. К.М. Малина. М.: «Химия», 1971 г. – 744 с.
-
Амелин А.Г. Технология серной кислоты. – М.: Химия. 1983, - 360с.
-
Методичка №3906
Министерство образования и науки РФ
Российский химико-технологический университет им. Д.И. Менделеева
Кафедра общей химической технологии
Дисциплина «Общая химическая технология»
Курсовая работа:
«Производство серной кислоты контактным методом. Термодинамические и кинетические расчеты. Определение контактной зоны промышленного реактора»
Выполнил студент группы Ф-40
Ларюшкин Андрей
Проверил: Сажин В.Б.
Вариант 4424
Москва 2006 г.
