
- •Российский Химико-Технологический Университет имени д.И. Менделеева
- •Курсовая работа
- •1. Состав реакционной смеси перед реактором.
- •8 Используем программу лабораторного практикума кафедры охт для определения время пребывания в каждом слое катализатора и суммарное время пребывания.
- •9 Расчет объема катализатора в каждом слое и суммарный объем.
- •1 Кмоль so2 - 1 кмоль н2so4 ;
- •Тогда для каждого слоя катализатора:
- •10 Сравнение протекания реакции в реакторах с различными режимами. Выводы.
- •Список используемой литературы
Российский Химико-Технологический Университет имени д.И. Менделеева
Кафедра Общей Химической Технологии
Курсовая работа
«Расчет контактного аппарата окисления SO2 в SO3»
Вариант
Выполнила:
Проверила: Давидханова М.Г.
Москва - 2000
Исходные данные
-
Состав обжигового газа после обжига серосодержащего сырья в атмосфере воздуха:
|
Состав |
Объемные % |
|
SO2 |
14.5 |
|
SO3 |
0.13 |
|
Н2О |
4.9 |
|
О2 |
2.4 |
|
N2 |
78.07 |
-
Перед подачей в реактор газ подвергается осушке и очистки от SO3, а также дополнительно разбавляется воздухом до содержания SO2 (объемные %):
Концентрация в объемн.% SO2 9,5
-
Окисление SO2 осуществляется в несколько стадий контактирования в каталитическом реакторе:
Каталитический реактор с вводом холодного сухого воздуха после 1 слоя катализатора и промежуточными теплообменниками между остальными слоями катализатора.
-
Заданная производительность установки (в тоннах 100%-ной серной кислоты в сутки):
П (H2SO4) 1400
1. Состав реакционной смеси перед реактором.
SO2 + 0.5 O2 = SO3
SO3
+ Н2О
= Н2SO![]()
1 кмоль SO2 - 1 кмоль Н2SO4
1. Расчет количества SO2, необходимого для производства 1400 т 100%-ой серной кислоты в сутки
22,4 м3 SO2 - 98 кг Н2SО4
Х м3 SO2 - 1.4*106 кг/сутки Н2SO4 (производительность)
![]()
2. Состав газовой смеси (SO2, N2, O2) после сушки и очистки от SO3
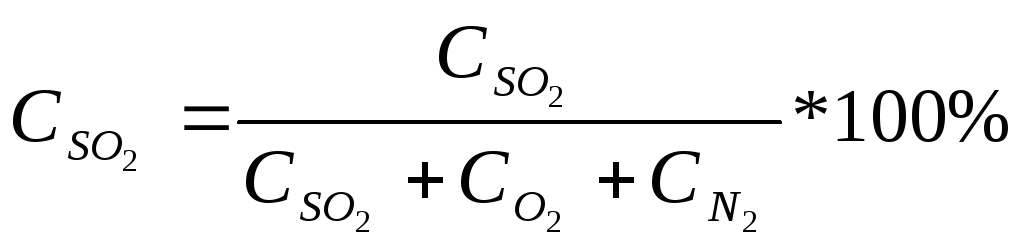 =
=![]() =15.27%
=15.27%
![]()
![]()
3. Объем кислорода в газовой смеси после осушки и очистки от SO3:
15.27% SO2 – 320000м3
2,53% O2 – Y м3
Y=53018.99м3
4. Объем азота в газовой смеси после осушки и очистки от SO3:
15.27% SO2 – 320000 м3
82.2% N2 – Z м3
Z=1722593,32м3
5. Объем газовой смеси перед подачей в реактор после разбавления сухим воздухом до содержания SO2 – 9.5% (об.)
Vобщ=VSO2+VO2+VN2=320000+53018,99+1722593,32=2095612,31 м3
![]()
Vдоб.=1272808,74м3
Из них: 21% O2, 79% N2
Vдоб.N2=0,79*1272808,74м3=1005518,91м3
Vдоб.О2=0,21*1272808,74м3=267289,84м3
Состав реакционной смеси перед реактором производительностью 1400 т/сут 100%-ой H2SO4
|
Компонент |
V, м3 |
% (об.) |
Мольная доля |
|
SO2 |
320000 |
9,5 |
0,095 |
|
O2 |
320308,83 |
9,5 |
0,095 |
|
N2 |
2728112,23 |
81 |
0,81 |
|
Итого |
3368421,06 |
100 |
1 |
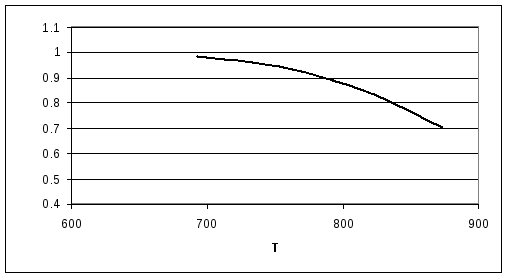
Расчет равновесной степени превращения диоксида серы.
Степень превращения SO2 достигается на катализаторе, зависит от его активности, состава газа, продолжительности контакта газа с катализатором, давления и др.
|
T, к |
Xравн |
Кр |
|
693 |
0.9838 |
270.66 |
|
713 |
0.9748 |
171.35 |
|
733 |
0.9620 |
111.22 |
|
753 |
0.9442 |
73.87 |
|
773 |
0.9206 |
50.11 |
|
793 |
0.8905 |
34.66 |
|
813 |
0.8533 |
24.42 |
|
833 |
0.8092 |
17.49 |
|
853 |
0.7589 |
12.73 |
|
873 |
0.7035 |
9.4 |
По полученным данным строим диаграмму X*(T)
Расчет скорости реакции в зависимости от температуры и степени превращения.
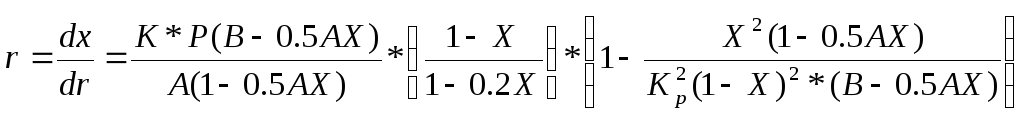
где А-начальная концентрация SO2 (A=0.085)
B-начальная концентрация O2 (B=0.1288)
P-общее давление (Р=1атм)
r-скорость
K-константа скорости
Kp-константа равновесия
Пользуюсь программой лабораторного практикума по ОХТ,
для пяти значении степени превращения – 0,6 ; 0,7 ; 0,8 ; 0,9 ; 0,95, интервал варьирования температуры 20 оК. Результаты свели в таблицу:
|
|
Скорость W(X,T) |
||||
|
T, oK |
X=0,6 |
X=0,7 |
X=0,8 |
X=0,9 |
X=0,95 |
|
693 |
0.104 |
0.074 |
0.047 |
0.022 |
0.010 |
|
713 |
0.246 |
0.176 |
0.110 |
0.050 |
0.019 |
|
733 |
0.321 |
0.229 |
0.143 |
0.061 |
0.015 |
|
753 |
0.413 |
0.293 |
0.179 |
0.065 |
-0.011 |
|
773 |
0.523 |
0.366 |
0.214 |
0.046 |
|
|
793 |
0.648 |
0.443 |
0.234 |
-0.034 |
|
|
813 |
0.703 |
0.457 |
0.040 |
|
|
|
833 |
0.664 |
0.385 |
-0.225 |
|
|
|
853 |
0.593 |
0.253 |
|
|
|
|
873 |
0.467 |
0.019 |
|
|
|
4. Построили зависимость W (T) для выбранных значений степени превращения и определили температуры Т (опт), соответствующие максимумам скорости (W мах) для каждого выбранного значения Х.
|
Х |
W мах |
Т опт (К) |
|
0,6 |
0.703 |
803 |
|
0,7 |
0.457 |
803 |
|
0,8 |
0.234 |
794 |
|
0,9 |
0.065 |
750 |
|
0,95 |
0.019 |
713 |
5 На диаграмму Х-Т вместе с равновесной линией Хравн(Т) нанесли найденные значения Топт и построили линию оптимальных температур ЛОТ.
6 Ограничиваем область протекания процесса окисления в реакторе величиной скорости реакции W = 0.8*W мах для каждого выбранного Х. Наносим их на диаграмму W – Т, определяем температуру, соответствующую W = 0.8*W мах.
Находим значения температур:
|
Wmax |
0.8 Wmax |
Т1 |
Т2 |
|
0.703 |
0.562 |
778 |
858 |
|
0.457 |
0.366 |
770 |
838 |
|
0.234 |
0.187 |
758 |
799 |
|
0.065 |
0.052 |
718 |
768 |
|
0.019 |
0.015 |
697 |
738 |
7. На диаграмме Х-Т изображаю температурный режим окисления в каталитическом реакторе. Для этого определим адиабатическое изменение темппературы, используя формулу:
![]() Тад
=
Тад
=
![]()
где:
Qр
– тепловой эффект реакции, Qр
= -![]() Н
Н
СSO2 – концентрация SO2 = 0,08
Cр – средняя теплоемкость реакционной смеси
![]() Н
= - 101420 + (9,26*Т) = -101420 + (9,26*713) = -94817,62 Дж/моль
Н
= - 101420 + (9,26*Т) = -101420 + (9,26*713) = -94817,62 Дж/моль
Ср
= СSO2
* СрSO![]() +СO
+СO![]() * CpO
* CpO![]() + СN
+ СN![]() * CpN
* CpN![]()
Cp берем из справочника при Т = 713 С в Дж/(моль*К) [2]
Ср = (0,095 * 46,32) + (0,095 * 31,39) + (0,81 * 30,04) = 31,71Дж/(моль*К)
![]() Тад
=
Тад
=![]() = 284,06 К
= 284,06 К
Изображаем на графике Х-Т температурный режим для определения количества слоев катализатора
по
уравнению Тк = Тн +
![]() Тад ( Хк-Хн) строим промежуточные точки:
Тад ( Хк-Хн) строим промежуточные точки:
|
Слои |
Тн |
Хн |
Тк |
Хк |
|
1 |
713 |
0 |
866 |
0.54 |
|
2 |
782 |
0.54 |
832 |
0.72 |
|
3 |
768 |
0.72 |
794 |
0.81 |
|
4 |
754 |
0.81 |
773 |
0.88 |
|
|
724 |
|
|
|
Получили 4 слоев катализатора
