
Лекция 13(адсорбция)
.docЛ13 АДСОРБЦИЯ
Накопление веществ в поверхностном слое и понижение поверхностной активности относится к ещё одному виду поверхностных явлений: адсорбция – накопление, концентрации одного вещества на поверхности раздела двух фаз из которых одна является обычно жидкостью или твёрдым веществом.
Вещества способные поглощать (адсорбировать) другие вещества на своей поверхности – адсорбенты, адсорбируемое вещество – адсорбтив – адсорбат.
Адсорбцию выражают в моль/см2, кмоль/м2.
Существует несколько типов адсорбционных систем со своими закономерностями.
А дсорбент
Адсорбат
дсорбент
Адсорбат
Ж Г подвижные поверхности раздела сред
 Ж Ж
Ж Ж
Тв Г неподвижные поверхности раздела сред
Тв Ж
Системы с подвижными поверхностями раздела.
Адсорбцию в данной системе определить непосредственно нельзя. Её рассчитывают по величине поверхностного натяжения, по уравнению Гиббса.
Г = dσ/dС ∙ СПАВ/RT ,
где СПАВ – молярная концентрация ПАВ,
Г определяется по σ, которая определяется приборами.
-
Если σ↓, т.е. dσ/dС < 0 → Г > 0 – положительная адсорбция (все вещества встали на границе раздела. Работают ПАВ
-
Если σ↑, т.е. dσ/dС > 0 → Г < 0 – отрицательная адсорбция (вещества находятся в объёме раствора). Работают ПИАВ.
-
Если σ - const, т.е. dσ/dС = 0 → Г = 0 – вещество распределено равномерно между поверхностью и объёмом.
М

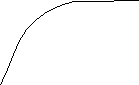
 ожно
построить график зависимости Г от
С(х) – изотерма адсорбции:
ожно
построить график зависимости Г от
С(х) – изотерма адсорбции:
Г
Гmax


I II III
С
Лэнгмюр объяснил ход изотермы: согласно принципу независимости поверхностного натяжения:
-
При адсорбции полярная граница втягивается в воду в то время, как неполярный радикал выталкивается в неполярную фазу.
-
П


 ри
малых концентрациях ПАВ углеводородные
цепи располагаются на поверхности
следующим образом:
ри
малых концентрациях ПАВ углеводородные
цепи располагаются на поверхности
следующим образом:




-
С














 ростом концентрации число молекул в
поверхностном слое увеличивается, и
они принимают такой вид:
ростом концентрации число молекул в
поверхностном слое увеличивается, и
они принимают такой вид:
4















 .
При увеличении концентрации ПАВ
выстраиваются в мономолекулярный слой
– «частокол Лэнгмюра».
.
При увеличении концентрации ПАВ
выстраиваются в мономолекулярный слой
– «частокол Лэнгмюра».


















I участок – соответствует ↓СПАВ, зависит Г от CПАВ прямолинейная.
II участок – параболическая зависимость.
III участок – СПАВ↑, Г – const, Гmax соответствует молекулярному слою.
К чему может привести не обезвреживание ПАВ? – Образуется мономолекулярная плёнка – растения и животные использующие атмосферный кислород для дыхания погибают (особенно растения и насекомые).
Адсорбция на неподвижных поверхностях раздела.
К этому типу относится адсорбция на твёрдой поверхности. Для определения этой адсорбции уравнение Гиббса не подходит, т.к. для твёрдых веществ нельзя измерить поверхностное натяжение, поэтому адсорбция на неподвижных поверхностях раздела определяют экспериментально.
Адсорбцию рассчитывают по формуле:
Г = n(х) / m(х),
где Г – адсорбция,
n(х) – количество молей адсорбированного вещества,
m(х) – масса вещества на поверхности которого идёт адсорбция.
В качестве адсорбента используют пористые вещества: активированный уголь, силикагель, крахмал, белая глина (Al2O3·SiO2·2H2O), Al(OH)3.
Механизм этой адсорбции также объяснил Лэнгмюр.
-
Адсорбция идёт не на всей поверхности адсорбента, а только на активных центрах. Активными центрами служат узлы кристаллической решётки, выступы, шероховатости.
-
Каждый активный центр адсорбирует только 1 молекулу.
-
Адсорбтив располагается на поверхности адсорбента мономолекулярным слоем.
-
На поверхности твердого вещества адсорбируются те газы, которые легко конденсируются на данной поверхности. Например: уголь хорошо адсорбирует аммиак, почти не адсорбирует угарный газ.
Впервые адсорбция Тв. – Г. была использована Зелинским в устройстве противогаза в I Мировую войну (хлор и фосген COCl2). Позже была разработана адсорбционная терапия основанная на способности угля поглощать газообразные и жидкие вещества. Активированный уголь назначают больным при отравлении пищевыми продуктами, газами, в после операционный период.
Адсорбция из растворов (молекулярная).
В процессе адсорбции из растворов участвуют три вещества: адсорбат, адсорбент и растворитель. Процесс в этом случае осложняется тем, что на адсорбенте может адсорбироваться не только адсорбат, но и растворитель, тем самым, снижая адсорбцию адсорбата.
Молекулярную адсорбцию изучал русский ученый П.А. Ребиндер. Он сформулировал правило выравнивания полярностей: на полярных адсорбентах лучше адсорбируется полярные адсорбаты, из малополярных растворителей, на неполярных адсорбентах лучше адсорбируется неполярные адсорбаты, из полярных растворителей. То есть подобное растворяется в подобном, но труднее из него адсорбируется. Все гидрофильные вещества (силикагель, глина, оксид магния, гидроксид алюминия) хорошо адсорбируют полярные вещества из неполярных жидкостей. Все гидрофобные вещества (уголь, графит, парафин, целлюлоза, крахмал) хорошо адсорбируют неполярные вещества из полярных жидкостей.
Механизм молекулярной адсорбции лежит в основе одного из самых современных методов лечения – гемосорбции – очистки крови от токсических веществ с помощью различных адсорбентов. В медицине это называют гемоперфузией и используют при почечной и печеночной недостаточности, сильными отравлениями барбитуратами, фосфорорганическими и хлорсодержащими (дихлорэтан, тетрахлорметан ир др.) соединениями. Все эти вещества неполярны, кровь – полярный растворитель, значит, адсорбцию надо проводить в колонке с неполярным адсорбентом (уголь). Если произошло отравление спиртами (полярные вещества), то этот метод становится не пригоден. Здесь необходимо использовать аппарат «искусственная почка» - трубка с биологической мембраной с одной стороны, которой пропускают кровь, а с другой – физиологический раствор. В результате согласно законам осмоса происходит выход вредных веществ из крови.
Ионная адсорбция.
Если на адсорбент действовать растворами электролитов, то будет происходить ионная адсорбция. Необходимым условием адсорбции ионов является наличие на поверхности адсорбента либо полярных молекул, либо ионов. Адсорбционная способность ионов на адсорбенте увеличивается с увеличением их заряда. При одинаковых зарядах адсорбционная способность увеличивается с увеличением их радиуса. В соответствии с этим правилом ионы располагаются в лиотропные ряды: Cs+ > Rb+ > K+ > Na+ > Li+; J- > Br- > Cl- >F-; K+ < Ca2+ < Al3+. Различают несколько видов ионной адсорбции:
-
Избирательная адсорбция. Правило Фаянса: на поверхности кристалла адсорбируются те ионы, которые входят в состав кристаллической решетки адсорбента. Например: адсорбент – йодид серебра, адсорбат – йодид калия, адсорбироваться будут ионы йода.
-
Ионно-обменная адсорбция. В данном случае раствор электролита и адсорбент обмениваются в эквивалентных количествах одноименно заряженными ионами.
Адсорбентами могут быть природные алюмосиликаты (цеолиты) или синтетические ионно-обменные смолы, которые представляют собой органические вещества, в состав которых входит Н+, тогда соединение называют катионит, ОН- - анионит, и Н+ и ОН- - амфолит. Эти вещества способны обменивать ионы водорода и гидроксид ионы на катионы и анионы, находящиеся в растворе.
АДН+ + Na+ = АДNa + + Н+ - катиониты очищают раствор от всех катионов кроме катионов тяжелых металлов.
АДОН- + NО3- = АДNО3- + ОН- - аниониты очищают раствор от всех анионов.
Амфолиты способны поглощать и катионы, и анионы. Это используется для устранения жесткости, которая обусловлена присутствием ионов кальция, магния, сульфат. В качестве амфолитов используют пермутиты (соли алюминия).
Ионно-обменные смолы можно регенерировать, пропуская через них ионы натрия. В медицине используют катиониты для консервирования крови. Кальций крови замещают на натрий катионита, процесс свертывания прекращается. Для снижения ацидоза крови используют замену ионов водорода крови на ионы натрия катионитов.
Явление адсорбции лежит в основе многих физико-химических методов исследования, в том числе и хроматографии.
