
Лекция 4(растворы, закон Сеченова)
.docЛ4 РАСТВОРЫ И ИХ СВОЙСТВА.
Раствор – это находящаяся в состоянии равновесия гомогенная система, состоящая из двух или более компонентов.
Раствор состоит из растворителя и растворенного вещества. Растворителем принято считать тот компонент системы, который при образовании раствора не изменяет своего агрегатного состояния или берется в большем количестве. Важнейшие биологические жидкости: кровь, лимфа, слюна, пот являются растворами солей, белков, липидов, углеводов и др. в воде. Биологические жидкости участвуют в транспорте питательных веществ, лекарственных препаратов, в выводе из организма метаболитов – продуктов жизнедеятельности: углекислый газ, мочевина. Тело человека массой 70кг содержит 40кг воды: 25кг приходится на жидкость, находящуюся внутри клеток, а 15кг составляет внеклеточная жидкость. Особенно богаты водой интенсивно функционирующие органы:
-
Кора головного мозга – 83% жидкости;
-
Почки – 82% ;
-
Легкие и сердце – по 79% ;
-
Спинной мозг – 69% ;
-
Костная ткань – 15% .
Эти данные свидетельствуют о том, что вода является важным компонентом высокоорганизованных биохимических процессов.
Вода обладает особенной структурой, так как при образовании молекул воды происходит гибридизация атомных орбиталей кислорода по типу sp3. Молекула воды имеет тетраэдрическую структуру за счет гибридизации:
Электронная формула: О 1s22s22p4
Г




 рафическая
формула: Н Н
(+)
рафическая
формула: Н Н
(+)
2 \ /
1 О (-)
В результате гибридизации в молекуле возникают два полюса: положительный и отрицательный, что обеспечивает высокую полярность молекулы воды, вода – хороший растворитель (соли, кислоты, щелочи). Молекулы воды находятся в ассоциированном состоянии, за счет возникающих водородных связей.
Н – О - - Н – О - -
Н Н Н Н Н Н
\ / \ /
Н – О - - Н – О О О О
/\
Н Н Н Н
Рис.: Строение ассоциата воды
Высокая температура кипения воды (если судить по структуре молекулы, температура кипения должна быть 780С) так же объясняется возникновением водородных связей. Вода обладает наибольшей диэлектрической проницаемостью (80). Диэлектрическая проницаемость показывает, во сколько раз ослабевает взаимодействие между ионами в воде по сравнению с вакуумом. Вода лучший растворитель, так как у нее высокая полярность и высокая диэлектрическая проницаемость. В связи с этим в воде достаточно глубоко идет процесс электролитической диссоциации.
Концентрация раствора. Способы ее выражения.
Концентрация раствора – это величина, показывающая отношение количества растворенного вещества к определенной массе или объему раствора или растворителя.
Виды концентраций:
-
Массовая доля – ω – отношение массы растворенного вещества к массе раствора. (Эта единица измерения часто используется в фармации.)
ω(х) = m(х) / mр-ра (доля единицы);
ω(х) = (m(х) / mр-ра) ∙ 100% (%).
-
Молярная концентрация – отношение количества растворенного вещества к объему раствора.
С(х) = n(х) / Vр-ра (моль/л).
Растворы с молярной концентрацией готовят в специальной посуде для приготовления растворов точной концентрации – мерных колбах.
-
Моляльная концентрация – отношение количества растворенного вещества к массе растворителя.
Сm(х) = n(х) / mр-ля (моль/кг).
-
Молярная концентрация эквивалента – отношение количества растворенного вещества эквивалента к объему раствора.
С(fэх) = n(fэх) / Vр-ра (моль/л = н).
n(fэх) = m(х) / М(fэх).
fэ = 1 / z.
где n(fэх) – количество эквивалента вещества.
m(х) – масса вещества.
М(fэх) – молярная масса эквивалента вещества.
fэ – фактор эквивалентности – безразмерная величина – число, обозначающее, какая доля реальной частицы вещества эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции.
z – основность кислоты, кислотность основания, число электронов участвующих в окислительно-восстановительной реакции. Например, для H2SO4 z = 2.
Эквивалент – реальная или условная частица вещества, которая может присоединять, высвобождать или быть другим образом эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции.
Задача: Определите молярную концентрацию эквивалента при растворении 4,9 г серной кислоты в 200 мл раствора.
Для решения используем формулы: С(fэх) = n(fэх) / Vр-ра и n(fэх) = m(х) / М(fэх).
n(1/2 H2SO4) = m(H2SO4) / М(1/2 H2SO4) = 4,9г / (1/2 ∙ 98г/моль) = 0,1 моль.
С(1/2 H2SO4) = n(1/2 H2SO4) / Vр-ра = 0,1 моль / 0,2 л = 0,5 моль/л = 0,5 н.
-
Молярная доля - ǽ (кси) - отношение количества данного компонента к сумме количеств всех компонентов раствора.
ǽ(х) = n(х) / (ni(хi) + nр-ля) (доля единицы, %);
ǽ(х) = (n(х) / (ni(хi) + nр-ля)) ∙ 100% (%).
-
Объемная доля – φ (фи) – отношение объема растворенного вещества к объему раствора.
φ(х) = V(х) / Vр-ра (доля единицы);
φ(х) = (V(х) / Vр-ра) ∙ 100% (%).
-
Титр раствора – Т – отношение массы растворенного вещества к объему раствора.
Т(х) = m(х) / Vр-ра (г/мл).
Механизм и термодинамика процесса растворения.
Растворение – это физико-химический процесс. Это было доказано Д.И.Менделеевым в гидратной теории.
Стадии растворения:
-
При растворении вещества происходит разрушение его структуры под действием молекул воды и распределение частиц растворяемого вещества между молекулами растворителя(воды) – это физический процесс. Процесс эндотермический.
М








 олекулы
воды подходят к кристаллу поваренной
соли. К ионам натрия отрицательным
концом, к ионам хлора – положительным,
и начинают оттягивать их к себе.
олекулы
воды подходят к кристаллу поваренной
соли. К ионам натрия отрицательным
концом, к ионам хлора – положительным,
и начинают оттягивать их к себе.






 диполь
воды
диполь
воды


 ион
натрия
ион
натрия
 ион
хлора
ион
хлора
-
Одновременно происходит взаимодействие молекул растворителя с частицами растворяемого вещества – это химический процесс, так как в результате образуются гидраты (если растворитель – вода) или сольваты (если используется другой растворитель). Соответственно, процессы растворения называются: гидратации или сольватации. Это экзотермические процессы.





 Na+
Cl-
Na+
Cl-


Рис.: Гидратированные ионы натрия и хлора (гидраты).
При гидратации происходит изменение цвета раствора. Гидратированные ионы не взаимодействуют между собой из-за наличия гидратной оболочки.
1стадия: ∆Нразрушения кристал. решетки > 0, эндотермический процесс, 2стадия: ∆Нгидротации < 0, экзотермический процесс. Поэтому теплота растворения может иметь различный знак, в зависимости от того какой процесс преобладает:
∆Нрастворения = ∆Нразрушения кристал. решетки + ∆Нгидратации
При растворении твердых веществ с ионной связью всегда будет преобладать ∆Нразрушения кристал. решетки, отсюда общий тепловой эффект – эндотермический, растворы будут охлаждаться. При растворении веществ с ковалентной связью и жидких всегда преобладает ∆Нсольватации, отсюда общий тепловой эффект – экзотермический, растворы будут нагреваться. При растворении газов ∆Нразрушения кристал. решетки = 0, поэтому общий тепловой эффект определяется только ∆Нсольватации.
Но не будем забывать, что при растворении происходит изменение энтропии. Для твердых и жидких веществ ∆S > 0, а для газов ∆S < 0.
∆G = ∆Н - Т∆S
∆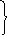 G
< 0, для твердых веществ: ∆Н > 0 или
∆Н < 0 и ∆S
> 0
G
< 0, для твердых веществ: ∆Н > 0 или
∆Н < 0 и ∆S
> 0
для жидкостей: ∆Н < 0 и ∆S > 0 ненасыщенные растворы.
для газов: ∆Н < 0 и ∆S < 0
∆G = 0 – насыщенные растворы.
∆G > 0 – пересыщенные растворы.
Пересыщенные растворы могут стоять без изменений так же долго, как и равновесные. Насыщенный раствор – раствор, содержащий при данной температуре максимальное количество вещества. Концентрация насыщенного раствора численно равна растворимости вещества.
Растворимость – показывает массу растворенного вещества (в граммах) в 100 г растворителя при определенной температуре (обычно 20-250С). Растворимость веществ зависит от природы растворенного вещества, изменяется от температуры и давления (газов). Для повышения растворимости необходимо учитывать тепловой эффект процесса растворения. Если процесс эндотермический, то вещества лучше растворяются с повышением температуры, если экзотермический, то – с понижением температуры.
Для увеличения растворимости газов используют изменение давления. Эта зависимость была установлена Генри. Закон Генри: количество газа, растворенного при определенной температуре, прямо пропорционально давлению газа.
С(х) = Кг · Р(х)
Кг – постоянная Генри (моль/(Па·л))
Закон Генри лежит в основе лечения кессонной болезни, в барокамере. Кессонная болезнь возникает у водолазов, летчиков, альпинистов – людей подвергающихся резким перепадам давления. При нырянии происходит резкое увеличение давления и кислород в большом количестве попадает в капилляры. При быстром поднятии на поверхность давление падает, кислород собирается в пузырьки и закупоривает капилляры. С течением времени у человека появляются характерные симптомы: тремор, шаткая походка в результате снижения поступления крови в мозг, смерть. Для лечения этого заболевания используют барокамеру, в которой люди дышат воздухом с повышенным содержанием кислорода под давлением. В результате улучшается кровообращение в капиллярах.
Еще один пример с шампанским. При открытии бутылки происходит резкое уменьшение давления, в результате чего растворенные газы собираются в пузырьки, и мы наблюдаем «пенный выстрел».
Закон Сеченова И.М.: растворимость газов в жидкости в присутствии электролита понижается, происходит как бы высаливание газа. (Высаливание – соль бросают в смесь воды и спирта, происходит разделение смеси, спирт всплывает.)
С(х) = С0 · е- КсСэл
где, С(х) – растворимость газа в присутствии электролита;
С0 – растворимость газа в чистом растворителе;
е – основание натурального логарифма;
Кс – постоянная Сеченова;
Сэл – концентрация электролита.
Существуют состояния, возникающие в результате большого потребления электролитов, витаминов, минеральной воды. В результате в организме накапливается много электролитов, которые способствуют снижению растворимости кислорода. У человека появляются вялость, слабость, повышенная утомляемость. Содержание белков, липидов и других молекул также влияет на растворимость газов в крови.
