
- •30.Основні фізичні величини
- •31.Ідеальний газ
- •32.Емпіричні закони
- •33.Рівняння стану ідеального газу
- •34.Основне рівняння мкт ідеального газу
- •35.Висновки з основного рівняння мкт ідеального газу
- •36.Закон розподілу молекул ідеального газу за швидкостями. Розподіл Максвелла
- •37.Барометричні формули
- •39.Кі-сть ступенів вільності молекул
- •47. Оборотні і необоротні процеси.
29.Сили інерції, що діють на тіло, яке рухається в системі, що обертається
Розглянемо диск, що обертається з постійною кутовою швидкістю, кулька рухається вздовж радіуса диска рівномірно прямолінійно з постійною швидкістю. Для того щоб кулька невідхилялась від свого прямолінійного положення, жорстко закріплюють стержень вздовж якого кулька рухатиметься без тертя прямолінійно. Збоку стержня на кульку діятиме сила F. Відносно системи повязаної з диском протилежно до сили F на кульку діє сила Коріоліса.
Fk=2*m[V*w]
Сила Коріоліса діє лише на рухоме тіло, що знаходиься на диску, який обертається. Наприклад…в Пн. Півкулі праві рейки залізниці за напрямком руху зношуються швидше ніж ліві.
30.Основні фізичні величини
Термодинамічна система – це система що складається з великої кількості молекул або атомів, тобто, будь-яка макроскопічна система.
Термодинамічні параметри – це фіз величини які характеризують стан термодинамічної системи.
Основні термодинамічні параметри:
1)Тиск – це фіз вел що = відношенню нормальної складової сили до площі поверхні на яку вона діє
p=Fn/S
2)Обєм
V=m/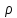
Питомий обєм-величина обернена до густини. Vn=1/p=dV/dm
Якщо речовина однорідна, то Vn=V/m
3)К-ть речовини – це к-ть структурних одиниць(молекул або атомів), що містяться в даній масі речовини. В 1 молі будь-якої речовини міститься однакова к-ть молекул або атомів- число Авогадро.
Молярна маса – це маса 1 моля речовини.
M=m0*Na
Молярний обєм – це обєм одного моля речовини
Vm=M/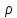
Закон Авогадро:Молі будь-яких речовин при однакових абсолютних температурах і тисках займають однакові обєми. V=m/M=N/Na=V/Vm
4)Температура – це фіз вел що характеризує міру нагрітості тіла. Дві шкали температури:а) МПШТ(міжнародна практична шкала температури)-вона характеризується двома реферними точками – це температура при якій хім чиста речовина переходить із одного агрегатного стану в інший, градується в градусах.
б)ТТШ(термодинамічна темп шкала)-визначається однією реферною точкою – це потрійна точка води – це температура при якій лід вода насичена пара при тиску 690 Па знаходиться в термодинамічній рівновазі.
Абсолютнийй нуль – цн темп при якій повністю відсутній тепловий рух молекул.
31.Ідеальний газ
В МКТ користуються моделлю ідеального газу – це газ для якого нехтують:
1)розмірами молекул(власним обємом)
2)потенціальною енергією взіємодії молекул
3)вважають, що молекули взаємодіють між собою та зі стінкою посудини лише під час зіткнення, удар абсолютнно пружній.
В природі ідеального газу не існує, але за певних умов( висока Т і низький р) реальний газ наближається до моделі ідеального газу( водень, кисень.
32.Емпіричні закони
1) Закон Бойля-Маріотта
Для газу даної маси при сталій абсолютній Т добуток тиску на обєм є величина стала.
Ізотерма
Ізотермічний процес – це процес що відбувається при сталій абсолютній Т
1стан p1,V1
2стан p2,V2 =>> p1*V1=p2*V2
2)Закон Гей-Люссака
Для газу даної маси при сталому тиску віднощення обємудо абсолютної Т є величина стала
Цей закон виконується для ізобарного процесу – це процес що відбувається при сталому тиску.
Ізобара
3)Закон Шарля
Для газу даної маси при сталому обєму відношення тиску до абсолютної температури залишається сталим.Цей закон виконується для ізохорного процесу – це процес що відбувається при сталому обємі
Ізохора
33.Рівняння стану ідеального газу
Це рівняння повязує між собою параметри p,V,T. Франц.вчений Клапейрон, обєднавши закони Бойля-Маріотта і Шарля отримав рівняння стану ідеального газу.
1-1’: p1*V1=p1’*V2(закон Бойля-Маріотта, 1*)
1’-2:p1’/T1=p2/T2(закон Шарля, 2*)
P1’=p1*V1/V2(3*)
3*->2*->p1*V1/T1=p2*V2/T2
P*V/T=const=B –рівняння Клапейрона( В-газова стала, різна для різних речовин)
Менділєєв обєднавши рівняння Клапейрона для 1 моля речовини та закон Авогадро отримав рівняння стану ідеального газу(рівняння М-К)
P*Vm=R*T(4*)
Vm=V*M/m(5*)
5*->4*->p*V=(m/M)*R*Т – рівняння М-К
R-універсальна газова стала (8,31 Дж/моль*К)
k=R/Na (стала Больцмана)
p=n*k*T
n=N/V(концентрація молекул). Якщо газ має постіний тиск та абсолютну температуру, то концентрація молекул газу залишається постійною. В 1 м^3 газу при нормальних умовах к-сть молекул залишається постійною – ця к-сть називається число Лошмідта.
