
Расчёт конверсии метана / Расчет конверсии метана
.doc
Содержание
1.Введение ………………………………………………………стр 3
Cхема …………………………………………………….…….стр 4
3.Расчет конверсии метана(КМ)
3.1 Материальный баланс(КМ)……………………………...стр 5
3.2 Энергетический баланс (КМ)……………………………стр 6
3.3 Эксергетический баланс(КМ)……………………………стр 6
(Эксергетический анализ химической реакции)
4.Баланс кинетической энергий (исследование политропного процесса)…………………………………………………………стр 8
5.Горение топлива (ГТ)
5.1 Материальный баланс (ГТ)…………………………….. стр 10
5.2 Энтальпический баланс (ГТ)…………………………...стр 11
5.3 Эксергетический анализ (ГТ)…………………………...стр 12
6.Эксегетический анализ процесс теплообмена………………стр 13
7.Процесс течения на примере стуйного компрессора……….стр 13
8.Мноступенчатая компрессорная установка…………………стр 15
8.1 Определение механической мощности………………….стр 15
8.2.Определение массы воды при охлаждении……………..стр 16
8.3.Определение Та……………………………………………стр 16
9.Паросиловой цикл Рекина……………………………………стр 16
9.1 Расчет механической мощности………………………….стр 20
9.2 Термический К.П.Д………………………………………..стр 20
9.3 Эксергетический К.П.Д……………………………………стр 20
10.Выводы……………………………………………………….стр 20
Дано
6 9 9 сн4: н2о 10 12 12 8 с3н8:сн4
нм3/с мпа к ------------ нм3/с мпа к к ----------------
8 2,3 1123 1:4 13 2,5 800 573 0,3:0,7
из 2:2 сн4 н2о
1,02 1:3,76 0,81 0,32
P4=P6=8 бар T4=T0=300o TS=0,8 Mex=0,95 Пер=1 25=h”-h’=2500 KДЖ /КГ
Введение
Технологические газы – смесь Н2,СО,СО2,Н2О и некоторых других – используют в агрегатах синтеза аммиака и метанола.
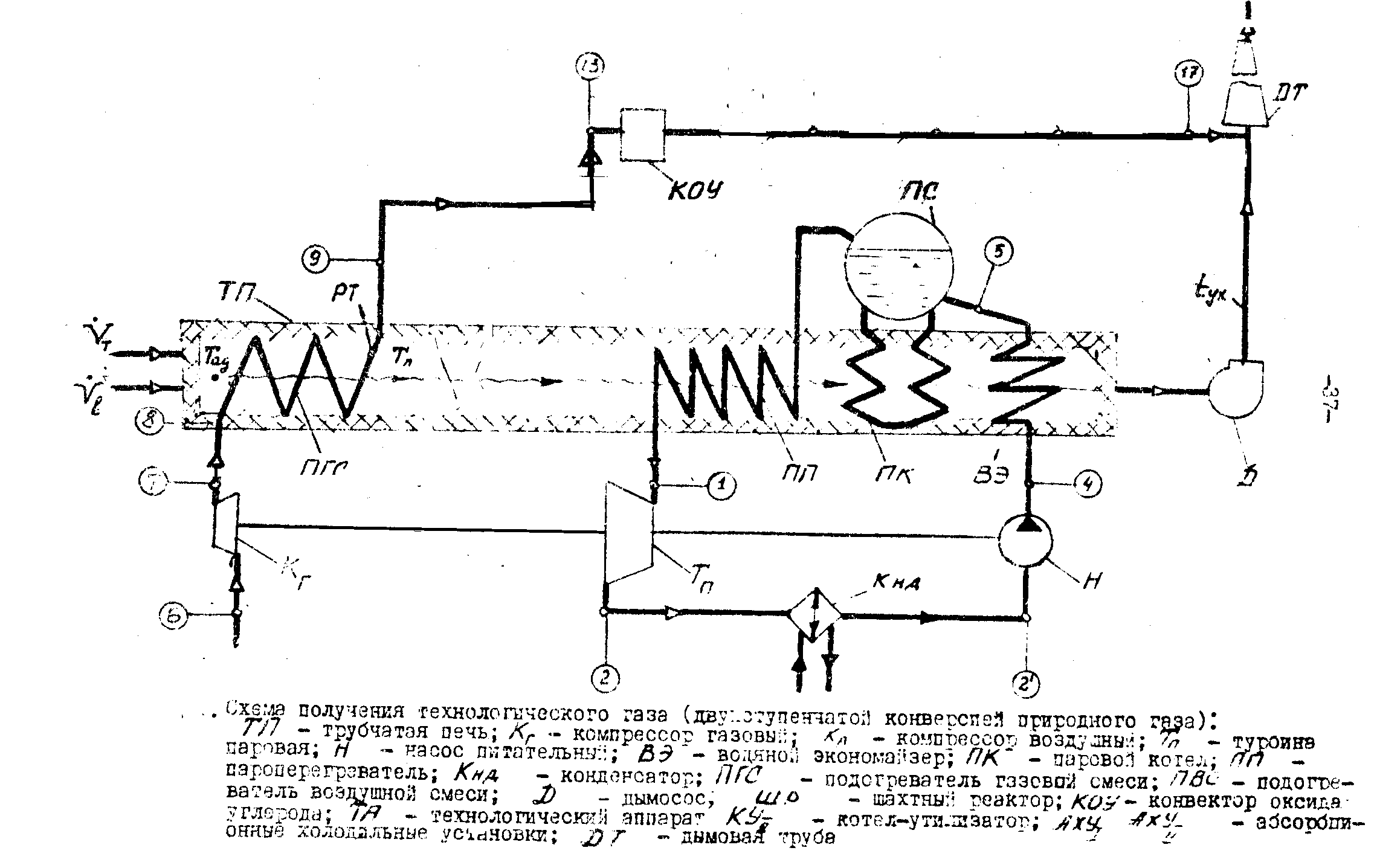
Преимущественным способом их получают путем двухступенчатой конверсии углеводородных газов, в основном метана.В первый ступени ,который служит трубчатая печь, совершается конверсия метана с водяным паром; во второй ступени, которой является шахтный реактор, конверсия метана осуществляется кислородом воздуха.(Схема ниже)
Очищенный от тяжелых фракций во входном холодилнике-конденсаторе (на схеме не показан) природный газ сжимается адиабатическим газовым компрессором Кг от давление Р6=8 бар до давления Р7
Пройдя аппарат сероочистки ( на схеме не показан ) нагретый до Т8=540оК газ смешивается с водяным паром и подается в трубчатую печь, в первую её ступень – подогреватель газовой смеси ПГС. Трубчатая печь состоит из двух последовательно включенных по ходу газа теплообменников: конвективного подогревателя ПГС и радиантных труб РТ. Конвективный и радиантный подогреватели конструктивно представляют систему параллельно включенных труб. Радиантные трубы содержат насадку-катализатор в форме колец Рашига или таблеток.
Химический процесс конверсии метана эндотермический, поэтому для осуществления такого превращения необходим подвод теплоты конвертируемому газу. С этой целью в топке-печи сжигается топливо. Конвертируемый газ после радиантных труб РТ трубчатой печи ТП направляется с параметрами Р9, Т9 в конвертор второй ступени – шахтный реактор ШР.
В шахтный реактор направляется также воздух. Воздух для второй ступени конверсии, предварительно очищенный в фильтрах , поступает на всас 4-х ступенчатого центробежного компрессора Кв и
Сжимается в ней (адиабатически в каждой ступени) до давления Р11.
После последней ступени сжатия воздух подается в подогреватель воздушной смеси ПВС, где нагревается топочными газами.
ПВО представляет собой пучок из нескольких (nb) параллельно включенных труб без насадки.
На выходе из ПВС воздух имеет параметры Р12,Т12.Воздух и конвертированная смесь подаются в шахтный реактор(ШР), затем в конвертор оксида углерода(КОУ) и далее в аппараиы утилизации теплоты.
Дымовые газы ,образовавшиеся присжиганиитоплива в топке трубчатой печи , передают теплоты конвертируемому газу сначала в РТ и ПГС , затем в ПВС , потом воде и водяному пару в парогенератор. Парогенератор состоит из водяного экономайзера ВЭ, парового котла ПК, паросборника-сепаротора ПС , пароперегреватель ПП.
После того , как дымовые газы , передав теплоту воде в водяном экономайзере , покинут парогенератор , они с температурой Тух выбрасываются дымососом D через дымовую трубу в атмосферу.
Питательная вода для парогенератора подается питательным насосом Н сначала в водяной экономайзер ВЭ , затем в барабан паросборника ПС.
Из парогенератора выходит перегретый пар с параметрами Р1,Т1.Перегретый пар , получаемый в парогенераторе , используется в паровой турбине Тп для привода компрессоров Кв и Кг , а также и для других целей, если мощность турбины превосходит суммарную мощность двух компрессоров Кв и Кг.
Расчет
3.1 Материальный баланс
Цель: Определение всех материальных процессов вход и выход
Уравнение:
Кт,т
сн4 .СН4 + н2о.Н2О н2о Н2 + со СО + со2 СО2
Q89
“i ” --------“1”
“j”----------“2”
Вход:
сн4(i)=V6/22,4=8/22,4=0,36 [кмоль/с сн4(i)]
н2о(i)= 4*сн4(i) =1,44[кмоль/с н2о(i)]
Выход:
сн4(j)= (1 -сн4) *сн4(i) = (1-0,81).0,36= 0,0684 [кмоль/c]
н2о(j)= (1-н2о) *сн4(i) = (1-0,32).1,44= 0,9792 [кмоль/c]
сн4= сн4 *сн4(i) = 0,81* 0,36= 0,0684[кмоль/c]
н2о= н2о *н2о(i) = 1,44* 0,32 = 0,46[кмоль/c]
а Материальный баланс по Н:
4*сн4 + 2*н2о=2*н2о
-
4*0,2916 +2*0,4608 = 2*X
-
X=1,044 кмоль
б Материальный баланс по С:
сн4 = со + со2 = Y +Z
-
Y+Z=0,2916 (1)
в Материальный баланс по О:
н2о = со + 2*со2
Y+ 2Z = 0,4608 (2)
(1)(2) Y=0,1224 со = 0,1224 [кмоль/c]
Z=0,1692 со2 = 0,1692 [кмоль/c]
Условие проверки: ii= jj
ii= 16*0,36 +18*1,44=31,68 [кг/c]
jj = 0,0684*16 +0,9792*18 +1,044*2 +0,1224*2 +0,1224*28 +0,1692*44 = 31,68 [кг/c]
-
Верно!
3.2 Энергетический баланс КМ
Цель:определение выделение(поглощение) энергии
Q89= jj - ii + z89
Для химическая реакция jj - ii z89
Q89= jj - ii
-
Тi(j) =298 + Ср(Т8(9) +То)
-
Ср(средное)= а + 0,5b(Т8(9)+То)
Получим таблицы значения:
|
|
|
Выход |
|
|
|
|
Вешество |
a |
b |
Cp
|
II (МДЖ/КМОЛ) |
Моль КМОЛ |
|
Н2 |
27,28 |
0,003 |
29,6 |
24,42 |
1,044 |
|
СО |
28,41 |
0,004 |
31,32 |
-84,7 |
0,1224 |
|
СО2 |
44,14 |
0,009 |
50,56 |
-351,8 |
0,1692 |
|
Н2О |
30 |
0,011 |
37,61 |
-210,79 |
0,9792 |
|
СН4 |
14,32 |
0,075 |
67,37 |
-19,28 |
0,0684 |
|
|
|
Вход |
|
|
|
|
Вешество |
a |
b |
Cp |
II (МДЖ/КМОЛ)
|
Моль КМОЛ |
|
Н2О |
30 |
0,011 |
34,67 |
-232,3 |
1,44 |
|
СН4 |
14,32 |
0,075 |
46,48 |
-61,98 |
0,36 |
Q89=104,7 МДЖ/c(*)
3.3 Эксергетический анализ химической реакции
х= х +Cph(T2-To) -Toc .Cpsln(T2/To) + Toc.Rln(Pj/Po)

 х.рех=
х+
= nj
хj(9—9)
- ni
хi(8—8)
х.рех=
х+
= nj
хj(9—9)
- ni
хi(8—8)
х- niхi (1—1) - nj хj (2—2)
 х.рех=
nj
хj(9—9)
- ni
хi(8—8)
х.рех=
nj
хj(9—9)
- ni
хi(8—8)
nB(iхi(1—1) - j хj(2—2)
Определение nB
Qe89= nB(jj- ii) где Qe89=104,7 MДЖ/C( *)
jj(2—2) T=1835
При Т=1835 нет диссоциации
|
Вещества |
a |
b |
Cp |
Н МДЖ/КМ |
II МДЖ/КМ |
моль |
|
СО2 |
32,2 |
0,022 |
55,66 |
-393,5 |
-307,96 |
1,6 |
|
Н2О |
32,3 |
0,002 |
34,43 |
-241,8 |
-188,9 |
2,6 |
|
N2 |
27,9 |
0,004 |
32,17 |
0 |
49,44 |
11,12 |
|
О2 |
31,5 |
0,003 |
34,7 |
0 |
53,33 |
0,058 |
jj= -429,84 МДЖ/КМоль
ii(1—1) T=298,16
|
Вещества |
a |
b |
Cp |
Н МДЖ/КМоль |
II МДЖ/КМоль |
Моль |
|
C3H8 |
1,72 |
0,271 |
82,52 |
-103,3 |
-103,3 |
0,3 |
|
CH4 |
14,32 |
0,075 |
36,68 |
-74,8 |
-74,8 |
0,7 |
|
O2 |
31,5 |
0,003 |
32,39 |
0 |
0 |
2,958 |
|
N2 |
27,9 |
0,004 |
29,1 |
0 |
0 |
11,12 |
ii= -83,35 МДЖ/КМоль
nB=104,7/346,49=0,3 Кмоль/c
ni хi(8—8): T=573
|
Вещества |
a |
B |
Cph |
Cps |
Моль/c |
P,atp |
х МДЖ/КМоль |
х МДЖ/КМоль |
|
H2O |
32,30 |
0,002 |
33,17 |
33,14 |
1,44 |
28,0 |
8,60 |
19,52 |
|
CH4 |
14,32 |
0,075 |
46,99 |
45,89 |
0,360 |
7,0 |
830,00 |
838,80 |
ni хi=330,1 МВТ
nj хj(9—9): T=1123оК
|
Вещества |
a |
b |
Cph |
Cps |
х МДЖ/КМ |
Моль/c |
P,atp |
х МДЖ/КМ |
|
CH4 |
14,32 |
0,075 |
67,61 |
60,97 |
830 |
0,068 |
0,667 |
860,7 |
|
Н2О |
32,3 |
0,002 |
33,72 |
33,54 |
8,6 |
0,98 |
9,43 |
28,74 |
|
Н2 |
28,8 |
0 |
28,8 |
28,8 |
235 |
1,04 |
10,12 |
253,12 |
|
СО |
28,4 |
0,004 |
31,24 |
30,89 |
275,4 |
0,12 |
1,15 |
289,32 |
|
СО2 |
32,2 |
0,022 |
47,83 |
45,89 |
20,1 |
0,17 |
1,61 |
42,61 |
nj хj=391,9 МВТ
iхi(1—1): T=298,16=To
х= х +Cph(T-To) -Toc .Cpsln(T/To) + Toc.Rln(Pj/Po)
х= х + Toc.Rln(Pj/Po) ( Po=1atp)
|
Вещества |
х МДЖ/КМ |
Моль |
Р |
х МДЖ/КМ |
|
С3Н8 |
2149,00 |
0,30 |
0,02 |
2139,30 |
|
СН4 |
830,00 |
0,70 |
0,05 |
822,60 |
|
О2 |
3,95 |
2,96 |
0,20 |
-0,089 |
|
N2 |
0,70 |
11,12 |
0,74 |
-0,14 |
iхi =1215,6 МДЖ/КМоль
jхj(2—2): T=1835 нет диссоциации
х= х +Cph(T-To) -Toc .Cpsln(T/To) + Toc.Rln(Pj/Po)
|
Вещества |
а |
b |
cph |
Cps |
Моль |
Р |
х МДЖ/КМ |
х МДЖ/КМ |
|
CO2 |
32,2 |
0,022 |
55,66 |
50,8 |
1,6 |
0,1 |
20,1 |
72,67 |
|
H2O |
32,3 |
0,002 |
34,43 |
33,99 |
2,6 |
0,17 |
8,6 |
38,87 |
|
N2 |
27,9 |
0,004 |
32,17 |
31,28 |
11,12 |
0,72 |
0,7 |
32,41 |
|
O2 |
31,5 |
0,003 |
34,7 |
34,04 |
0,058 |
0,0038 |
3,95 |
25,02 |
jхj = 579,3 MДЖ/КМоль

 х.рех=
nj
хj(9—9)
- ni
хi(8—8)
=
391,9 –
330,1
х.рех=
nj
хj(9—9)
- ni
хi(8—8)
=
391,9 –
330,1
nB(iхi(1—1) - j хj(2—2)) 0,3( 1215,6- 579,3)
х.рех= 0,32
Кроме этого у нас уравнение КПД
х.рех= конехт/обехадех
0,32 = х.рех * 0,69*0,74
КПД реакции конверсии метана х.рех= 0,64
4.Баланс кинетической энергий (исследование политропного процесса)
Цель:Определение давление Р8
Исползуя :
-баланс кинетической энергии
-Уравнение политропного процесса
Через нескольких итерации получим P8=3,2МПа
-
Баланс кинетической энергии
р=е + где е=т + d+ gdz
е12=т12(=0) +((2) 2-(1) 2)/2 + g(z2-z1)(0)
n*R(Т8-Т9)/(n-1)=89(-vdp)= ((9)2-(8)2)/2 +89
-
Уравнение политропного процесса
-
n=ln(P8/P9)/ln(8/9)(2)
8=P8/(R8*T8) ; 9=P9/(R9*T9)
Где R8=R/М8 ; R9=R/М9
М8=Мi*i ; М9=Мj*j ;
Для входа
Н2О= 1,44/1,8=0,8
СН4= 0,36/1,8=0,2
М8=18*0,8+16*0,2=17,6(КГ/Кмоль) R8=472,39 Дж/(Кг.К)
8=P8/(R8*T8)=3,2*106/(472,39*573)=11,82 Кг/М3
Для выхода
Н2О=0,9792/2,3832=0,41
СН4=0,0684/2,3832=0,029
Н2=1,044/2,3832=0,438
СО2=0,1692/2,3832=0,071
СО= 0,1224/2,3832=0,051
М9=18*0,41+16*0,029+2*0,438+44*0,071+28*0,051=13,272
(КГ/КМоль)
R9=626,53 Дж/(Кг.К)
9=P9/(R9*T9)=2,3*106/(626,53*1123)=3,27 Кг/М3
R=(R8+R9)/2=549,46 Дж/(Кг.К)
=(8+9)/2=8,1[КГ/М3]
m=8w8 где =0,785*(d3)2*k=1,73 М2 d3=0,072M;k=426(число трубы)
w8= m/(8)=31,68/(1,73*11,82)=1,55[M/C]
w9= m/(9)=31,68/(1,73*3,27)=5,6[M/C]
w=3,57[M/C]
e =(w92-w82)/2=14,5ДЖ/КГ
P=Pтр +Pмс
89=P/ где P=w**L/K K=6,15*10-4*(0,0027)2 (M2)
L=42 М
=(1+2)/2 (расcчитываем только СН4 , Н2О , Н2)
Формулы определение из методики
1=20,1*10 -6Па.с
2=31,85*10 -6Па.с
=(1+2)/2=26*10 -6Па.с
P=w**L/K=0,87*10 6Па
89=P/=1,14*105
(2)n=lg(3,2/2,3)/lg(11,8/3,27)=0,26
p12=n*R(Т1-Т2)=1,06*105
Уравнение (1) для проверить
106179,4=14,5+114820,4=114834,9
Расхождение между слевой и правой части баланса = 7%
Применим P8=3,2*10 6Па
5.Исследование процесс горения
5.1 Материальный баланс процесса
0,3С3Н8 + 0,7СН4 + 2,9О2 + 10,9N2 1,6 СО2 2,6Н2О + 2,9(-1) О2 + 10,9 N2
При Т>1500
(1) СО2 СО + 1/2 О2
1-X X X/2
(2) Н2О ОН + 1/2 Н2
1-Y Y Y/2
Поэтому мы получаем последние продукты :
1,6(1-X)СО2 + 1,6XСО + 2,6(1-Y)Н2О + 2,6YОН +1,3YН2 +
(0,8X + 2,9(-1))О2 +10,9N2
Сумма моля продуктов : =1,6(1-X) +1,6X +2,6(1-Y) +2,6Y +1,3Y +0,8X +2,9(-1) +10,9 1,3 +13,8= 15,376
(Так как X 0, Y0)
Константа равновесия:
-
K
 p1=
(1-X)(
)
1/2
p1=
(1-X)(
)
1/2
X(0,5X)1/2
-
K
 p2=
(1-Y)( )1/2
p2=
(1-Y)( )1/2
Y(0,5Y)1/2
При Т=2200 Рассматрим продукты:
|
Вещества |
a |
b |
Cp |
Н МДЖ/КМоль |
ii МДЖ/КМоль |
|
CO2 |
32,20 |
0,022 |
55,66 |
-393,51 |
-288,10 |
|
O2 |
31,50 |
0,003 |
34,70 |
0,00 |
67,90 |
|
N2 |
27,90 |
0,004 |
32,17 |
0,00 |
63,17 |
|
OH |
29,00 |
0,06 |
92,99 |
-42,10 |
155,59 |
|
H2 |
28,80 |
0,000 |
28,80 |
0,00 |
59,87 |
|
CO |
28,40 |
0,004 |
32,67 |
-110,53 |
-46,75 |
|
H2O |
32,30 |
0,002 |
34,43 |
-241,81 |
-159,31 |
Кр1=2430 X=0,017
Kp2=3240 Y=0,014
jj= -148,86 МДЖ/КМоль
При Т=2400
|
Вещества |
a |
B |
Cp |
Н МДЖ/КМ
|
ii МДЖ/КМ |
|
CO2 |
32,20 |
0,022 |
56,33 |
-393,51 |
-275,10 |
|
O2 |
31,50 |
0,003 |
36,03 |
0,00 |
75,74 |
|
N2 |
27,90 |
0,004 |
33,64 |
0,00 |
70,71 |
|
OH |
29,00 |
0,06 |
109,94 |
-42,10 |
188,99 |
|
H2 |
28,80 |
0,000 |
31,82 |
0,00 |
66,89 |
|
CO |
28,40 |
0,004 |
33,94 |
-110,53 |
-39,19 |
|
H2O |
32,30 |
0,002 |
44,44 |
-241,81 |
-148,40 |
Kp1=152 X=0,1
Kp2=202 Y=0,09
jj= 95,13 МДЖ/КМоль
При исходных величинах T=298,16(СН4, С3Н8, О2, N2)
ii= -83,35 МДЖ/КМоль
|
|
|
T=298.16 |
To=298.16 |
|
|
|
|
Вещества |
a |
b |
Cp |
Н МДЖ/КМ |
II МДЖ/КМ |
Mol КМ |
|
C3H8 |
1,72 |
0,271 |
82,52 |
-103,30 |
-103,30 |
0,30 |
|
CH4 |
14,32 |
0,075 |
36,68 |
-74,80 |
-74,80 |
0,70 |
|
O2 |
31,50 |
0,003 |
32,39 |
0,00 |
0,00 |
2,96 |
|
N2 |
27,90 |
0,004 |
29,09 |
0,00 |
0,00 |
11,12 |
