
Англійський металофізик Юм-Розері відкрив твердий розчин на основі електронного з’єднання. Цей вид з’єднань утворюється двома металами із наступних груп: мідь, срібло, золото, кобальт, свинець, нікель, з однієї сторони та берилій, цинк, кадмій, алюміній, олово, кремній – з іншої. Ці з’єднання характеризуються певним відношенням валентних електронів до числа атомів (3/2; 21/13 чи 7/4), причому кожному відношенню відповідає певна кристалічна решітка. Так, відношенню 3/2 відповідає ОЦК решітка, 21/13 – складна кубічна, 7/4 – гексагональна решітка.
До числа найбільш важливих з’єднань, які утворюються в сплавах, відносяться фази втілення. Це з’єднання перехідних металів (залізо, марганець, хром, молібден тощо) з неметалами, які мають малі атомні радіуси (вуглець (0,077 нм), водень (0,046 нм), азот (0,071 нм)). У цьому випадку атоми металу утворюють прості решітки, а атоми неметалу впроваджуються в пори цих решіток в певні місця. Основна відмінність фаз втілення від твердих розчинів втілення, полягає в тому, що перші утворюють нову кристалічну решітку із закономірним розташуванням атомів компонентів, а другі зберігають упаковку розчинника. Фази втілення мають високі температури плавлення, твердість і електро-провідність.
2.2. Діаграми стану сплавів
Діаграми стану є графічним зображенням фазового стану сплавів в залежності від температури і концентрації компонентів.
Діаграми стану показують стійкий стан, при якому система має мінімум вільної енергії, тому вони назива-ються діаграмами рівноважного стану. Цей стан відповідає дуже повільному нагріванню та охолодженню сплаву. Оскільки істинну рівновагу в реальних умовах досягти важко, то діаграми стану носять теоретичний характер, а на практиці вони використовуються для розгляду перетворень при малих швидкостях нагріву та охолодження.
Загальні закономірності співіснування стійких фаз, які відповідають теоретичним умовам рівноваги, можуть бути виражені в математичній формі правилом фаз (законом Гіббса):
с = k - f + п,
де с – число степеней свободи; k– кількість компонентів; f – число фаз у системі; п – число зовнішніх факторів (k, п i f– незалежні змінні фактори рівноваги).
Під числом степеней свободи (варіантністю) системи розуміють число зовнішніх і внутрішніх факторів (температура, тиск, концентрація), які можна змінювати без зміни числа фаз в системі.
Якщо с = 0 (нонваріантна система), то зміна хоча б одного фактора приведе до порушення рівноваги та викличе зміну фазового стану системи. Якщо с = 1 (моноваріантна система), то можлива зміна в деяких межах одного з факторів і це не приведе до зменшення чи збільшення числа фаз.
Фазою називається однорідна частина системи, яка відділена від іншої частини поверхнею розподілу, при переході через яку хімічний склад, або структура речовини змінюється скачками. Так, розплавлений метал одно-фазний, а сплав механічна суміш – двофазний.
Число зовнішніх факторів п це температура і тиск. Оскільки в металах і сплавах усі перетворення відбу-ваються при постійному (атмосферному) тиску, то п = 1, тоді правило фаз записується так:
с = k - f + 1.
Правило фаз дозволяє перевірити правильність побудови кривих кристалізації та діаграм стану. При с = 0 на кривій охолодження відмічається полочка, а при с = 1 – перелом лінії. Діаграми стану будують на основі кривих охолодження. Для конкретного сплаву з різною концентра-цією компонентів будують криві охолодження. Потім критичні точки з кривих охолодження переносять в систему координат температура-концентрація і з’єднують їх лініями. Так отримують основні лінії діаграм.
Конкретний приклад побудови діаграми сплаву свинець-сурма наведений на рисунку 2.1.
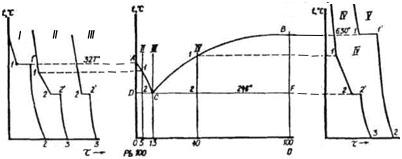
Рис. 2.1
Лінію АСВ називають ліквідус (у перекладі з латинського означає «рідкий»). Вище цієї лінії сплав знаходиться в рідкому стані. Лінію ДСF, яка відділяє сплав в твердому стані від двофазного (рідина плюс тверде тіло), називають солідус (твердий). Точка С, де перетинаються лінії ліквідус і солідус, називається точкою евтектики (легкоплавкий). Ця точка характерна тим, що при кристалізації сплав із рідкого стану відразу переходить у твердий.
При наявності поліморфних перетворень у компонентів сплаву критичні точки на кривих охолодження будуть і в твердому стані, тому на діаграмі крім лінії ліквідус та солідус будуть ще лінії, які проходять нижче лінії солідус.
У наведеному прикладі діаграма має простий вигляд. Проте з неї можна почерпнути чимало корисного. Наприклад, без затруднень можна знайти температуру плавлення сплаву будь-якої концентрації, встановити залежність температури плавлення від концентрації, визначити точку евтектики, встановити, як із зміною концентрації сплаву змінюється температура початку і кінця кристалізації тощо. Крім того, діаграма стану дозволяє проводити якісний і кількісний аналіз фазового складу при різних температурах. Для цього, через будь-яку точку на лінії сплаву проводиться лінія, паралельна осі концентрації (конода). Точки перетину її з осями і лініями діаграми покажуть концентрацію рідкої і твердої фаз.
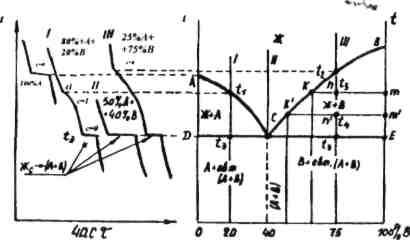
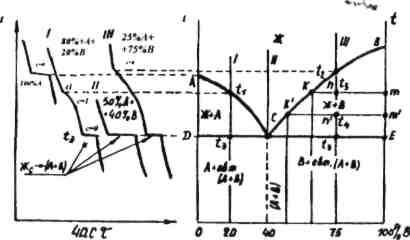
Рис. 2.2
Наприклад, при температурі t3 точка т характеризує склад твердої фази компонента В. Перетин коноди з лінією ліквідує k дозволяє визначити склад рідкої фази (опустити перпендикуляр на вісь концентрації) (рис. 2.2).
При зменшенні температури продовжується криста-лізація компонента В, а тому його концентрація в рідині зменшується.
Таким чином, при охолодженні сплаву точка к переміщується по лінії ліквідус, наближуючись із зниженням температури до точки С. Значить, лінія ліквідус показує зміну концентрації компонента В у рідкій фазі по мірі кристалізації сплаву. В точці С рідина, яка залишилась, дає евтектичну суміш кристалів A і В.
Кількісна оцінка здійснюється правилом відрізків, яке можна сформулювати з двох частин. Перша з них формулюється так:
Щоб визначити концентрацію компонентів у фазах, через дану точку п, яка характеризує стан сплаву, проводять горизонтальну лінію до перетину з лініями, які обмежують дану область. Проекції точок перетину на вісь концентрації показують склад фаз.
Друга:
Для того, щоб визначити кількісне співвідношення фаз, через дану точку п проводять горизонтальну лінію. Відрізки цієї лінії тп і пk між заданою точкою і точками, які визначають склад фаз, обернено пропорційні кількості фаз.
Виходячи з цього правила знайдемо співвідношення між рідкою фазою (Ж) і кристалами (В):
Ж
=
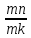 · 100%; B
=
· 100%; B
=
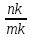 · 100%
· 100%
Якщо кількість сплаву позначити Q, то
Ж
=
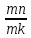 · Q;
B
=
· Q;
B
=
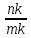 ·Q
·Q
Після розгляду побудови діаграми сплаву свинець-сурма може виникнути запитання: чи велика різноманіт-ність діаграм сплавів? Виявилося, що ні. Експериментальні дослідження показали, що всі діаграми можна розділити на чотири типи (рис. 2.3).
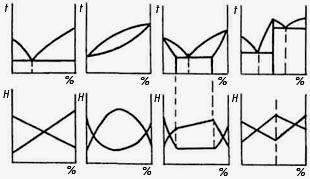
а) б) в) г)
Рис. 2.3
Як з’ясувалось, тип діаграми відповідає типу сплаву. Механічна суміш має діаграму, показану на рис. 2.3, а, твердий розчин з обмеженою розчинністю в твердому стані розчинюваного – рис. 2.3, б, твердий розчин з необмеженою розчинністю – рис. 2.3, в, хімічна сполука – рис. 2.3, г. Проте, діаграми деяких сплавів не співпадають із зазначеними вище. Вони складаються з їх частин. Виявляється, що тип сплаву залежить не тільки від його компонентів, а й від концентрації. До цього винятку належить і діаграма сплаву заліза з вуглецем. При незначній кількості вуглецю залізо з вуглецем утворює і твердий розчин, а більший – хімічну сполуку.
