
Розділ І. БУДОВА І ВЛАСТИВОСТІ МЕТАЛІВ
1.1. Загальні відомості про метали
До металів відносяться хімічні елементи, що проявляють металічні властивості. Влучне визначення металу дав Ломоносов – «Метал – це тіло, яке можна ковать». В ньому закладений глибокий зміст. Дійсно, метали при пластичній деформації, на відміну від інших твердих тіл, не руйнуються.
Серед відомих хімічних елементів металів багато, біло 80. Хоча явно виражені металічні властивості проявляє не так багато хімічних елементів, що формально відносяться до металів. Ще менше цих елементів використовується на практиці.
Властивості металів можна представити у вигляді такої схеми:

Метали класифікують за різними ознаками.
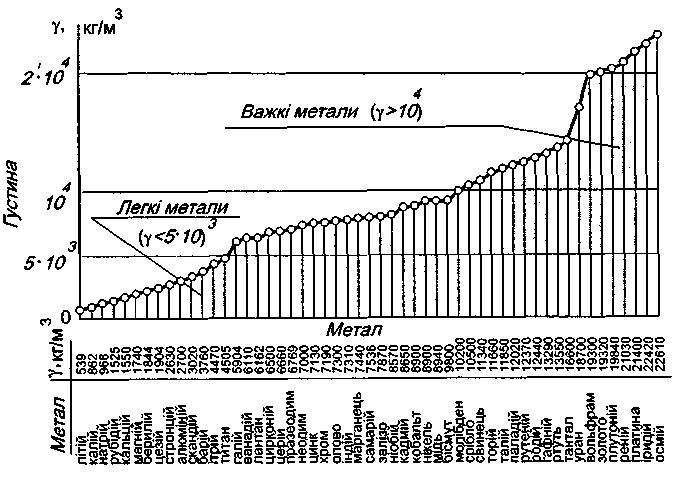
За густиною метали розділяють на легкі і важкі. До легких відносять метали з густиною до ρ = 5·103 кг/м3. До важких – ρ = 10·103 кг/м3. Найлегший метал літій (ρ = 539 кг/м3), найважчий – осмій (ρ = 226·103 кг/м3).
За температурою плавлення метали розділяють на легкоплавкі (tпл < 500oC) та тугоплавкі (tпл > 1700oC). До легкоплавких відносять такі метали як цезій, калій, натрій, літій, олово, свинець, цинк тощо. Тугоплавкі метали – хром, ванадій, цирконій, молібден, ніобій, тантал, вольфрам тощо.
Серед металів виділяють благородні – золото, срібло, платина, осмій, іридій, паладій, рутеній і родій. Вони корозостійкі, пластичні, мають гарний зовнішній вигляд.
Окрему групу становлять радіоактивні метали – уран, торій, паладій, плутоній, полоній, франній, радій, актиній.

Значну частину металів становлять перехідні метали. Вони характеризуються непослідовним заповненням електронами енергетичних рівнів в ізольованих атомах. Так, у 4-му періоді в елементах від скандію до нікелю 3d підоболонка не завершена, тоді як 4s підоболонка вже містить 1…2 електрони. У 5-му періоді в металах від ітрію до паладію незавершеним є 4d рівень. У 6-му періоді в елементах від лантану до платини несподівано заповнюється 4f і 5d підоболонки.
Метали, атоми яких мають повністю заповнені або повністю не заповнені електронами d і f оболонки називають простими. Характерною ознакою атомів є наявність в них вільних, колективізованих електронів. Чим меншою є робота, яку необхідно затратити для видалення з ізольованого атому електрона, зовнішньої оболонки, тим сильніші металічні властивості елементів.
Магнітні властивості металів також зумовлені їх електронною будовою. За магнітною сприйнятливістю метали розділяють на діамагнетики, парамагнетики та феромагнетики. Діамагнетики відштовхуються від магніту. Парамагнетики – нейтральні до магнітного поля. Феромагнетики притягуються до магніту.
1.2. Сили міжатомного зв’язку
Атоми в твердому тілі тісно пов’язані між собою дією міжатомних сил притягання і відштовхування. Сили притягання виникають завдяки взаємодії електронів з позитивно зарядженим ядром власного атома, а також з ядром сусідніх атомів. Сили відштовхування виникають в результаті взаємодії позитивно заряжених ядер сусідніх атомів при їх наближенні. Сили відштовхування проявляються при значному наближенні і збільшуються інтенсивніше, ніж сили притягання.
Рис. 1.1. Зміна сили взаємодії (а) і енергії зв’язку (б) при наближенні атомів у кристалі
Зрівноваження сил відбувається при наближенні елементарних частинок на відстань d0. Цьому зближенню відповідає мінімум енергії зв’язку Езв., що робить кристал термодинамічно стабільним. Вона визначає температуру плавлення, випаровування, модуль пружності, температурний коефіцієнт лінійного розширення та ін.
Тип зв’язку між атомами в твердому тілі (кристалі) визначається електронною будовою атомів, які взаємодіють між собою. Найважливіші зв’язки: іонний, ковалентний і металічний.
Іонний зв’язок будується на взаємному притяганні протилежно заряджених іонів. Він виникає між різнорідними атомами, один з яких віддає валентний електрон і перетворюється в позитивно заряджений іон, а інший приймає електрон і стає негативно зарядженим. Таким чином, іонний зв’язок зумовлюється електростатичною взаємодією протилежно заряджених іонів.
У більшості випадків іонні кристали – діелектрики.
До найбільш характерних властивостей іонних кристалів відносять високу температуру плавлення, високу механічну міцність іонних кристалів.
Ковалентний зв’язок утворюється за рахунок об’єднання валентних електронів сусідніх атомів на одному енергетичному рівні. Об’єднані електрони належать водночас обом атомам і перебувають на спільному рівні. Ці електрони мають протилежно скеровані спіни і взаємодіють як два електромагніти.
Ковалентний зв’язок утворюється переважно між однорідними атомами. Багато кристалів з таким зв’язком характеризуються високою температурою плавлення, значною твердістю і зносостійкістю.
Металевий зв’язок реалізується електростатичною взаємодією між позитивно зарядженими іонами та негативно зарядженими вільними електронами. Кристал металу можна розглядати як сукупність позитивних іонів, що знаходяться в середовищі майже вільних, колективних електронів. При зближенні атомів металу їх валентні електрони розташовуються не на зовнішніх орбітах, а займають широкий енергетичний рівень і можуть досить легко переміщуватися в металі. Цим пояснюється висока електропровідність і теплопровідність металів.
Металевий зв’язок не спрямований в одному напрямку, завдяки чому іони металу можуть легко зміщуватися під дією зовнішньої сили. Цим зумовлюється висока пластичність металів.
Ван-дер-ваальсів зв’язок зумовлений силами притягання (силами Ван-дер-Ваальса), котрі виникають між нейтральними атомами в кристалах інертних газів, органічних сполук та в деяких простих речовинах. Ці досить слабкі сили є результатом перерозподілу густини електронів за законом індукції.
Для кристалів, де діють ці сили характерні низькі температури плавлення.
