
- •Теоретичні відомості
- •Зміст роботи
- •1. Утворення і дисоціація сполук з комплексним катіоном.
- •2. Утворення і дисоціація сполук з комплексним аніоном.
- •3. Різниця між простими і комплексними іонами ферум (III).
- •4. Стійкість і руйнування комплексних іонів.
- •5. Дисоціація подвійної солі.
- •6. Гідратна ізометрія аквакомплексів.
- •Індивідуальні завдання
Лабораторна робота №7
Тема: Комплексні сполуки
Мета роботи: ознайомлення з реакціями утворення комплексних сполук, їх дисоціацією, а також з властивостями сполук із комплексними іонами.
Обладнання та реактиви: 1) мірний циліндр ємністю 10 мл; 2) штатив з пробірками; 3) пальник; 4) цинк; 5) хром (III) хлорид (кристали); 6) натрій гідроксид (2 н.); 7) водний розчин амоніаку (2 н.); 8) амоній сульфід (2 н.); 9) барій хлорид (1 н.); 10) вісмут (III) нітрат (0,5 н.); 11) ферум (II) сульфат (0,5 н.); 12) ферум (III) хлорид (0,5 н.); 13) залізоамонійні галуни (0,5 н.); 14) калій йодид (насич. та 0,1 н.); 15) калій гексаціаноферат (III) (0,5 н.); 16) калій роданід (0,5 н. та насич.); 17) натрій хлорид (2 н.); 18) купрум (II) хлорид (0,5 н.); 19) меркурій (II) нітрат (0,5 н.); 20) аргентум нітрат (насич. та 0,1 н).
Теоретичні відомості
Комплексними сполуками називаються такі сполуки, у вузлах кристалічної гратки яких перебувають комплексні іони, здатні існувати в розчині.
Будову молекул комплексних сполук розглядають на основі координаційної теорії. Молекули комплексних сполук складаються із внутрішньої й зовнішньої сфер. У центрі молекул перебувають атоми або іони-комплексоутворювачі. Ними можуть бути як метали, так і неметали.
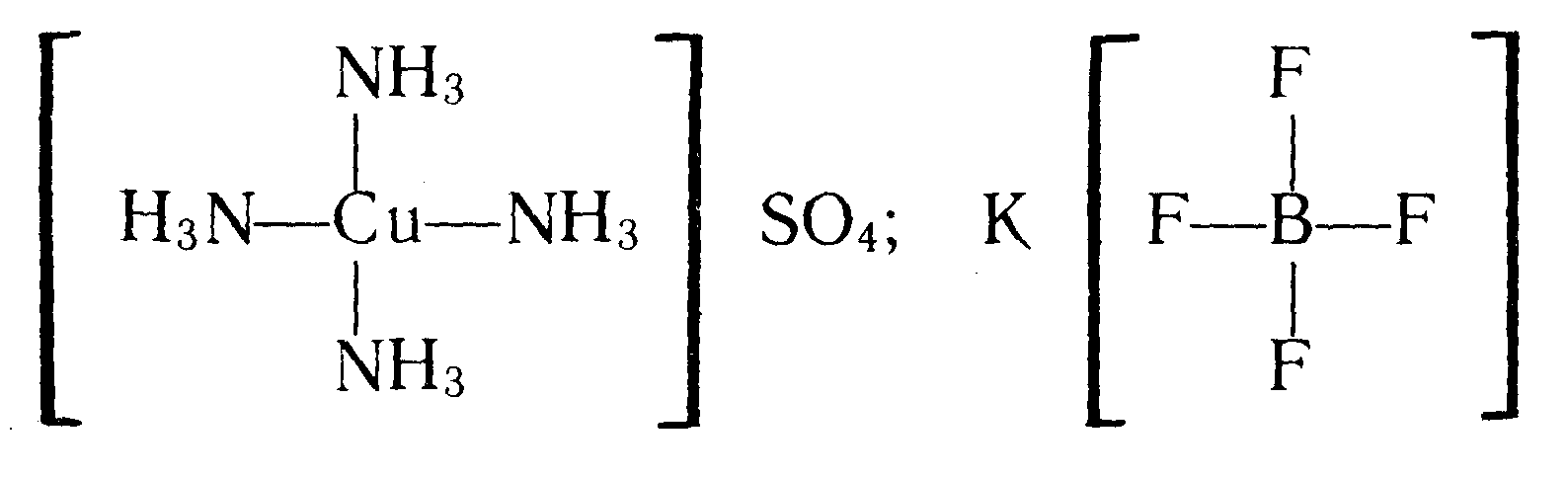
Найбільш типові комплексоутворювачі — елементи побічних підгруп періодичної системи Д. І. Менделєєва.
Молекули або іони, безпосередньо пов'язані із центральним іоном, називаються лігандами. Ними можуть бути аніони кислот і гідроксид-іони, наприклад, у К4 [Fe (CN)6] і в Na3 [Al (OH)6]; електронейтральні молекули (Н2О, NH3, СО і ін.), наприклад в [Ag(NH3)2]Cl або ті й інші одночасно, наприклад [Pt(NH3)4Cl2]Cl2.
Нижче наведена схема будови молекули К3[Fe(CN)6] Комплексоутворювач — іон Fe+3.
Ліганди
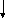
К3[Fe(CN)6]

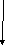





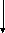
Внутрішня сфера –
комплексний іон
Зовнішня сфера Координаційне число
Загальне число часток, безпосередньо пов'язаних з комплексоутворювачем, називається координаційним числом центрального атома.
Нижче наведені координаційні числа деяких комплексоутворювачів:
|
Координаційне число |
Комплексоутворювач |
|
2 |
Ag+, Cu+ |
|
4 |
Cu+2, Zn+2, Hg+2, B+3, Al+3, Pt+2 |
|
6 |
Fe+2, Fe+3, Co+3, Pt+4, Cr+3, Al+3? Zn+2, Ni+2 |
Знаючи склад комплексної сполуки й враховуючи електронейтральність молекули, можна визначити заряд комплексного іона й ступінь окиснення комплексоутворювача.
Комплексоутворення сильно змінює властивості вихідних речовин. Наприклад, взаємодія слабкої основи Сu(ОН)2 з аміаком приводить до утворення сильної комплексної основи [Cu(NH3)4](OH)2:
Сu (OH)2 + 4NH3 [Cu (NH3)4] (OН) ,
Сu (OH)2 + 4NH3 [Cu (NH3)4]2++20H–
Взаємодія середньої сили плавикової кислоти HF з BF3 приводить до утворення сильної комплексної кислоти Н [BF4]
BF3 + HF H [BF4]
Комплексоутворення звичайно супроводжується зміною властивостей центрального атома й лігандів, що пов'язане з їхнім взаємним впливом один на одного. Наприклад, у некомплексних солях для кобальту й свинцю стійкою є ступінь окиснення +2, а в комплексних сполуках відповідно +3 і +4.
У розчинах комплексні сполуки зазнають дисоціацію трьох видів: 1) на комплексний іон і іон зовнішньої сфери; 2) комплексного іона; 3) лігандів.
Дисоціація комплексних сполук на комплексний іон і іон зовнішньої сфери проходить практично націло:
К3 [Fe (CN)6] 3K++[Fe (CN)6]3–
При реакціях обміну комплексні іони переходять із одних сполук в інші, не змінюючи свого складу. Тому в розчині легко виявляється комплексний іон. Наприклад, у реакції
FeSO4 + 2K3 [Fe (CN)6]– KFe [Fe (CN)6]+3K2SO4
він переходить в осад турнбулевої сині:
Fe2+ + K++[Fe (CN)6]3– KFe2+ [Fe+3 (CN)6]
Комплексні іони дисоціюють як слабкі електроліти. Їхня дисоціація підкоряється закону дії мас і з кількісної сторони характеризується константою, яка визначається як константа нестійкості комплексу.
Так, комплексний іон [Ag(NH3)2]+ дисоціює за схемою:
[Ag(NH3)2] Ag++2NH3
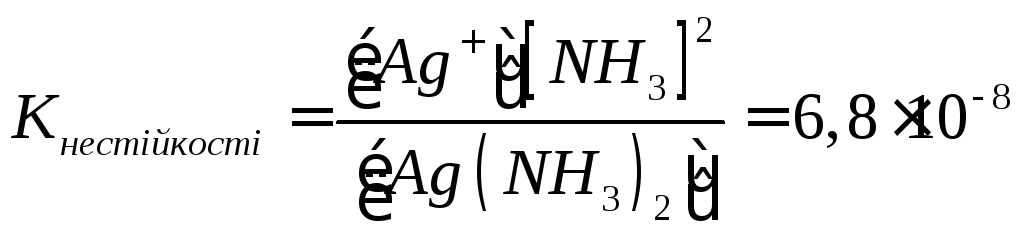
Чим більша величина константи, тем менш стійкий комплексний іон.
Спрямованість реакцій у розчинах убік утворення комплексних сполук обумовлена тим, що комплексоутворення приводить до утворення слабкого електроліту — комплексного іона.
Перехід одних комплексів в інші здійснюється тільки в тому випадку, якщо утворюється більш стійкий у розчині комплексний іон, що є більш слабким електролітом. Наприклад, при додаванні розчину KCN до розчину [Ag(NH3)2]Cl останній руйнується у зв'язку з тим, що утворюється нова сполука, що містить комплексний іон [Ag(CN)2]–, який більш стійкий у розчині, ніж іон [Ag(NH3)2]+ (Кнест [Ag (CN)2]– = 110–21).
Рівняння реакції, що відбувається при цьому:
[Ag (NH3)2]C1 + 2KCN K [Ag (CN)2] +KC1 + 2NH3
У багатьох випадках дисоціація комплексного іона може бути виявлена за допомогою відповідного реактиву, якщо останній має достатню чутливість. Так, наприклад, наявність іонів Ag+ у розчині комплексної солі [Ag (NН3)2]Сl виявляють за допомогою Kl, додавання якого викликає руйнування комплексного іона за рахунок утворення жовтого осаду Agl. Пояснюється це в такий спосіб.
Добуток розчинності іодіда срібла є досить малою величиною: ПРАgl=1,7 10–16. Тому, незважаючи на мізерно малу концентрацію іонів Ag+ у розчині [Ag (NH3)2]C1, при додаванні KI добуток концентрації іонів [Ag+] і [I–] перевищує величину добутку розчинності Agl, внаслідок чого й випадає осад іодіда срібла.
Навпаки, інші реактиви на іон Ag+ (наприклад, NaOH), які утворюють із ним сполуки, що володіють більшою розчинністю, у цьому випадку не можуть бути використані для його виявлення, тому що не відбувається руйнування комплексного іона. Ступінь дисоціації комплексних іонів збільшується при зниженні концентрації розчину. Тому розведення розчину веде в багатьох випадках до розкладання комплексних сполук.
До комплексних солей, складні іони яких легко дисоціюють, відносять подвійні солі, прикладом яких є алюмо-калієві квасці КАl (SO4)2 12Н2O, які можна представити й у вигляді комплексної сполуки K [Al (SO4)2] 12Н2O. Іноді подвійні солі протиставляються комплексним солям. Вірніше розглядати їх як комплексні сполуки, що відрізняються малою стійкістю комплексного іона (або як комплексні сполуки, що характеризуються великою константою нестійкості). Координовані молекули лігандів, що містять водень, можуть також дисоціювати як слабкі електроліти з відщепленням протонів. Так, амінокомплекси дисоціюють з утворенням амідо-комплексів:
[Pt (NH3)6]4+ [Pt (NH3)5NH2]3+ + H+,
а аквакомплекси — з утворенням гідроксокомплексів:
[А1 (Н2О)6]3+ [А1 (Н2О)5ОН]2++Н+
Введення в таку рівноважну систему лугу приводить до зрушення рівноваги вправо, до подальшого відщеплення протонів і утворення гідрокомплексів.
Здатність катіонів до утворення стійких гідроксокомплексів обумовлює амфотерні властивості відповідних гідроксидів. Наприклад, при взаємодії А1(ОН)3 з лугом відбувається реакція:
А1 (ОН)3 + 3КОН К3 [А1 (ОН) 6]
Просторове розташування складових частин комплексної сполуки часто може бути порушене без зміни складу молекули в цілому. Так, наприклад, сполуці СгСl36Н2O відповідають три речовини. У молекулі фіолетової солі всі шість молекул води перебувають у внутрішній сфері [Сг(Н2O)6]Cl3.
При нагріванні частина молекул води переходить із внутрішньої сфери, уступаючи місця хлорид-іонам. При цьому утворюються наступні комплексні солі:
[Сг (Н2О)5Сl]Cl2 Н2O
світло-зеленого кольору
[Сг (Н2O)4С12]Сl 2Н2O
темно-зеленого кольору
Ізомерія, подібна, що спостерігалася в СгС13 6Н2О, називається гідратною ізомерією, тому що обумовлена різним просторовим розташуванням молекул води в комплексній сполуці. У комплексних сполуках, як показано вище, спостерігаються й інші види ізомерії.
Між іонами внутрішньої й зовнішньої сфери здійснюється іонний зв'язок. Хімічний зв'язок між центральним атомом і лігандами ковалентний, утворений в основному по донорно-акцепторному механізму.
Наприклад, у сполуці [Ag (NH3)2]C1 зв'язок між зовнішньою й внутрішньою сферою іонний. Дві молекули NH3 внутрішньої сфери координуються іоном Ag+ за рахунок двох -зв'язків, утворених по донорно-акцепторному механізму (молекули NH3 — донори, іон Ag+ — акцептор електронних пар).

При утворі -зв'язків у цьому випадку здійснюється sp -гібридизація орбіталей атома срібла, валентний кут становить 180°.
Величини валентних кутів у комплексних іонах залежать від характеру гібридизації орбіталей при утворенні зв'язків між центральним атомом і лігандами.
|
Координаційне число |
Характер гібридизації орбіталей |
Просторове розташування лігандів |
|
2 4 6 |
sp sp3 sp3d2 |
Лінійне Тетраедричне Октаедричне |
Координаційне число визначається числом -зв'язків, утворених центральним атомом з лігандами за рахунок гібридних орбіталей.
