
1. Экзотермические и эндотермические реакции.
2. Тепловой эффект химической реакции. Понятие об энтальпии.
3. Термохимические уравнения.
4. Теплота образования. Теплота сгорания.
5. Закон Гесса и следствия из него.
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ
Химические реакции протекают с выделением или поглощением энергии (обычно в виде теплоты).
Химические реакции, протекающие с выделениемтеплоты, называютсяэкзотермическими - Q0, а реакции, протекающие споглощениемтеплоты, –эндотермическими - Q<0.
Количество теплоты, которое выделяется или поглощается в результате химической реакции, называется тепловым эффектомреакции (Q). Тепловой эффект выражается в кДж или ккал (1 ккал = 4,187 кДж).
Уравнения химических реакций, в которых записывается тепловой эффект реакции, называют термохимическими уравнениями.
Величина Q указывается в правой части уравнения со знаком «+» в случае экзотермической реакции и со знаком «–» в случае эндотермической реакции. В термохимическом уравнении указываются агрегатные состояния реагентов и продуктов реакции, т.к. тепловой эффект реакции зависит от агрегатных состояний реагирующих веществ. По термохимическим уравнениям можно проводить различные расчеты, т.к. тепловой эффект реакции относится к мольным количествам исходных веществ и продуктов реакции. Также термохимические уравнения можно записывать с величиной изменения энтальпии (Н).
Теплота образования– это теплота, которая выделяется или поглощается при образовании 1 моль сложного вещества из простых веществ при стандартных условиях.Теплоты образования простых веществ приняты равными нулю.
Стандартные условия– давление 1 атм (101,3 кПа), Т = 298К (25 °С).
Теплота сгорания– это теплота, выделяющаяся при сгорании 1 моль вещества в кислороде при стандартных условиях с образованием оксида элемента в высшей степени окисления.Теплоты сгорания негорючих веществ равны нулю.
Теплоты сгорания и образования – справочные величины, они приводятся в справочных термодинамических таблицах при стандартных условиях.
ТЕРМОДИНАМИЧЕСКАЯ ФУНКЦИЯ
|
Название |
Обозначение, размерность |
Определение, физический смысл |
Расчет |
|
Энтальпия |
Н кДж/моль
Нобро298 |
Тепловой эффект химической реакции при постоянном давлении. Экзотермическая реакция -Н0, тепло выделяется. Эндотермическая реакция -Н0,тепло поглощается.
Теплота образования 1 моль вещества из простых веществ, устойчивых при стандартных условиях.
|
Закон Гесса (1840 г): Тепловой эффект химической реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса. 1 следствие (всегда): тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом сумм теплот образования исходных веществ (с учетом коэффициентов) Нх.р.=Нобр.прод.-Нобр.исх. 2 следствие (для горючих веществ): тепловой эффект химической реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов реакции (с учетом коэффициентов) Нх.р. =Нсгор. исх -Нсгор. прод |
ОПРЕДЕЛЕНИЕ ЭНТАЛЬПИИ СВЯЗИ
2С(графит)
+ 3Н2(газ)
С2Н6(газ),
Н1
= Н
обр.(С2Н6)
2Натомиз
3Натомиз
Н
Н




2
С (газ) + 6Н (ат)
-Ес-с
- 6Е
с-н
Н
-С-С
-
Н

Н Н
Н обр.(С2Н6) = 2Натомиз + 3Натомиз-Ес-с - 6Е с-н
РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ
Вычислить теплоту реакции получения гидроксида кальция из оксида кальция и воды, если теплота образования оксида кальция равна +635,7 кДж/моль, теплота образования воды равна +285,8 кДж/моль, а теплота образования гидроксида кальция равна +986,8 кДж/моль.
Решение
Q р-ции = Qобр.прод. – Q обр. реаг. = Q обр. Са(ОН)2 – (Q обр.СаО + Q обр. Н2О) = 986,8 – (635,7 + 285,8) = 65,3 кДЖ/моль
Ответ. 65,3 кДж/моль.
Окисление глюкозы в организме может протекать по реакции:
С6Н12О6 (тв.) + 6О2 (г.) = 6СО2 (г.) + 6Н2О (ж.), Н = –2803 кДж.
Какое количество теплоты выделится при окислении 800 г глюкозы?
Решение
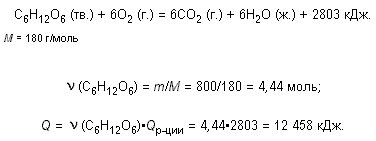
Ответ. 12 458 кДж.
Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mg + O2 = 2MgO + 1204 кДж
Решение
1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу. ν = m / M
ν(MgO) = 120г: 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции
По уравнению 2 моль MgO - 1204 кДж
По условию 3 моль MgO - Q
Отсюда Q= (3 * 1204):2 = 1803кДж
Ответ: При образовании 120г оксида магния выделится 1803 кДж энергии.
В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
Решение
1) Установим пропорциональные отношения между количеством вещества ацетилена и количеством теплоты.
По уравнению 2 моль C2H2---------- 2610 кДж
По условию х моль ---------- 652,5 кДж
Решаем пропорцию х=(2 * 652,5):2610
2) Определяем массу ацетилена по формуле m= n * M
m = 0,5 моль * 26 г/моль = 13 г.
Ответ: масса сгоревшего ацетилена 13 г.
В результате горения 48 г метана выделилось 2406 кДж теплоты. Составьте термохимическое уравнение этой реакции.
Решение
Запишем уравнение реакции горения метана в общем виде
CH4+ 2O2= CO2+2H2O + Q
2. Определим количество 48 г метана
ν = m / M
ν(CH4) = 48г: 16 г/моль = 3 моль
3. Составляем пропорцию с учетом коэффициентов в уравнении реакции
По условию 3моль CH4 - 2406 кДж
По уравнению 1 моль CH4- Q
Решаем пропорцию Q=(1*2406):3=802кДж
Ответ: термохимическое уравнение реакции горения метана
CH4+ 2O2 = CO2 +2H2O + 802 кДж
Рассчитайте тепловой эффект реакции:
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж),
если ΔH0обр NH3(г) и H2O(ж) равны соответственно -286 и -46 кДж/моль.
Решение
1. O2иN2– простые вещества, следовательно тепловой эффект образования их равен нулю.
2. Согласно следствию из закона Гесса, тепловой эффект реакции равен разности между суммами теплот образования продуктов реакции и теплот образования исходных веществ с учетом стехиометрических коэффициентов:
ΔH0 = 6·(-286) – 4·(-46)=-1532 кДж.
Термохимическое уравнение будет иметь вид
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж)+1532 кДж
Ответ: в результате данной реакции выделится 1532 кДж.
Определить тепловой эффект реакции гидролиза нитрида магния
Mg3N2(тв.) + 6H2O(ж.) = 3Mg(OH)2(тв.) + 2NH3(г.).
Решение
H = Hобр.прод. –Hобр.исх.
Используя справочные данные, находим теплоты образования продуктов и исходных веществ:
H обр. (Mg3N2(тв.)) = –461,5 кДж/моль;
H обр. (Mg(OH)2(тв.)) = –924,66 кДж/моль;
H обр. (H2O(ж.) = –285,77 кДж/моль;
H обр. (NH3(г.) = –46,19 кДж/моль;
Отсюда
H0= [3×(–924,66) + 2×(–46,19)] – [–461,5 + 6×(–285,77)] == –689,86 кДж/моль.
Вычислить стандартную энтальпию реакции:
2C2h5oh(жидк.) c2h5oc2h5(жидк.) h2o(жидк.)
по значениям стандартных энтальпий сгорания веществ: H0сгор.C2H5OH 1368 кДж/моль; H0сгор.C2H5OC2H5 2727 кДж/моль.
Решение
Запишем выражение второго следствия из закона Гесса с учетом того, что стандартная энтальпия сгорания воды равна нулю:
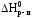 2
2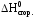 C2H5OH
C2H5OH
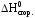 C2H5OC2H5.
C2H5OC2H5.
Подставим значения стандартных
энтальпий сгорания веществ, участвующих
в реакции:
 2(1368)
(2727)9
кДж.
2(1368)
(2727)9
кДж.
Ответ:
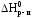 9
кДж.
9
кДж.
При сгорании некоторого количества газообразного углеводорода образовалось 4,48 л оксида углерода (IV) (н.у.) и 3,6 г воды и выделилось 137,5 кДж теплоты. Определите теплоту сгорания углеводорода, если известно, что его плотность по воздуху равна 1,448.
Решение
Определяем простейшую формулу сгоревшего углеводорода:
СхНу + О2→ х СО2+ 0,5у Н2О
ν(СО2) = 4,48 / 22,4 = 0,2 моль;
ν(Н2О) = 3,6/ 18 = 0,2 моль.
ν(С) = 0,2 моль;
ν(Н) = 0,2 · 2 = 0,4 моль.
х :у = 0,2 : 0,4 = 1 : 2. Простейшая формула углеводорода СН2.
Рассчитываем молярную массу и определяем молекулярную формулу углеводорода:
М(СхНу) = Dвоздух · 29 = 1,448 · 29 = 42 г/моль. М(фрагмента СН2) = 14 г/моль
Молекулярная формула углеводорода (СН2)n:
n = М(СхНу) / М(фрагмента СН2) = 42 / 14 = 3.
Углеводород (СН2)3или С3Н6.
Записываем термохимическое уравнение реакции горения углеводорода и определяем теплоту сгорания:
С3Н6(газ) + 4,5 О2(газ) → 3 СО2(газ) + 3 Н2О(ж) + Q(сгорания)
ν(С3Н6) =ν(СО2) / 3 = 0,2 / 3 = 0,0667 моль.
Q(сгорания С2Н6) = Q / ν(С2Н6) = 137,5 / 0,0667 = 2061 кДж/моль.
Ответ: Q(сгорания С2Н6) = 2061 кДж/моль.
При сжигании 9 г органического вещества образовалось 13,2 г оксида углерода(IV) и 5,4 г воды и выделилось 140 кДж теплоты. Определите молекулярную формулу вещества, если его теплота сгорания равна 2800 кДж/моль.
Решение
Судя по продуктам сгорания исходное вещество содержало углерод, водород и,возможно, кислород. Рассчитываем количества образовавшихся веществ, и записываем схему горения:
ν(СО2) = 13,2 / 44 = 0,3 моль.
ν(Н2О) = 5,4 / 18 = 0,3 моль.
СхНуОz + О2→СО2+ Н2О
Рассчитываем количества веществ элементов, входящих в состав исходного вещества и определяем его простейшую формулу:
ν(С) = ν(СО2) = 0,3 моль.
ν(Н) = 2 · ν(Н2О) = 0,3 · 2 = 0,6 моль.
m(O) = m(вещества) – m(С) – m(Н) = 9 – 0,3 · 12 – 0,6 · 1 = 4,8 г.
ν(О) = 4,8 / 16 = 0,3 моль.
х : у : z = 0,3 : 0,6 : 0,3 = 1 : 2 : 1. Простейшая формула вещества СН2О.
Определяем молярную массу вещества и его молекулярную формулу:
ν(исходного вещества) = Q(выделившееся при сгорании взятого количества) :
Q(сгорания) = 140 / 2800 = 0,05 моль.
М(исходного вещества) = 9 / 0,05 = 180 г/моль.
Молекулярная формула (СН2О)n;n = 180 / 30 = 6. С6Н12О6.
Ответ: С6Н12О6.
ТЕСТЫ ПО ТЕМЕ: «ОСНОВЫ ТЕРМОХИМИИ. ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ».
Тест 1
1. При стандартных условиях теплота образования равна 0 для:
а) водорода; б) воды; в) пероксида водорода; г) алюминия.
2. Реакция, уравнение которой N2 + O2 = 2NO – Q, относится к реакциям:
а) эндотермического соединения; б) экзотермического соединения;
в) эндотермического разложения; г) экзотермического разложения.
3. При взаимодействии 10 г натрия с водой выделяется 36,46 кДж теплоты. Какое количество теплоты (в кДж) выделилось, если в результате реакции образовалось 200 г гидроксида натрия?
а) 838; б) 209,5; в) 364,6; г) 419.
4. Эндотермической является реакция:
а) горения водорода; б) разложения воды; в) горения углерода; г) горения метана.
5. Известны тепловые эффекты следующих процессов:
2С2Н2 (г.) + 5О2 (г.) = 4СО (г.) + 2Н2О (ж.) + 2600 кДж,
Н2О (ж.) = Н2О (г.) – 40 кДж.
Какую массу воды (в г), находящейся при температуре кипения, можно испарить за счет теплоты, полученной при полном сгорании 89,6 л (н.у.) ацетилена?
а) 72; б) 1170; в) 2340; г) 4680.
6. Какое определение неверно для данной реакции:
2NaNO3 (тв.) = 2NaNO2 (тв.) + O2 (г.) – Q?
а) гомогенная; б) эндотермическая; в) реакция соединения; г) окислительно-восстановительная.
7. Даны теплоты реакций:
С + 1/2О2 = СО + 110 кДж,
2СО + О2 = 2СО2 + 566 кДж.
Определить теплоту образования углекислого газа из простых веществ (в кДж/моль).
а) 346; б) 786; в) 503; г) 393.
8. Дано термохимическое уравнение:
2SO2 + O2 = 2SO3 + 198 кДж.
В результате реакции выделилось 495 кДж теплоты. Какая масса (в г) сернистого газа прореагировала с кислородом?
а) 160; б) 640; в) 320; г) 320.
9. Теплота сгорания ацетилена – 1300 кДж/моль. Какое количество теплоты (в кДж) выделится при сгорании 1л ацетилена (в пересчете на н.у.)?
а) 58; б) 116; в) 1300; г) 58 000.
10. Основным законом термохимии является закон:
а) Гей-Люссака; б) Гесса; в) Авогадро; г) Пруста.
Ключ к тесту 1 2 3 4 5 6 7 8 9 10
а, г а г б в а, в г в а б
Тест 2
1. При стандартных условиях теплота образования равна 0 для:
а)углекислого газа ;б) железа ;в) пероксида водорода; г) кислорода.
2. Реакция, уравнение которой N2 + 3Н2 = 2NН3 +Q, относится к реакциям:
а) эндотермического соединения; б) экзотермического соединения;
в) эндотермического разложения; г) экзотермического разложения.
3. При соединении 11,16 г железа с серой выделилось 20,06 кДж теплоты. Определить теплоту образования сульфида железа.
а) 838; б) 100; в) 364,6; г) 419.
4. Эндотермической является реакция:
а) горения водорода; б) разложения воды; в) горения углерода; г) горения метана.
5. Известны тепловые эффекты следующих процессов:
2С2Н2 (г.) + 5О2 (г.) = 4СО (г.) + 2Н2О (ж.) + 2600 кДж, Н2О (ж.) = Н2О (г.) – 40 кДж.
Какую массу воды (в г), находящейся при температуре кипения, можно испарить за счет теплоты, полученной при полном сгорании 89,6 л (н.у.) ацетилена?
а) 72; б) 1170; в) 2340; г) 4680.
6. Какое определение неверно для данной реакции:
СaCO3
![]() CaO
+ CO2 – Q.?
CaO
+ CO2 – Q.?
а) гомогенная; б) эндотермическая;
в) реакция соединения; г) окислительно-восстановительная.
7. Вычислить теплоту реакции получения гидроксида кальция из оксида кальция и воды, если теплота образования оксида кальция равна +635,7 кДж/моль, теплота образования воды равна +285,8 кДж/моль, а теплота образования гидроксида кальция равна +986,8 кДж/моль.
а) 65,3; б) 786; в) 503; г) 393.
8. Дано термохимическое уравнение:2SO2 + O2 = 2SO3 + 198 кДж.
В результате реакции выделилось 495 кДж теплоты. Какая масса (в г) сернистого газа прореагировала с кислородом?
а) 160; б) 640; в) 320; г) 320.
9. Термохимическое уравнение
реакции горения метана имеет вид:СН4
(г.) + 2О2 (г.) = СО2
(г.) + 2Н2О (г.),
![]() Н
= –802,2 кДж.
Н
= –802,2 кДж.
Найти, какое количество теплоты выделится при сгорании 44,8 л (н.у.) метана.
а) 1604; б) 116; в) 1300; г) 58 000.
