
Лекция №6
(Буланчук О.Н., каф. физики ПГТУ )
Уравнения Шредингера для атома водорода. Квантовые числа
С момента построения Резерфордом
планетарной модели атома в
1911 г. (а
также при исследовании спектров атомов)
остро встал вопрос обоснования
(объяснения) строения атома и наблюдаемых
спектров. Экспериментальные данные
показывали следующее:
момента построения Резерфордом
планетарной модели атома в
1911 г. (а
также при исследовании спектров атомов)
остро встал вопрос обоснования
(объяснения) строения атома и наблюдаемых
спектров. Экспериментальные данные
показывали следующее:
-
Атом устойчив.
-
Спектр излучения атома представляет собой набор линий (т.е., является линейчастым).
С
точки зрения классической физики
движущийся вокруг ядра с центростремительным
ускорением электрон, теряя энергию,
непрерывно излучает электромагнитные
волны. За время
![]() с
электрон должен упасть на ядро. Спектр
излучения должен быть непрерывным.
с
электрон должен упасть на ядро. Спектр
излучения должен быть непрерывным.
Эта задача оказалась неразрешимой для классической физики. Чтобы как-то исправить ситуацию Нильс Бор предложил два постулата, которые давали возможность выйти из затруднительного положения (без объяснения механизма поведения электрона в атоме).
-
Атом может существовать в стационарных состояниях, для которых момент импульса электрона
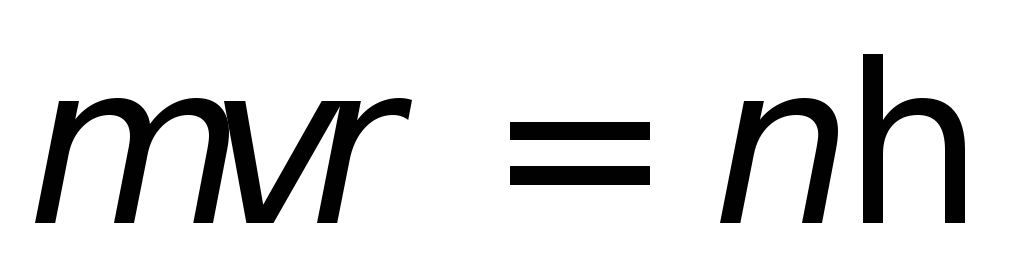 ,
,
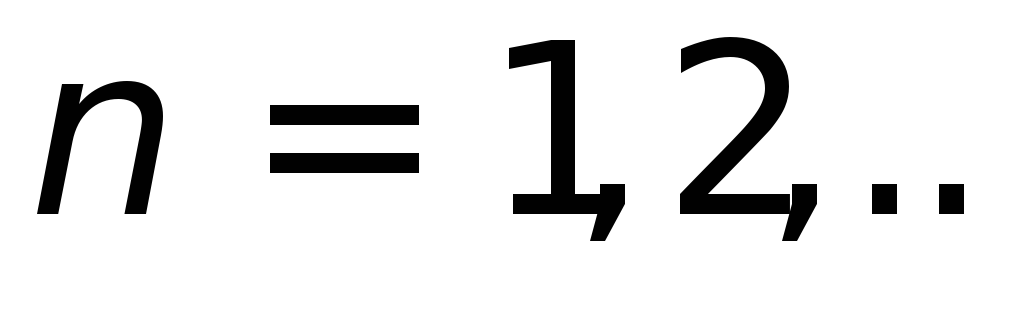 .
Находясь в стационарном состоянии он
не излучает.
.
Находясь в стационарном состоянии он
не излучает. -
Излучение атома происходит при переходе электрона из одного стационарного состояния в другое. Энергия излучаемого кванта равна разности энергий состояний
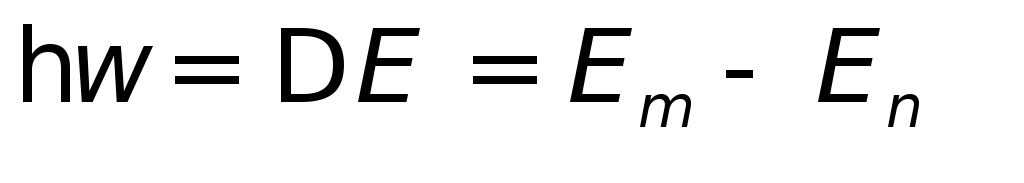 .
.
С точки зрения квантовой механики, для ответа на вопрос о характере движения электрона в атоме необходимо решить уравнение Шредингера. Поскольку атом считается изолированным, то можно сразу записать стационарное уравнение Шредингера
![]()
Потенциальная энергия электрона в поле ядра с зарядом Ze
![]()
З ависимость
ависимость
![]() только от
только от
![]() означает,
что задача имеет сферическую симметрию.
В этом случае рационально перейти к
сферической системе координат
означает,
что задача имеет сферическую симметрию.
В этом случае рационально перейти к
сферической системе координат
![]() .
Это значит,
что волновая функция будет зависеть от
сферических координат:
.
Это значит,
что волновая функция будет зависеть от
сферических координат:![]()
Рассмотрение
оператора Лапласа
![]() в сферической системе координат не
входит в данный курс. Таким образом,
уравнение Шредингера для атома водорода
(или водородоподобного атома) имеет
вид:
в сферической системе координат не
входит в данный курс. Таким образом,
уравнение Шредингера для атома водорода
(или водородоподобного атома) имеет
вид:
![]()
Непосредственное решение виду его сложности, не предусмотрено программой. Следует отметить, что является одним из немногих уравнений квантовой механики для которого удается найти точное решение. Анализ этого решения позволяет сделать следующие выводы:
-
В
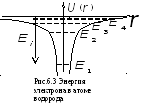 случае
случае
 происходит рассеяние электрона на ядре
и энергетический спектр электрона
непрерывный.
происходит рассеяние электрона на ядре
и энергетический спектр электрона
непрерывный. -
Уравнение имеет локализованные (вблизи ядра) решения при
 .
Энергетический спектр при
.
Энергетический спектр при
 дискретен:
дискретен:
![]()
![]() – главное квантовое
число. Экспериментальное подтверждение
квантование энергетических уровней в
атоме нашло в опытах Франка и Герца.
Энергетический уровень с
– главное квантовое
число. Экспериментальное подтверждение
квантование энергетических уровней в
атоме нашло в опытах Франка и Герца.
Энергетический уровень с
![]() называется основным, уровни с
называется основным, уровни с
![]() называются возбужденными.
называются возбужденными.
При
![]() (атом
водорода)
(атом
водорода)
![]() эВ
эВ
Если электрону
сообщить энергию
![]() ,
то
,
то
![]() и он станет свободным, т. е. произойдет
ионизация атома. Минимальная энергия,
которая необходима для вырывания
электрона из атома называется энергией
ионизации
и он станет свободным, т. е. произойдет
ионизация атома. Минимальная энергия,
которая необходима для вырывания
электрона из атома называется энергией
ионизации
![]() .
Ионизация может происходить за счет
следующих механизмов:
.
Ионизация может происходить за счет
следующих механизмов:
-
Нагрева вещества (термическая ионизация происходит за счет кинетической энергии сталкивающихся частиц).
-
Бомбардировки атомов элементарными частицами (ударная ионизация).
-
Под воздействием электромагнитного излучения: фотоионизация. Интересным направлением использования фотоионизации является ее применение в работе ионных двигателях, которые используются для космических аппаратов. Принцип работы ионного двигателя базируется на том, инертный газ (ксенон) вначале ионизируется микроволновым излучением, затем поступает между двух вытянутых металлических пластин, где он ускоряется напряжение в 6кВ. Скорость истечения плазмы составляет от 60 до 80 тысяч метров в секунду. На данный момент мощность такого двигателя составила 12 кВт (в перспективе до 25 кВт). Удельный импульс такого двигателя составляет 6000 с, что существенно выше, чем у двигателей установленных сейчас на шаттлах (460 с). Удельный импульс горючего показывает, сколько времени при помощи 1 кг горючего, сгорающего в двигателе, можно поддерживать силу тяги, равную весу этого горючего.
Решение имеет довольно громоздкий вид
![]()
где
![]() - радиальная составляющая волновой
функции,
- радиальная составляющая волновой
функции,
![]() —сферические
функции,
—сферические
функции,
![]() —присоединенные
полиномы Лежандра.
—присоединенные
полиномы Лежандра.
Пример:
при
![]()
![]() ,
,
![]() ,
,
![]()
![]() м
— радиус
Бора
м
— радиус
Бора
![]()
![]()
Вероятность
обнаружения электрона в элементе объема
сферической системы координат
![]() равна:
равна:
![]()
Вероятность
обнаружения электрона в сферическом
слое толщиной
![]() на
расстоянии
на
расстоянии
![]()
![]() ,
,
где
![]() —
плотность вероятности найти частицу
на расстоянии
—
плотность вероятности найти частицу
на расстоянии
![]() .
Поскольку
.
Поскольку
![]() ,
то
,
то
![]() .
Например, для основного состояния:
.
Например, для основного состояния:
![]()
![]()
![]()
Для обозначения состояния электрона в атоме применяют следующее правило:
Электроны с одинаковыми главными квантовыми числами формируют оболочки:
![]() —оболочка,
—оболочка,
![]() —оболочка,
—оболочка,
![]() —оболочка,
—оболочка,
![]() —оболочка
и т.д.
—оболочка
и т.д.
Электроны с
одинаковыми орбитальными квантовыми
числами объединяют в подоболочки:
![]() подоболочка ,
подоболочка ,
![]() подоболочка ,
подоболочка ,
![]() подоболочка
подоболочка
![]() подоболочка
подоболочка
![]() —подоболочка,
—подоболочка,
![]() подоболочка
подоболочка
![]() подоболочка.
подоболочка.
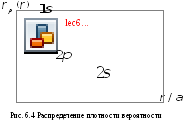
Из Рис.6.4 видно,
что при меньших n
вероятность обнаружить электрон ближе
к ядру больше. Кроме того, существует
ненулевая вероятность найти электрон
внутри ядра (точно в центре ядра
![]() ).
Хотя при больших n
вероятность обнаружить электрон в
непосредственной близости от ядра мала,
но все же она не равна нулю. Из вида
волновой функции также следует, что
существует ненулевая вероятность найти
электрон даже на очень больших расстояниях
от ядра. Таким образом, представления
об атоме, как уменьшенной копии планетарной
системы оказывается неправильным.
).
Хотя при больших n
вероятность обнаружить электрон в
непосредственной близости от ядра мала,
но все же она не равна нулю. Из вида
волновой функции также следует, что
существует ненулевая вероятность найти
электрон даже на очень больших расстояниях
от ядра. Таким образом, представления
об атоме, как уменьшенной копии планетарной
системы оказывается неправильным.
Х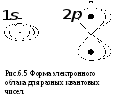 арактерное
время движения электрона вокруг ядра
арактерное
время движения электрона вокруг ядра
![]() .
Это означает, что для промежутков времени
.
Это означает, что для промежутков времени
![]() электрон создает вокруг ядра электронное
облако, которое экранирует заряд ядра.
Это приводит к тому, что потенциал атома
убывает более быстро
электрон создает вокруг ядра электронное
облако, которое экранирует заряд ядра.
Это приводит к тому, что потенциал атома
убывает более быстро
![]() (для основного состояния), чем потенциал
поля диполя (
(для основного состояния), чем потенциал
поля диполя (![]() ).
Эффект экранирования ядра влияет на
порядок заполнения электронами оболочек
и характеристическое рентгеновское
излучение. Геометрическая форма и размер
электронного облака задаются
).
Эффект экранирования ядра влияет на
порядок заполнения электронами оболочек
и характеристическое рентгеновское
излучение. Геометрическая форма и размер
электронного облака задаются
![]() и
и
![]() (Рис.6.5).
А его ориентация в пространстве
определяется магнитным квантовым числом
(Рис.6.5).
А его ориентация в пространстве
определяется магнитным квантовым числом
![]() .
.
Квантовые числа не только определяют форму и ориентацию электронного облака в пространстве, но также позволяют рассчитывать значения следующих физических величин:
-
Орбитальное квантовое число l определяет модуль орбитального момента импульса
![]()
Таким образом, при
заданном значении
![]() возможны
возможны
![]() различных значений моментов импульсов.
Например: при
различных значений моментов импульсов.
Например: при ![]() ,
при
,
при
![]()
-
М
 агнитное
квантовое число
агнитное
квантовое число
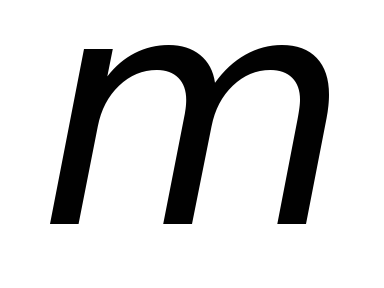 определяет проекцию орбитального
момента импульса на выделенное
направление (задаваемое внешним полем).
определяет проекцию орбитального
момента импульса на выделенное
направление (задаваемое внешним полем).
![]()
![]()
![]()
Вывод: при заданном
![]()
![]() может принимать
может принимать
![]() значений.
значений.
Квантование проекции момента импульса (Рис.6.6) на выделенное направление получило название пространственного квантования. Это означает (в соответствии с классической аналогией), что орбита электрона не может быть ориентирована в пространстве произвольным образом, а возможны только определенные направления момента импульса.
Замечание 1:
необычной выглядит ситуация существования
такого состояния, когда
![]() .
В классической механике это возможно,
если орбита имеет форму восьмерки (или
проходит через центр атома). Это означает,
что существует такое состояние электрона
в котором он не имеет момента импульса,
связанного с движением по орбите.
.
В классической механике это возможно,
если орбита имеет форму восьмерки (или
проходит через центр атома). Это означает,
что существует такое состояние электрона
в котором он не имеет момента импульса,
связанного с движением по орбите.
Замечание 2:
Если одному и тому же значению
![]() соответствуют различные волновые
функции, то в этом случае говорят, что
уровень с энергией
соответствуют различные волновые
функции, то в этом случае говорят, что
уровень с энергией
![]() вырожден.
Число волновых функций определяет
кратность
вырождения уровня
с энергией
вырожден.
Число волновых функций определяет
кратность
вырождения уровня
с энергией
![]() .
В данном случае
.
В данном случае
![]()
Таким образом,
имеет место вырождение по квантовым
числам
![]() .
Вырождение по
.
Вырождение по
![]() связано с кулоновским характером
взаимодействия между электроном и
ядром (
связано с кулоновским характером
взаимодействия между электроном и
ядром (![]() ).
).
