
- •Вопрос№1. Предмет и методы химии как науки. Химизация сельского хозяйства.
- •Вопрос№2. Закон сохранения массы вещества м.В. Ломоносова. Закон взаимосвязи массы и энергии а. Эйнштейна. Закон постоянства состава.
- •Вопрос№3. Эквивалент. Закон эквивалентов. Использование эквивалентов веществ в объемном анализе.
- •Вопрос№4. Основные положения атомно-молекулярного учения. Атом. Молекула. Относительный атомная и молекулярная массы. Моль. Молярная масса.
- •Вопрос№5. Закон Авогадро. Молярный объем газа. Относительная плотность газа.
- •Вопрос№6. Корпускулярно-волновой дуализм электрона. Электронная орбиталь.
- •Вопрос№7. Квантовые числа. Правило заполнения электронами энергетических уровней и подуровней. Принц Паули, правило Хунда, принцип наименьшей энергии.
- •Вопрос№8. Электронные структуры и электронные формулы атомов.
- •Вопрос№9. Строение атомных ядер. Изотопы. Применение изотопов в биологии.
- •Вопрос№10. Свойства атомов. Энергия ионизации, сродство к электрону, электроотрицательность, радиус. Их значение для характеристики свойств элементов.
- •Вопрос№11. Химическая связь, её основные характеристики: длина, валентный угол, энергия и полярность.
- •Вопрос№12. Ковалентная связь. Два способа её образования. Свойства ковалентной связи. Направленность и насыщаемость связи. Сигма и Пи связи.
- •Вопрос№13. Гибридизация атомных орбиталей и строение молекул.
- •Вопрос№14. Полярная и неполярная ковалентная связь. Дипольный момент связи молекулы.
- •Вопрос№15. Валентность и степень окисления.
- •Вопрос№16. Ионная связь. Её образование и свойства. Структура ионных соединений.
- •Вопрос№17. Водородная связь, её природа. Биологическая роль водородной связи.
- •Вопрос№18. Межмолекулярное взаимодействие. Его природа. Роль для биологических объектов.
- •Вопрос№19. Периодический закон д.И. Менделеева, его физическая сущность.
- •Вопрос№20. Периодичность в изменении радиусов, энергии ионизации, сродства к электрону и электроотрицательность по периодам и группам.
- •Вопрос№21. Структура периодической системы. Период, группа, семейства элементов.
- •Вопрос№22. Общенаучное и философское значение периодического закона.
- •Вопрос№23. Комплексные соединения. Комплексообразователь, лиганды, координационное число, внутренняя и внешняя сферы комплекса. Константа нестойкости. Биологическая роль комплексных соединений.
- •Вопрос№25. Скорость химических реакций. Факторы, влияющие на скорость химической реакции.
- •Вопрос№26. Закон действия масс. Константа скорости. Энергия активации.
- •Вопрос№27. Обратимые и необратимые реакции. Химическое равновесие, константа равновесия. Принцип Ле Шателье.
- •Вопрос№28. Катализ. Катализаторы и ингибиторы. Ферменты. Каталитические процессы в живых организмах.
- •Вопрос№29. Оксиды, гидроксиды и соли как важнейшие класса неорганических соединений. Их классификация, способы получения и химические свойства.
- •Вопрос№30. Вода. Строение молекулы. Свойства воды. Роль воды в биологических объектах.
- •Вопрос№31. Растворы. Их характеристика. Гидратная теория растворов. Сольваты и гидраты, кристаллогидраты. Роль водных растворов в биологических системах.
- •Вопрос№32. Способы выражения концентраций растворов.
- •Вопрос№33. Теория электролитической диссоциации. Электролиты и неэлектролиты. Степень диссоциации. Сильные и слабые электролиты. Константа диссоциации.
- •Вопрос№34. Кислоты, основания и соли в свете теории электролитической диссоциации.
- •Вопрос№35. Электролитическая диссоциация воды. Ионное произведение воды.
- •Вопрос№36. Водородный показатель среды. Значение рН для работы биологических систем.
- •Вопрос№37. Произведение растворимости.
- •Вопрос№38. Гидролиз солей. Типичные случаи гидролиза. Константа и степень гидролиза.
- •Вопрос№39. Хлор. Распространение в природе. Получение, физические и химические свойства.
- •Вопрос№40. Хлороводород. Соляная кислота. Получение и свойства. Хлориды, их роль в живом организме.
- •Вопрос№41. Фтор. Получение. Свойства. Фтороводород. Плавиковая кислота, ее свойства. Фториды. Биологическая роль фтора.
- •Вопрос№42. Кислород. Получение, свойства, биологическое значение. Применение.
- •Вопрос№43. Озон. Получение. Свойства. Применение. Перекись водорода. Применение в ветеринарии.
- •Вопрос№44. Сера. Распространение в природе, свойства. Применение в с/х.
- •Вопрос№45. Сернистый ангидрид, его получение, свойства, применение. Восстановительные свойства сернистого ангидрида. Сернистая кислота и сульфиты.
- •Вопрос№47. Азот в природе. Свойства, получение, применение. Соединения азота с металлами (нитриды). Азот как органогенный элемент.
- •Вопрос№49. Кислородные соединения азота. Общая характеристика его оксидов. Азотистая кислота и нитриты. Их физиологическая активность.
- •Вопрос№50. Свойства и методы получения азотной кислоты. Взаимодействие азотной кислоты с металлами и неметаллами. Азотные удобрения – селитры.
- •Вопрос№51. Фосфор, его природные соединения (фосфориты и апатиты). Свойства фосфора, его аллотропические видоизменения. Биологическая роль фосфора.
- •Вопрос№52. Фосфорный ангидрид. Фосфорные кислоты и их соли (фосфаты и гидрофосфаты). Значение соединений фосфора в с/х-ве. Фосфорные удобрения.
- •Вопрос№53. Углерод. Аллотропические видоизменения углерода. Поглотительные свойства угля (адсорбция). Углерод как органный элемент.
- •Вопрос№54. Кислородные соединения углерода. Угольная кислота и её соли. Карбонаты, их роль в организме.
- •Вопрос№55. Кремний распространение в природе. Важнейшие минералы и горные породы, содержащие кремний (силикаты).
- •Вопрос№56. Кремниевый ангидрид. Кремниевая кислота и её соли. Их значение.
- •Химические свойства
- •Медь и её соединения Получение
- •Химические свойства
- •Вопрос№58. Магний. Оксид и гидроксид магния. Применение солей магния в ветеринарии. Ион магния как биогенный элемент.
- •Вопрос№59. Хром. Общая характеристика. Амфотерность гидроксида. Токсичность соединений хрома. Биологическое значение хрома.
- •Вопрос№60. Марганец. Общая характеристика. Свойства оксидов и гидроксидов марганца. Перманганаты. Марганец как биогенный элемент.
- •Вопрос№61. Семейство железа. Общая характеристика, свойства простых веществ и их соединений. Комплексные соединения. Гемоглобин. Железо и кобальт как биогенные элементы.
- •Вопрос№62. Цинк. Общая характеристика. Амфотерность гидроксида. Комплексные соединения. Ферменты. Применение в животноводстве.
- •Вопрос№63. Ртуть. Свойства ртути и ее соединений. Соединения ртути как лекарственные препараты.
- •Вопрос№64. Кальций, характеристика свойств его и его важнейших соединений. Биологическая роль их в жизнедеятельности организмов. Хлорная известь как дезинфицирующее вещество.
- •Вопрос№65. Жесткость воды, ее влияние на живые организмы. Методы ее устранения.
- •Вопрос№66. Бор. Борная кислота. Биоорганические соединения. Применение соединений бора в животноводстве.
- •Вопрос№67. Алюминий. Общая характеристика свойств важнейших соединений, Квасцы. Применение в ветеринарии.
- •Вопрос№69. Щелочные металлы. Общая характеристика, свойства оксидов и гидроксидов. Роль элементов в жизнедеятельности живых организмов. Применение в сельском хозяйстве.
Вопрос№13. Гибридизация атомных орбиталей и строение молекул.
sp-Гибридизация - это гибридизация, в которой участвуют атомные орбитали одного s- и одного p-электронов (рис. 1).
![]()
Рис. 1. Образование sp-гибридных орбиталей
В процессе гибридизации образуются 2 гибридные орбитали, которые ориентируются друг к другу под углом 180° (рис. 2).
![]()
Рис. 2. Модель атома с sp-гибридными орбиталями.
Пространственная конфигурация молекулы, центральный атом которой включает sp-гибридные орбитали, представлено на рис. 3.

Рис. 3. Пространственная конфигурация молекулы, центральный атом которой включает sp-гибридные орбитали.
Представление о sp-гибридизации орбиталей можно применить для объяснения линейной формы, например, молекулы BeH2, в которой атом бериллия образован гибридными sp-орбиталями. Модель этой молекулы показана на рис. 4.
![]()
Рис. 4. Модель молекулы BeH2
sp2-Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и двух p-электронов (рис. 1).
![]()
Рис. 1. Образование sp2-гибридных орбиталей
В результате гибридизации образуются три гибридные sp2 орбитали, расположенные в одной плоскости под углом 120° друг к другу (рис. 2).

Рис. 2. Модель атома с sp2-гибридными орбиталями
Пространственная конфигурация молекулы, центральный атом которой включает в себя sp2-гибридные орбитали, представлена на рис. 3.
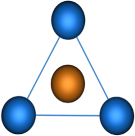
Рис. 3. Пространственная конфигурация молекулы, центральный атом которой включает в себя sp2-гибридные орбитали
Этот тип гибридизации наблюдается, например в молекуле BCl3. Модель этой молекулы изображена на рис. 4.
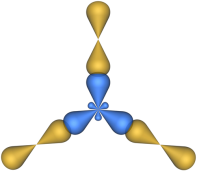
Рис. 4. Модель молекулы BCl3
sp3-Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов (рис. 1).
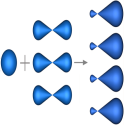
Рис. 1. Образование sp3-гибридных орбиталей
Четыре sp3-гибридные орбитали симметрично ориентированны в пространстве под углом 109°28' (рис. 2).
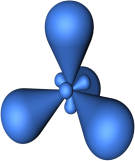
Рис. 2. Модель атома с sp3-гибридными орбиталями
Пространственная конфигурация молекулы, центральный атом которой образован sp3-гибридными орбиталями – тетраэдр (рис. 3).
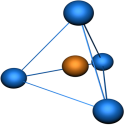
Рис. 3. Тетраэдрическая пространственная конфигурация молекулы, центральный атом которой образован sp3-гибридными орбиталями
На рис. 4 представлена
модель молекулы метана (CH4), в которой
атом углерода подвергается sp3-гибридизации.
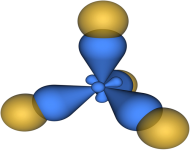
Рис. 4. Модель молекулы CH4
Вопрос№14. Полярная и неполярная ковалентная связь. Дипольный момент связи молекулы.
Различают две разновидности ковалентной связи: полярную и неполярную.
Полярная ковалентная связь образуется между атомами разных элементов с различной относительной электроотрицательностью. В этом случае электронное облако смещается в сторону более электроотрицательного атома. Пример
HCl, H2O, H2S, NH3.
Образование молекулы хлороводорода HCl можно представить схемой:
Электронная пара смещена в сторону хлора, так как относительная электроотрицательность атома хлора больше, чем атома водорода.
Неполярная ковалентная связь образуется между атомами одного и того же элемента. Пример
H2, O2, Cl2
Образование молекулы хлора Cl2:
