
Медична хімія. Методичні вказівки 3 заняття
.doc
Тема 3. Способи вираження кількісного складу розчинів
1.Актуальність теми
Розчинами є плазма крові, слина, шлунковий сік, сеча та інші рідини людського організму. З утворенням розчинів пов’язані процеси засвоєння їжі та виведення із організму продуктів життєдіяльності. У формі розчинів у організм вводиться багато лікарських препаратів. Тому лікареві необхідні знання про величини, що характеризують кількісний склад розчинів.
2. Конкретні цілі
Вміти характеризувати кількісний склад розчинів.
3. Базові знання, вміння, навички, необхідні для вивчення теми
Знати склад розчинів та величини, що характеризують їх кількісний склад .
Вміти розраховувати кількість розчиненої речовини у розчині певної концентрації.
4.Завдання для самостійної роботи під час підготовки до заняття
4.1. Теоретичні питання до заняття:
-
Склад розчинів.
-
Класифікація розчинів.
-
Величини, що характеризують кількісний склад розчинів.
3.1. Масова, об’ємна та молярна частки.
3.2. Молярна концентрація.
3.3. Молярна концентрація еквівалента (деци-, санти-, мілі- та
мікромолі).
3.4. Моляльна концентрація.
3.5. Титр.
4.2. Завдання, що виконується студентами на занятті
Задача № 1.
У воді об’ємом 0,2 л розчинили сіль масою 0,04 кг. Визначити масову частку солі в розчині, якщо густина води дорівнює 1 кг/л.
Задача № 2.
Визначити масу розчину з масовою часткою СuSО4 10% і масу води, що необхідні для приготування розчину масою 0,5 кг з масовою часткою СuSО4 2%.
Задача № 3.
Визначити молярну концентрацію розчину з масовою часткою натрій гідроксиду 0,2. Густина розчину – 1,29 кг/л
Задача № 4.
Визначити молярну концентрацію еквівалента розчину, утвореного при
розчиненні 0,0426 кг натрій сульфату в 0,3 кг води, якщо густина розчину дорівнює 1,12 кг/л.
Задача № 5.
Визначити моляльну концентрацію розчину калій хлориду, якщо 0,5 кг розчину містить 0,05 кг солі.
Матеріали для самоконтролю
Задача № 1.
У 1л плазми крові міститься 0,142 моль катіонів Натрію. Визначити титр плазми по катіону Натрію.
Задача № 2.
Водний розчин, одержаний розчиненням глюкози (М = 180 г/моль) у 95г води, є ізотонічним плазмі крові. Визначити масову та молярну частки глюкози в розчині.
Задача № 3.
Титр розчину кальцій хлориду (М= 111г/моль), що використовується в медичній практиці при алергічних, шкірних та інших захворюваннях, дорівнює 0,0999 г/мл. Розрахувати молярну концентрацію та молярну концентрацію еквівалента кальцій хлориду в розчині.
Задача № 4.
Визначити моляльну концентрацію 0,85% NaCl.
Правильні відповіді
Задача № 1.
Титр (Т) означає масу розчиненої речовини, що міститься в 1 мл розчину. Масу частіше виражають у грамах (г).
Отже, маємо:
![]()
![]()
![]()
де m (Na+) – маса катіонів Натрію, г,
V (розчину) – об’єм розчину, мл,
ν (Na+) – кількість речовини катіонів Натрію, моль,
М (Na+) – молярна маса катіону Натрію, г/моль.
![]()
![]()
Задача № 2.
Масова частка (ω) – це відношення маси компоненту (розчиненої речовини) до загальної маси системи (розчину, суміші). Це безрозмірна величина, що виражається частками одиниці, відсотками (частки сотні) тощо.
![]()
Мольна частка ( χ ) – це відношення кількості розчиненої речовини (7ν речовини) до загальної кількості розчину (ν розчину). Вона має таку ж розмірність, як і масова частка.

Задача № 3.
Молярна концентрація речовини, що позначається С, – це відношення кількості речовини ν до об’єму розчину V. Молярна концентрація виражається в моль/л.
![]()
де ν – кількість речовини СаСl2 , моль,
Vрозчину – об’єм розчину, л.
Якщо Т(СаСl2) = 0,0999 г/мл = 0,0999 кг/л, то в 1 л розчину маємо 0,0999 кг солі.

Молярна концентрація еквівалента речовини, що позначається як Секв , – це відношення кількості речовини еквівалента νекв дo об’єму розчину.
Молярна концентрація еквівалента виражається в моль/л.

де νекв – кількість речовини еквівалента, моль,
V – об’єм розчину, л.
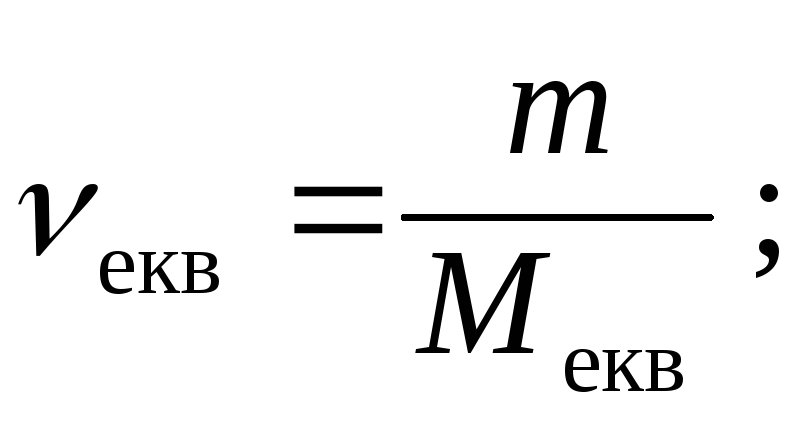
М екв = М . f екв ;
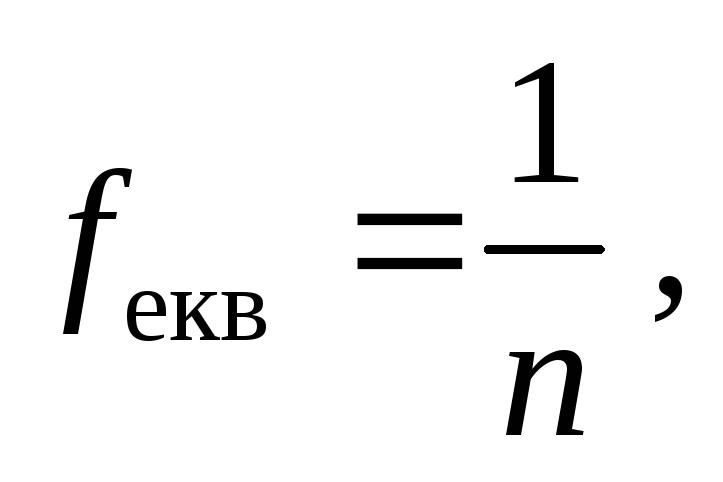
де n – число йонів Н+ у молекулі кислоти,
або гідроксид-іонів ОН- у молекулі основи,
або добуток валентності металу на кількість атомів металу в молекулі солі.
Еквівалент – це така частина речовини (реальна або умовна), що в реакції еквівалентна (відповідає) одному молю атомів Гідрогену (катіонів), або в окисно-відновних реакціях – одному електрону.
![]()
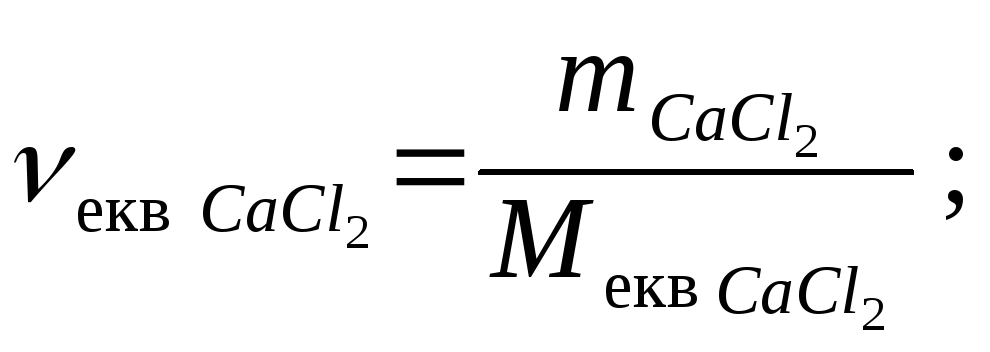
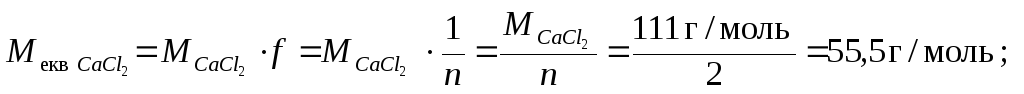
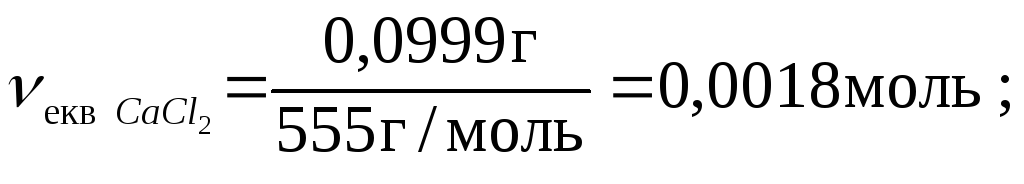
![]()
Задача № 4.
Моляльна концентрація речовини, що позначається Сm є відношенням кількості речовини до маси розчинника.
![]()
де ν – кількість речовини, моль,
m – маса розчинника, кг.
0,85% розчин містить 0,85 г солі у 100 г розчину.
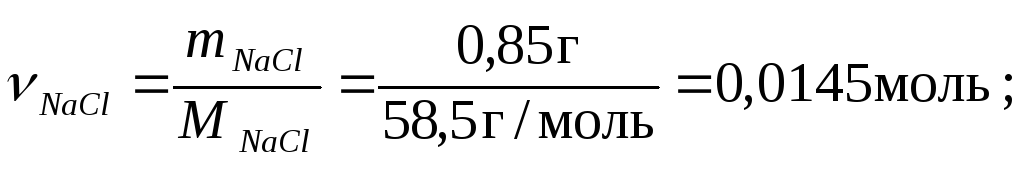
![]()
![]()
Список рекомендованої літератури
-
Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця: Нова книга, 2006. – 775с.
-
Калибабчук В.А., Грищенко Л.И., Галинская В.И., Гождзинский С.М., Овсянникова Т.А., Самарский В.А. Медицинская химия. – Киев: Медицина, 2008. – 400с.
-
Садовничая Л.П., Хухрянский В.Г., Цыганенко А.Я. Биофизическая химия. – К.: Вища школа, 1986. – 272с.
