
Ответы на экзамен
.pdf1. Ферменты: определение понятия, химическая природа, физико-химические свойства и биологическая роль ферментов.
Ферменты - это белки, которые действуют как катализаторы в биологических системах.
Химическая природа: белки.
Физико-химические свойства:
1)являются амфотерными соединениями;
2)вступают в те же качественные реакции, что и белки (биуретовую, ксантопротеиновую, фолина и др.);
3)подобно белкам растворяются в воде с образованием коллоидных растворов;
4)обладают электрофоретической активностью;
5)гидролизуются до аминокислот;
6)склонны к денатурации под влиянием тех же факторов: температуры, изменениях рН, действием солей тяжелых металлов, действием физических факторов (ультразвук, ионизирующее излучение и др.);
7)имеют несколько уровней организации макромолекул, что подтверждено данными рентгеноструктурного анализа, ЯМР, ЭПР
Биологическая роль: Ферменты катализируют контролируемое протекание всех метаболических процессов в организме.
2. Изоферменты. Строение, биологическая роль, диагностическое значение определения, изменение в онтогенезе и при патологии органа, диагностическое значение.
Изоферменты – это множественные формы одного фермента, катализирующие одну и ту же реакцию, но отличающие по физическим и химическим свойствам.
Строение: Четвертичная структура, образованная четным количеством субъединиц (2, 4, 6 и т.д.). Изоформы фермента образуются в результате различных комбинаций субъединиц.
Биологическая роль: Существование изоформ повышает адаптационную возможность тканей, органов, организма в целом к меняющимся условиям.
Диагностическое значение определения: По изменению изоферментного состава оценивают метаболическое состояние органов и тканей.
1
Изменение в онтогенезе: На примере ЛДГ (окисляет лактат до ПВК). В процессе индивидуального развития организма в тканях происходит изменение содержания кислорода и изоформ ЛДГ. У зародыша преобладают ЛДГ4, ЛДГ5. После рождения в некоторых тканях происходит увеличение содержания ЛДГ1, ЛДГ2.
Изменения при патологии органа: На примере ЛДГ. ЛДГ1,2 работают в миокарде. Если в миокард не будет поступать кислород, там увеличится количество анаэробных субъединиц – ЛДГ4,5, что свидетельствует о патологии органа.
Диагностическое значение:
ЛДГ – при увеличении активности ЛДГ в плазме крови можно предположить повреждение одной из тканей организма (сердце, мышцы, печень). (В норме
170-520 ЕД/л)
КК – (катализируют превращение кретина в креатинфосфат); определяют активность КК в плазме крови. В норме – 90 МЕ/л. Повышение ММ – травма мышц, ВВ – в крови не определяется даже при инсультах, т.к. не может проникнуть в кровь.
3.Особенности ферментативного катализа. Механизм, стадии
ферментативного катализа.
Особенности:
Сходство ферментов и |
Отличие ферментов от неорганических |
неорганических |
катализаторов |
катализаторов |
|
|
|
1. Ускоряют только |
1. Для ферментов характерна высокая |
термодинамически |
специфичность: |
возможные реакции |
• субстратная специфичность: |
|
▪ абсолютная (1 фермент - 1 субстрат), |
|
▪ групповая (1 фермент – несколько похожих |
|
субстратов) |
|
▪ стереоспецифичность (ферменты работают с |
|
субстратами только определенного стереоряда |
|
L или D). |
|
• каталитическая специфичность |
|
(ферменты катализируют реакции |
|
преимущественно одного из типов химических |
|
реакций – гидролиза, окисления- |
|
|
2
|
восстановления и др) |
|
|
2. Не изменяют состояние |
2. Высокая эффективность действия: ферменты |
равновесия реакций, а |
ускоряют реакции в108-1014 раз. |
только ускоряют его |
|
достижение. |
|
|
|
3. В реакциях не |
3. Ферменты действуют только в мягких |
расходуются |
условиях (t = 36-37ºС, рН ~ 7,4, атмосферное |
|
давление), т.к. они обладают |
|
конформационной лабильностью – |
|
способностью к изменению конформации |
|
молекулы под действием денатурирующих |
|
агентов (рН, Т, химические вещества). |
|
|
4. Действуют в малых |
4. В организме действие ферментов |
количествах |
регулируется специфически (катализаторы |
|
только неспецифически) |
|
|
5. Чувствительны к |
5. Широкий диапазон действия (большинство |
активаторам и ингибиторам |
процессов в организме катализируют |
|
ферменты). |
|
|
Механизм ферментативного катализа: Химические реакции протекают согласно закону сохранения энергии и закону энтропии: общая энергия химической системы и ее окружения – постоянна. Для снижения энергии активации необходимо увеличить скорость реакции. Для этого в организме имеются ферменты.
1)Сближение и ориентация – активный центр фермента связывается с субстратом
2)Напряжение и деформация субстрата - «эффект дыбы», растягивание субстрата, индукция соответствия S и Е.
3)Кислотно-основной катализ – присутствие в активном центре фермента СООН – групп и NН – гр., способных присоединять и отдавать протоны.
4)Ковалентный катализ – образование ковалентной связи между ферментом и субстратом.
Стадии ферментативного катализа:
Формирование фермент-субстратного комплекса.
1)АВ + Е – связывание субстрата с ферментом
2)(А:В)Е – образование фермент-субстратного комплекса -> активация фермент – субстратного комплекса
3)(А+В)Е – образование фермент-продуктного комполекса
3
4)А+В+Е – образование продуктов реакции -> отделение продуктов реакции от фермент – субстратного комплекса
4.Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от температуры, рН, концентрации
субстрата, концентрации энзима.
Кинетика ферментативных реакций – раздел энзимологии, изучающий зависимость скорости химических реакций, катализируемых ферментами, от химической природы реагирующих веществ, а также от факторов окружающей среды.
Зависимость скорости ферментативных реакций от: |
|||||||
|
Температуры: |
|
|
|
|
||
|
V |
|
|
|
|
|
|
|
0 |
10 |
20 |
30 |
40 |
50 |
60 T |
Имеется температурный оптимум. Для большинства одинаковый. Есть термостабильные ферменты. Выдерживают температуру до 95° и выше.
pH:
V |
|
|
|
|
|
|
|
|
|
|
|
|
pH |
0 |
4 |
5 |
6 |
7 |
8 |
9 |
|
Оптимум pH для каждого фермента свой. |
|||||
Концентрации субстрата:
4
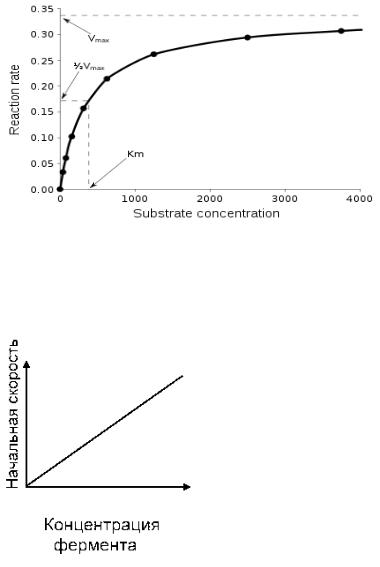
Скорость повышается до полного насыщения фермента субстратом. Далее скорость не увеичивается.
Концентрации энзима:
5. Ингибирование активности ферментов, виды ингибирования: обратимое, необратимое, конкурентное, неконкурентное
Ингибирование активности ферментов – снижение каталитической активности в присутствии определенных веществ – ингибиторов.
Виды ингибирования:
1)Обратимое:
a)Конкурентное
b)Неконкурентное
2)Необратимое
Обратимое ингибирование:
Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и могут легко отделяться от него.
5
Конкурентное: ингибитор связывается с активным центром фермента и препятствует образованию фермент-субстратного комплекса. Пример: малоновая кислота ингибирует сукцинатдегидрогеназную реакцию, являясь структурным аналогом сукцината. Конкурентные ингибиторы используют как лекарственные средства.
Неконкурентное: ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Образует неактивный комплекс, связываясь с ферментом или фермент-субстратным комплексом.
Необратимое ингибирование:
Образование ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего изменяется активный центр фермента. Примеры: ионы тяжелых металлов. Имеются специфичные и неспецифичные ингибиторы. Используются как лекарственные вещества.
6. Регуляция активности ферментов: неспецифическая, специфическая (понятия). Механизмы специфической регуляции активности ферментов
Регуляция активности ферментов:
Неспецифическая:
a)Изменением доступности субстрата и коферментов.
b)Изменением количества молекул субстрата.
c)Изменением каталитической активности ферментов.
i)Аллостерическая регуляция: регуляция происходит количеством не только молекул субстрата, но и эффекторов. Эффекторы – клеточные метаболиты, чаще всего, того пути, регуляцию которого они осуществляют.
ii)Регуляция с помощью белок-белковых взаимодействий: регуляция путем присоединения регуляторных белков (пример: аденилатциклазная система); изменение каталитической активности ферментов вследствие ассоциации и диссоциации протомеров фермента (присоединение остатка фосфорной кислоты с АТФ на белок).
iii)Регуляция путем фосфорилирования/дефосфорилирования молекулы фермента (к ОН-группе).
6
iv)Регуляция частичным (ограниченным) протеолизом: отщепление части молекулы неактивного предшественника.
Специфическая:
a)Обратимое ингибирование: Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и могут легко отделяться от него.
i)Конкурентное: ингибитор связывается с активным центром фермента и препятствует образованию фермент-субстратного комплекса. Пример: малоновая кислота ингибирует сукцинатдегидрогеназную реакцию, являясь структурным аналогом сукцината. Конкурентные ингибиторы используют как лекарственные средства.
ii)Неконкурентное: ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Образует неактивный комплекс, связываясь с ферментом или фермент-субстратным комплексом.
b)Необратимое ингибирование: Образование ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего изменяется активный центр фермента. Примеры: ионы тяжелых металлов. Имеются специфичные и неспецифичные ингибиторы. Используются как лекарственные вещества.
7.Роль гормонов и вторичных мессенджеров (цАМФ, цГМФ,
Са2+, ДГ, ИТФ, ПГ) в регуляции активности ферментов.
Гормоны – сигнальные молекулы беспроводного системного действия, влияющие на активность и количество ферментов в клетке через каскадные системы (аденилатциклазную, гуанилатциклазную,инозитолтри-фосфатную, RAS и т.д.).
Мессенджеры – низкомолекулярные вещества, переносящие сигналы гормонов внутри клетки (Са2+, цАМФ, цГМФ, ДАГ, ИТФ).
Роль мессенджеров в регуляции активности ферментов: цАМФ участвует в мобилизации энергетических запасов (распад углеводов в печени или триглицеридов в жировых клетках), в задержке воды почками, в нормализации кальциевого обмена, в увеличении силы и частоты сердечных сокращений, в образовании стероидных гормонов, в расслаблении гладких
7
мышц и так далее. цГМФ активирует ПК G, ФДЭ, Са2+-АТФазы, закрывает Са2+- каналы и снижает уровень Са2+ в цитоплазме.
Роль гормонов в регуляции активности ферментов: Гормоны влияют на активность и количество ферментов в клетке через каскадные системы, состоящие из:
1)Рецепторов
2)Регуляторных белков
3)Вторичных посредников
4)Ферментов
Может быть нужно будет зарисовать одну из гормональных систем.
8.Классификация и номенклатура ферментов: систематические
ирабочие названия, коферменты (по классами специфичности –
типу реакции)
Классификация ферментов:
1) Оксидоредуктазы.
Катализируют окислительно-восстановительные реакции. В реакцию вступают 2 вещества и 2 образуются, одно окисляется, другое восстанавливается: Sвост + S’окисл ↔ S’вост + Sокисл
a.дегидрогеназы (отщепляют Н от субстратов)
b.оксидазы (переносят Н с субстрата на кислород),
c.оксигеназы (включают кислород в молекулу субстрата)
d.гидроксипероксидазы (разрушают перекиси водорода и органические перекиси).
Систематическое название: донор: акцептор – оксидоредуктаза
Тривиальное название: донордегидрогеназа.
Шифр: КФ 1.1.1.1
Пример: Пируват + НАДН2 ↔ лактат + НАД+
Систематическое название: Лактат: НАД+ оксидоредуктаза Тривиальное название: ЛДГ. Шифр: КФ 1.1.1.1
2) Трансферазы
8
Принимают участие в переносе атомных групп, молекулярных остатков от одного соединения к другому. В реакцию вступают 2 вещества и 2
образуются: S-G + S’ ↔ S + S’-G.
a.фосфотрансферазы (киназы)
b.аминотрансферазы
c.гликозилтрансферазы
d.метилтрансферазы
e.ацилтрансферазы.
Систематическое название: откуда: куда - в какое положение–что– трансфераза или донор: акцептор–транспортируемая группа–
трансфераза
Тривиальное название: кудакиназа
Шифр: 2.1.1.1
Пример: АТФ + D-гексоза ↔ АДФ + D- гексоза-6ф
Систематическое название: АТФ: D-гексоза-6-фосфотрансфераза
Тривиальное название: гексокиназа
3) Гидролазы.
Расщепляют ковалентную связь с присоединением молекулы воды. В реакцию вступают 2 вещества и 2 образуются: S-G + Н2О ↔ S-ОН + G-Н.
a.гликозидазы – гидролиз гликозидов (лактоза – лактаза, мальтоза
–мальтаза, сахароза – сахараза)
b.пептидазы – гидролиз пептидных связей
c.эстеразы – разрыв связи в сложных эфирах.
Систематическое название субстрат–что отщепляется–гидролаза или
субстрат–гидролаза
Тривиальное название: субстрат-что отщепляетсяаза
Шифр: 3.1.1.1
Пример: Глюкозо-6ф + Н2О → глюкоза + Н3РО4
Систематическое название: Глюкозо-6ф-фосфогидролаза Тривиальное название: Глюкозо-6ф-фосфотаза
4) Лиазы
9
Отщепление групп от субстратов по негидролитическому механизму с образованием двойных связей (или наоборот, присоединение по двойной связи). Реакции обратимы, за исключением отщепления СО2. В реакцию вступает 1 вещество и 2 образуются (или наоборот): -SХ-SY- ↔ XY + -S=S-
Систематическое название: субстрат: что отщепляется–лиаза
Тривиальное название: продуктаза
Шифр: 4.1.1.1
Пример: L-малат ↔ фумарат + Н2О
Систематическое название: L-малат: гидро–лиаза
Тривиальное название: фумараза
5) Изомеразы
Взаимопревращения оптических, геометрических, позиционных изомеров. В реакцию вступает 1 вещество и 1 образуется.
a.Рацемазы
b.Эпимеразы
c.Таутамеразы
d.цис,- трансизомеразы
e.мутазы (при внутримолекулярном переносе группы)
f.цикло-, оксоизомеразы.
Систематическое название субстрат–вид изомеризации–изомераза или
субстрат–продукт–изомераза
Шифр: 5.1.1.1
Пример: гл-6ф ↔ фр-6ф
Систематическое название: гл-6ф–фр-6ф–изомераза
6) Лигазы (синтетазы)
Соединение 2 молекул с использованием энергии макроэргических соединений (АТФ и др). В реакцию вступают 3 вещества, образуется 3 вещества.
Систематическое название: субстрат: субстрат–лигаза (источник
энергии)
Тривиальное название: субстратсубстратлаза
10
