
1414
.pdf
Министерство образования и науки Российской Федерации
Московский государственный университет тонких химических технологий им. М. В. Ломоносова
Кафедра органической химии им. И. Н. Назарова
Лонина Н. Н., Сивова Н. В., Смирнов В. И., Соловьев П. А., Шуталев А. Д.
СБОРНИК МЕТОДИК СИНТЕЗОВ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Методические указания к выполнению лабораторных работ
Москва 2014
УДК 547
ББК 24.2
Н. Н. Лонина, Н. В. Сивова, В. И. Смирнов, П.А. Соловьев, А. Д. Шуталев.
Сборник методик синтезов органических соединений Методические указания к выполнению лабораторных работ, М.
МИТХТ им. М.В. Ломоносова, 2014. – 52 с.
Утверждено библиотечно-издательской комиссией МИТХТ им. М.В. Ломоносова в качестве методических указаний.
Поз. № 104/2014
Методические указания предназначены для студентов всех специальностей, проходящих лабораторный практикум по синтезу органических соединений на кафедре органической химии МИТХТ. Целью лабораторного практикума является практическое ознакомление студентов с основными методами органического синтеза.
Пособие содержит методики синтеза 48 соединений по различным разделам органической химии и снабжено правилами ведения рабочего журнала и правилами техники безопасности.
После каждой методики приведены Вопросы к работе, служащие для проверки подготовки студентов к лабораторной работе.
Рецензент: доцент, к.х.н. Помогаев А.И.
© МИТХТ им. М.В. Ломоносова, 2014
2
Оглавление |
|
НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ У НАСЫЩЕННОГО АТОМА |
|
УГЛЕРОДА........................................................................................................ |
5 |
Бутилбромид ....................................................................................................... |
5 |
трет-Бутилхлорид................................................................................................ |
5 |
Изопропилбромид............................................................................................... |
6 |
НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ ПРИ КАРБОНИЛЬНОМ АТОМЕ |
|
УГЛЕРОДА........................................................................................................ |
7 |
Ацетанилид.......................................................................................................... |
7 |
Ацетилсалициловая кислота (аспирин)............................................................. |
7 |
Бензимидазол...................................................................................................... |
8 |
Бутилацетат......................................................................................................... |
9 |
Диацетат гидрохинона........................................................................................ |
9 |
Изоамилацетат.................................................................................................. |
10 |
β-Нафтилацетат................................................................................................ |
11 |
п-Нитроанилин .................................................................................................. |
11 |
1,2,3,4,6-Пента-О-ацетил-α-D-глюкопираноза ................................................ |
12 |
Фталимид........................................................................................................... |
13 |
ЭЛЕКТРОФИЛЬНОЕ ЗАМЕЩЕНИЕ В АРОМАТИЧЕСКИХ |
|
СОЕДИНЕНИЯХ ............................................................................................. |
14 |
2,4-Динитро-1-нафтол....................................................................................... |
14 |
п-Йоданилин...................................................................................................... |
15 |
Метиловый оранжевый (гелиантин)................................................................. |
16 |
β-Нафтоловый оранжевый (нафтолоранж)..................................................... |
17 |
п-Нитроанилиновый красный........................................................................... |
18 |
п-Нитроацетанилид........................................................................................... |
19 |
п-Нитрозо-N,N-диметиланилин........................................................................ |
20 |
Пикриновая кислота (2,4,6-тринитрофенол) ................................................... |
20 |
Сульфаниловая кислота................................................................................... |
21 |
НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ К КАРБОНИЛЬНОЙ ГРУППЕ |
|
АЛЬДЕГИДОВ И КЕТОНОВ.......................................................................... |
22 |
Бензальанилин.................................................................................................. |
22 |
Дибензальацетон.............................................................................................. |
23 |
N-Метилолфталимид........................................................................................ |
23 |
Оксим бензофенона.......................................................................................... |
24 |
ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ .......................................................... |
25 |
Анилин ............................................................................................................... |
25 |
Антрахинон........................................................................................................ |
26 |
Бензил................................................................................................................ |
26 |
Бензил................................................................................................................ |
27 |
Бензойная кислота............................................................................................ |
28 |
Бензпинакон ...................................................................................................... |
29 |
Бензойная кислота и бензиловый спирт (реакция Канниццаро).................... |
30 |
Слизевая кислота (галактаровая кислота) ...................................................... |
30 |
3 |
|
ПРОЧИЕ РЕАКЦИИ........................................................................................ |
31 |
Ангидрид 2,3,5,6-дибензобицикло[2.2.2]окт-2,5-диен-7,8-дикарбоновой кислоты |
|
...................................................................................................................................... |
31 |
Бензимидазол-2-он........................................................................................... |
32 |
Бензпинаколин .................................................................................................. |
33 |
Бензотриазол..................................................................................................... |
33 |
4-Гидрокси-2-гуанилхиназолин ........................................................................ |
34 |
Диазоаминобензол............................................................................................ |
35 |
2,3-Дифенилхиноксалин................................................................................... |
36 |
2-Иминотиазолидин-4-он (псевдотиогидантоин) ........................................... |
36 |
п-Нитрофенилдиазотат натрия (анти-изомер)............................................... |
37 |
4-Оксо-3,4-дигидрофталазин-1-карбоновая кислота...................................... |
38 |
1,2,4-Триазолин-3-тион..................................................................................... |
39 |
Этиловый эфир 6-метил-2-оксо-4-фенил-1,2,3,4-тетрагидропиримидин-5- |
|
карбоновой кислоты (реакция Биджинелли).............................................................. |
40 |
N-Ацетил-N’-метилмочевина............................................................................ |
40 |
N-(4-метилфенил)-β-D-глюкопиранозиламин.................................................. |
41 |
Фумаровая кислота........................................................................................... |
42 |
ПРИЛОЖЕНИЯ............................................................................................... |
43 |
Правила оформления лабораторного журнала.............................................. |
43 |
Правила техники безопасности........................................................................ |
48 |
Примеры установок для проведения экспериментов..................................... |
50 |
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ.............................................. |
51 |
4

Нуклеофильное замещение у насыщенного атома углерода
Бутилбромид
|
|
NaBr |
|
|
H3C |
OH |
|
H3C |
Br |
|
||||
|
|
H2SO4 |
|
|
|
|
-H2O |
|
|
В круглодонную колбу ёмкостью 50 мл помещают 7 мл воды и постепенно присыпают 7,70 г тонко растертого бромида натрия (в ходе добавления NaBr смесь необходимо периодически помешивать, для того чтобы избежать образования комков). Далее добавляют 5,5 мл н-бутилового спирта и постепенно, помешивая колбу, порциями приливают 5,5 мл конц. серной кислоты. Колбу снабжают обратным водяным холодильником и реакционную массу нагревают при кипении в течение 1,5 ч. После этого обратный холодильник заменяют на нисходящий и отгоняют бутилбромид в приемник (при этом частично отгоняется вода). Бутилбромид отделяют от воды в делительной воронке, 1 раз промывают водой и 1 раз 10%-ным раствором гидрокарбоната натрия, высушивают над хлоридом кальция и перегоняют, собирая фракцию, кипящую в интервале 101– 104°C. Получают 7,40 г (90%) бутилбромида, nD20 1,4392.
Вопросы к работе
1.Обоснуйте необходимость применения воды для проведения реакции.
2.С какой целью бромид натрия используют в измельченном виде?
3.Почему добавление серной кислоты следует проводить постепенно и при перемешивании?
4.Можно ли проводить выделение бутилбромида не его отгонкой, а непосредственно отделением от водной фазы в делительной воронке?
5.С какой целью проводят промывку отогнанного бутилбромида?
трет-Бутилхлорид
|
CH3 |
HCl |
|
CH3 |
||
H3C |
|
CH3 |
|
H3C |
|
CH3 |
|
-H2O |
|
||||
|
OH |
|
Cl |
|||
Смесь 5,0 мл третичного бутилового спирта и 25,0 мл конц. соляной кислоты интенсивно взбалтывают в делительной воронке в
5
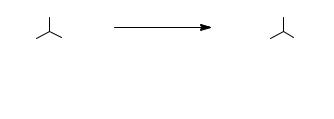
течение 15-20 минут. Реакционной массе дают отстояться, после чего органический слой отделяют от водного, сушат хлоридом кальция и перегоняют. Получают 3,00 г (61%) продукта. Температура кипения 51–52°C, nD20 1,3848.
Вопросы к работе
1.Объясните, почему используется большой избыток соляной кислоты?
2.Для чего нужно интенсивно взбалтывать реакционную массу в делительной воронке?
3.На каком свойстве трет-бутилхлорида основан его метод выделения из реакционной смеси?
4.Как можно объяснить достаточно низкий выход трет-бутилхлорида?
Изопропилбромид
O
В круглодонную колбу ёмкостью 100 мл помещают 7,5 мл изопропилового спирта и 5 мл воды. Далее при перемешивании и охлаждении колбы холодной водой порциями добавляют 9,9 мл конц. серной кислоты. Реакционную смесь охлаждают до комнатной температуры и к ней при перемешивании прибавляют 7,50 г тонко растертого бромида калия. Колбу соединяют с дефлегматором и присоединяют к нисходящему водяному холодильнику. В приёмник наливают до половины холодной воды так, чтобы конец алонжа был опущен в воду. Реакционную массу нагревают на песчаной бане до тех пор, пока в приёмник не перестанут капать маслянистые капли, опускающиеся на дно. Органический слой отделяют с помощью делительной воронки, сушат хлоридом кальция и перегоняют. Получают 6,00 г (77%) продукта. Температура кипения 59–60°C, nD20
1,3848.
Вопросы к работе
1.С какой целью бромид калия предварительно измельчают?
2.Почему необходимо охлаждение при смешивании реагентов?
3.Объясните, зачем реакционный прибор снабжают дефлегматором?
4.С какой целью изопропилбромид собирают под воду?
5.Какие осушающие вещества можно, а какие нельзя использовать при высушивании бромистого изопропила?
6

Нуклеофильное замещение при карбонильном атоме углерода
Ацетанилид
NH2 |
|
|
O |
|
H3C O |
CH3 |
HN CH3 |
||
|
||||
|
+ |
|
|
|
|
O |
O |
-CH3COOH |
В стакан наливают 100 мл воды и 4,5 мл анилина. После этого к смеси при интенсивном перемешивании стеклянной палочкой приливают 5,5 мл уксусного ангидрида. Через 5-10 мин смесь с выпавшим осадком охлаждают во льду, осадок отфильтровывают, промывают холодной водой. После перекристаллизации из воды получают 5,50 г (82%) ацетанилида с температурой плавления 114– 115°C.
Вопросы к работе
1.Для чего нужно интенсивное перемешивание реакционной массы?
2.С какой целью после окончания реакции смесь охлаждают?
3.Можно ли изменить порядок смешения реагентов, а именно к раствору ангидрида в воде добавить анилин?
4.Объясните, почему при перекристаллизации ацетанилида из воды не рекомендуется нагревать воду до кипения.
Ацетилсалициловая кислота (аспирин)
O |
|
|
|
|
|
|
|
|
|
|
|
O |
|||
H |
C |
O |
CH |
|
H2SO4 |
|
OH |
||||||||
|
|
||||||||||||||
|
|
|
|
|
|||||||||||
|
|
OH + |
3 |
|
|
|
|
|
|
3 |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
OH |
|
O |
O |
|
-CH3COOH |
||||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
H3C |
|
O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
В колбу помещают 3,20 г салициловой кислоты, 4,5 мл уксусного ангидрида и добавляют 2 капли конц. серной кислоты. Смесь тщательно перемешивают, затем колбу соединяют с дефлегматором
инагревают на водяной бане при 60°C в течение 1 ч, периодически перемешивая. После этого повышают температуру бани до 90–95°C
ивыдерживают реакционную смесь при этой температуре в течение 20 мин. После охлаждения полученного раствора до комнатной
7
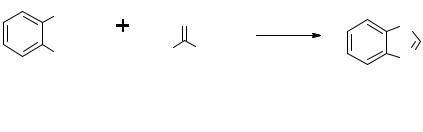
температуры, его выливают в стакан, содержащий 10 мл ледяной воды, хорошо перемешивают. Выпавший осадок отфильтровывают, промывают холодной водой, затем небольшим количеством холодного толуола, высушивают. Получают 4,00 г (96%) продукта, который перекристаллизовывают из 50%-ной уксусной кислоты. Температура плавления 133–136°C.
Вопросы к работе
1.Зачем нагревание реакционной смеси проводят вначале при одной температуре, а затем при более высокой?
2.Что может служить визуальным критерием завершения реакции?
3.С какой целью реакционную смесь после окончания реакции переносят в ледяную воду?
4.Зачем продукт реакции после фильтрования реакционной смеси желательно промывать на фильтре охлаждённым толуолом?
Бензимидазол
-H2O
В пробирку помещают 2,16 г о-фенилендиамина и 1,2 мл муравьиной кислоты (или соответствующее количество водного раствора муравьиной кислоты с концентрацией кислоты более 40%). Смесь нагревают на кипящей водяной бане в течение 2 ч, затем образовавшийся раствор охлаждают до комнатной температуры и при перемешивании медленно приливают 10%-ный раствор гидроксида натрия до слабощелочной реакции среды. Выпавший осадок отфильтровывают, промывают на фильтре ледяной водой, высушивают. Получают 2,30 г (97%) бесцветного продукта, который перекристаллизовывают из воды (около 30 мл). Температура плавления 170–172°C.
Вопросы к работе
1.Почему муравьиная кислота берётся в избытке по отношению к о-фенилендиамину?
2.С какой целью после окончания реакции проводят добавление водного раствора гидроксида натрия к реакционной массе?
3.Можно ли использовать гидрокарбонат или карбонат натрия вместо гидроксида натрия?
4.Чего можно ожидать, если после добавления раствора NaOH среда
8

станет сильнощелочной (рН>10)?
5. Что следует предпринять, если продукт получился окрашенным?
Бутилацетат
В круглодонной колбе ёмкостью 50 мл смешивают 5,0 мл ледяной уксусной кислоты, 8,0 мл н-бутилового спирта и 2 капли конц. серной кислоты. Колбу соединяют с водоотделителем (насадка Дина-Старка) и обратным холодильником. Реакционную смесь нагревают при кипении в течение 30-60 мин до прекращения поступления капель воды в насадку Дина-Старка. После охлаждения до комнатной температуры реакционную смесь и органический слой в насадке объединяют, переливают в делительную воронку, промывают водой, затем 10%-ным раствором карбоната натрия (до нейтральной реакции среды) и снова водой. Продукт высушивают сульфатом натрия и перегоняют. Получают 6,75 г (66%) продукта. Температура кипения 123–126°C, nD20 1,3941.
Вопросы к работе
1.Каким образом добиваются смещения равновесия данной реакции в сторону целевого продукта?
2.Объясните, почему реакционную массу промывают водой лишь после охлаждения? Что может произойти, если воду добавить к горячему раствору?
3.Какую роль играет серная кислота в данной реакции? Можно ли заменить серную кислоту другой минеральной кислотой (фосфорной,
хлорной и т.п.)?
5.Зачем экстракт промывают раствором карбоната натрия до нейтральной реакции?
Диацетат гидрохинона
|
|
|
|
O |
OH |
|
|
|
H3C O |
|
O |
|
H2SO4 |
|
+ 2 H3C |
CH3 |
|||
|
|
|
|
|
O |
O |
|
-CH3COOH |
|
OH |
|
|
|
O CH3 |
|
|
|
|
O |
|
|
9 |
|
|
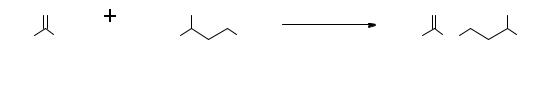
В пробирку помещают 2,00 г гидрохинона, 3,5 мл уксусного ангидрида и далее добавляют 1 каплю конц. серной кислоты. Реакционную массу встряхивают. При этом она разогревается и гидрохинон растворяется. Через 10 мин раствор выливают в 15 мл ледяной воды, выпавший осадок отфильтровывают, промывают холодной водой, высушивают. Получают 3,45 г (98%) продукта, который перекристаллизовывают из 50%-ного этилового спирта (около 14 мл). Температура плавления 121–122°С.
Вопросы к работе
1.Что является растворителем в данной реакции?
2.Какое влияние будет оказывать количество серной кислоты на скорость реакции? Возможно ли проведение реакции без кислоты или в присутствии уксусной кислоты?
3.Что является визуальным признаком окончания реакции?
4.С какой целью реакционную массу выливают в ледяную воду? Чего следует ожидать, если вода будет не ледяной?
5.Можно ли проводить перекристаллизацию продукта из воды? Из чистого этилового спирта?
Изоамилацетат
- O
В круглодонной колбе ёмкостью 50 мл смешивают 5,0 мл ледяной уксусной кислоты, 9,5 мл изоамилового спирта и добавляют 2 капли конц. серной кислоты. Колбу соединяют с водоотделителем (насадка Дина-Старка) и обратным холодильником. Реакционную смесь нагревают при кипении в течение 30-60 мин до прекращения поступления капель воды в насадку Дина-Старка. После охлаждения до комнатной температуры реакционную смесь и органический слой в насадке объединяют, переливают в делительную воронку, промывают водой, затем 10%-ным раствором карбоната натрия (до нейтральной реакции среды) и снова водой. Продукт высушивают сульфатом натрия и перегоняют. Получают 7,50 г (66%) продукта. Температура кипения 138–142°C, nD20 1,4053.
Вопросы к работе
1.Каким образом добиваются смещения равновесия данной реакции в сторону целевого продукта?
10
