
Pract-II-2014
.pdf
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ТОНКИХ ХИМИЧЕСКИХ ТЕХНОЛОГИЙ имени М.В.ЛОМОНОСОВА
КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ имени Я.К.СЫРКИНА
Б.А.Беляев, А.Н.Зобнина, П.В.Мельников, Н.Е.Минина, С.М.Пестов, О.Ю.Ткаченко
ХИМИЧЕСКАЯ
ТЕРМОДИНАМИКА
ЛАБОРАТОРНЫЙ ПРАКТИКУМ. ЧАСТЬ II ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
МОСКВА Издательство МИТХТ
2014 г.
УДК 544.3, 541.1 ББК 24.5
Рецензент: к.х.н. Рукк Н.С.
доцент кафедры неорганической химии МИТХТ имени М.В.Ломоносова
Рекомендовано к изданию кафедрой физической химии имени Я.К.Сыркина (протокол заседания кафедры №9 от 03.02.2014 г.)
План 2014 г. (поз. №77)
Авторы: Беляев Б.А., Зобнина А.Н., Мельников П.В., Минина Н.Е., Пестов С.М., Ткаченко О.Ю.
Химическая термодинамика: Лабораторный практикум Часть II. Экспериментальная часть. Под общей редакцией проф. Флида В.Р.
53стр.
Вэкспериментальную часть лабораторного практикума включены работы по «Химической термодинамике». В каждой работе даны основы метода исследования и порядок выполнения, расчета и оформления эксперимента. Пособие предназначено для студентов МИТХТ всех направлений, изучающих курс физической химии.
Данное пособие является переработанным и дополненным Лабораторным практикумом, впервые выпущенным кафедрой в 2007 г.
© МИТХТ им. М.В.Ломоносова
2
ФУНДАМЕНТАЛЬНЫЕ ФИЗИЧЕСКИЕ ПОСТОЯННЫЕ
Величина |
Символ |
Значение |
Размерность |
|
|
|
|
Скорость света в |
с |
2,99792458 108 |
м/с |
вакууме |
|
|
|
|
|
|
|
Элементарный |
е |
1,6021892 10 19 |
Кл |
заряд |
|
|
|
|
|
|
|
Электрическая |
0 |
8,8541878 10 12 |
Ф/м |
постоянная |
|
|
|
(диэлектрическая |
|
|
|
проницаемость |
|
|
|
вакуума) |
|
|
|
|
|
|
|
Постоянная |
NA |
6,02204 1023 |
моль 1 |
Авогадро |
|
|
|
|
|
|
|
Постоянная |
k=R/NA |
1,38066 10 23 |
Дж/К |
Больцмана |
|
|
|
|
|
|
|
Постоянная |
F |
96484,56 |
Кл/моль |
Фарадея |
|
|
|
|
|
|
|
Универсальная |
R |
8,31441 |
Дж/(моль К) |
газовая |
|
1,98717 |
кал/(моль К) |
постоянная |
|
||
|
|
0,082057 |
л атм/(моль К) |
|
|
|
|
Полезные соотношения
1 кал = 4,184 Дж 1 атм = 1,01325105 Па = 760 Торр (мм рт.ст.)
1 бар = 105 Па = 750 Торр (мм рт.ст.)
3
Тема I. ТЕРМОХИМИЯ
Цель работы. Получить практические навыки экспериментальной работы с простейшими калориметрическими приборами. Определение тепловых эффектов различных реакций калориметрическим методом.
I.1. ОПИСАНИЕ УСТРОЙСТВА КАЛОРИМЕТРА
При выполнении работ по термохимии основным прибором для измерения тепловых эффектов является калориметр.
Калориметры бывают нескольких типов, классификация их проводится по таким признакам, как принцип действия, тип исследуемых процессов, агрегатное состояние рабочего тела, способ перемешивания и другие. Если перемешивание проводится с помощью мешалки, такой калориметр называется статическим. Особое внимание уделяется измерению изменения температуры, при этом всегда стремятся достичь наибольшей точности. В качестве измерителя температур используются: термометр Бекмана (термометр расширения), термометры сопротивления, термопары и другие датчики температуры.
Наиболее часто в лабораторном практикуме применяются изопериболический жидкостной калориметр смешения (растворения), в котором учитывается теплообмен с окружающей средой путем введения поправки при расчете изменения температуры в ходе проведения опыта.
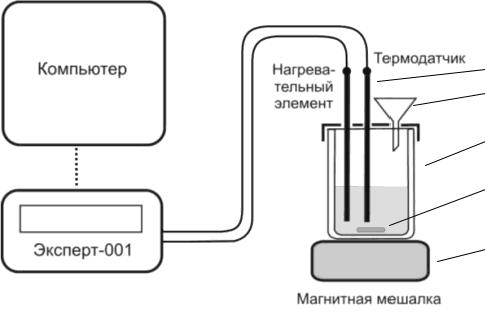
Схема калориметрической установки, используемой в работе, приведена на рис I.1.
1
2
3
4
Рис.I.1. Общая схема экспериментальной установки
4
Она состоит из реакционного сосуда (3) с двойными стенками (сосуд Дьюара), минимизирующего теплообмен с окружающей средой, закрытого крышкой. На его дно опущен магнит в защитной оболочке (4). Через крышку в реакционный сосуд вводится термодатчик (1) и воронка (2) для загрузки реагирующих веществ. В качестве рабочего тела используется дистиллированная вода (200 мл). Перемешивание реакционной смеси проводится с помощью магнитной мешалки (5).
В качестве измерителя температур - термометр сопротивления. Принцип его действия основан на том, что металлы и полупроводники могут изменять свое сопротивление при изменении температуры. Достоинствами термометров сопротивления являются: высокая точность измерения температуры, возможность автоматической записи, передача показаний на расстояние и др. Термометр сопротивления соединен с измерительным блоком «Эксперт-001» в качестве регистрирующего прибора. На дисплее прибора в реальном времени отображается график изменения температуры. Возможно подключение к компьютеру.
I.2. ПОРЯДОК РАБОТЫ С УСТАНОВКОЙ «ЭКСПЕРТ-001»
Включение прибора
1.Кнопкой  включите прибор.
включите прибор.
2.Для регулировки яркости дисплея нажмите кнопку  .
.
3.Дождитесь появления экрана с заголовком «Выбор режима». В строке ниже должна быть надпись «Термометр». Если она
отсутствует, используйте кнопки  и
и  для переключения в данный режим.
для переключения в данный режим.
4.Если планируется сохранение данных на картах формата SD,
убедитесь, что она вставлена в разъем (контактами к себе  ), а на дисплее прибора рядом с индикатором заряда батареи отображается символ «d». При вставке и извлечении карты памяти прибор издаёт звуковой сигнал.
), а на дисплее прибора рядом с индикатором заряда батареи отображается символ «d». При вставке и извлечении карты памяти прибор издаёт звуковой сигнал.
5
Проведение измерения
1.Налейте в термометрический стакан (сосуд Дьюара) 200 мл воды,
отмерив мерной колбой.
2.Опустите в налитую воду якорь магнитной мешалки.
3.Закройте термометрический стакан крышкой с термодатчиком и проверьте степень его погружения в измеряемую жидкость.
4.Включите магнитную мешалку (поворотом тумблера на её передней панели по часовой стрелке) и отрегулируйте скорость перемешивания.
5.Взвесьте на аналитических весах около 1-2 г вещества, подлежащего растворению. Используйте плотно закрывающийся бюкс, чтобы избежать адсорбции влаги из воздуха.
6.Нажмите на приборе кнопку  . Если запись производится на карту памяти, то рядом с индикатором заряда батареи символ «d» заменится на «D». ВНИМАНИЕ! Во время измерения вынимать карту памяти из прибора нельзя!
. Если запись производится на карту памяти, то рядом с индикатором заряда батареи символ «d» заменится на «D». ВНИМАНИЕ! Во время измерения вынимать карту памяти из прибора нельзя!
7.Прибор может отображать текущее значение температуры (по умолчанию) или график её зависимости от времени. Для переключения между режимами отображения используйте кнопку
 .
.
8.Дождитесь, установления стационарного режима теплообмена измерительной системы с окружающей средой. Об этом свидетельствует линейное изменение температуры во времени в течение не менее 3-5 минут.
9.Единовременно засыпьте навеску вещества в термометрический стакан.
10.Наблюдайте изменение температуры и дальнейший выход на стационарный режим теплообмена с окружающей средой (аналогично п.8).
11.Для окончания измерения нажмите кнопку  . Карту памяти можно извлечь, когда символ «D» заменится на «d».
. Карту памяти можно извлечь, когда символ «D» заменится на «d».
6
12.При определении теплового эффекта реакции нейтрализации обязательно определите pH раствора (дальнейший расчёт по недостатку).
13.Аккуратно вылейте раствор из термометрического стакана, не допуская выпадения якоря мешалки в раковину.
14.При повторном измерении вернитесь к п.1.
Обработка результатов
1.Сдайте SD-карту лаборанту и получите распечатанные результаты измерений.
2.По полученным данным постройте соответствующие термохимические кривые и обработайте их так, как это указано в практикуме.
Отключение прибора
1.Кнопкой  выключите прибор.
выключите прибор.
2.Электрод следует хранить в 3,5 М растворе KCl.
I.3. ОПРЕДЕЛЕНИЕ ПОСТОЯННОЙ КАЛОРИМЕТРА
Независимо от выбранной системы измерения для расчета теплоты растворения (или другого процесса) необходимо знать так называемую постоянную калориметра К. Эта величина представляет собой сумму
теплоемкостей всех частей калориметра: |
|
К = Сkmk (Дж/К), |
(I.1) |
где Сk удельные теплоемкости каждой из частей калориметра (Дж/г К), mk массы отдельных частей калориметра: мешалки, стакана, воды, термометра сопротивления (г) или любого другого датчика температур.
По физическому смыслу К представляет собой количество тепла, которое требуется для нагревания калориметра на один градус.
Постоянная калориметра может быть определена опытным путем. Одним из методов определения является расчет её через теплоту растворения точной навески вещества с известной удельной теплотой растворения по уравнению:
К |
qРВmРВ |
(Дж/ К) |
(I.2) |
|
Т |
||||
|
|
|
7
где qР В - удельная теплота растворения вещества (Дж/г ), mР В – точная навеска растворяемого вещества (г), - изменение температуры калориметра в процессе растворения вещества (К)
|
|
|
|
|
Таблица I.1 |
|
|
|
|
|
|
t0C |
10-3кг/м3 |
t0C |
10-3кг/м3 |
t0C |
10-3кг/м3 |
20 |
0,99823 |
24 |
0,99732 |
28 |
0,99626 |
21 |
0,99802 |
25 |
0,99707 |
29 |
0,99597 |
22 |
0,99780 |
26 |
0,99681 |
30 |
0,99567 |
23 |
0,99756 |
27 |
0,99654 |
35 |
0,99406 |
При определении постоянной калориметра в качестве растворителя используется дистиллированная вода, а в качестве растворяемого вещества - хлорид калия. Необходимая для расчета К величина удельной теплоты растворения хлорида калия при условиях опыта приведена в табл.31 на стр.46 “Краткого справочника физико-химических величин” [1]. По данным таблицы строится график зависимости интегральной теплоты растворения 1 моль хлорида калия от конечной концентрации раствора, выраженной числом моль соли, растворенных в 1000 г воды. По построенному графику определяется теплота растворения 1 моль хлорида калия при температуре опыта. В проведенном опыте по определению постоянной калориметра измеренными величинами являются объем воды и величина навески соли. Для расчета конечной концентрации раствора соли необходимо знать еще и массу воды, которую легко рассчитать по известной плотности. Данные по плотности воды приведены в табл.I.1. Найденная из графика величина теплоты растворения пересчитывается на удельную q[Дж/г], которая и используется для определения постоянной калориметра по уравнению (I.2).
I.4. ОБРАБОТКА РЕЗУЛЬТАТОВ КАЛОРИМЕТРИЧЕСКИХ ИЗМЕРЕНИЙ И ПРОВЕДЕНИЕ РАСЧЕТОВ
По окончании опыта распечатывается график (рис формуле:
по данным, записанным на SD-карту, I.2.), по которому проводится расчет по
= Ткон - Тнач, К |
(I.3) |
где Ткон соответствует точке С2 на рисунке, а Тнач – точке С1.
На калориметрической кривой на рис I.2. четко выделяются начальный (AB1) и конечный (D2E) периоды опыта, характеризующиеся стационарным режимом теплообмена системы с окружающей средой. Между начальным и конечным периодами находится главный период,
8
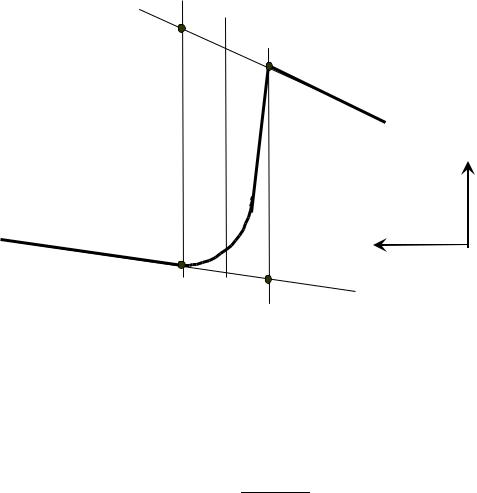
отвечающий исследуемому процессу. Чтобы найти изменение температуры с учетом поправок на теплообмен, прямые, соответствующие начальному и конечному периодам, продлеваются, как показано на рис. и определяются точки B1 и D2, в которых заканчивается начальный период и начинается конечный. Через эти точки проводятся линии, перпендикулярные оси времени (в данном случае вертикальные). На пересечении этих линий с продолжением линий AB1 и ED2 находят точки D1 и B2, а делением отрезков D1B1 и D2B2 пополам находят точки C1, которая соответствует значению Тнач и C2, которая соответствует значению Ткон, определяющие отрезок C1C2. Следовательно, величина отрезка C1C2 будет отвечать - изменению температуры с учетом поправок на теплообмен.
D1 |
C1 (Тнач ) |
|
B1 |
|
À |
|
Т, К |
Е |
, мин |
|
D2 |
||
B2 |
||
C2(Ткон) |
Рис.I.2. Калориметрическая кривая для определения температур в ходе калориметрического опыта
Таким образом уравнение для расчета постоянной имеет вид:
K qте mте , (Дж/К)
k ΔT
Полученное значение К используется во всех расчетах при удельных теплот растворения по формуле:
q те |
|
K k ΔT |
(Дж/г), |
|
m те |
||||
|
|
|
изменения
калориметра
(I.4)
определении
(I.5)
9
из уравнения (I.5) видно, что знак qр в зависит от знака (С2 С1), т.е. при
(С2 С1) 0 qр в 0 и наоборот.
В лабораторной работе «Термохимия» проводятся определения интегральных теплот растворения. Последовательность проведения операций и обработки полученных результатов проводится так, как указано в разделе I.2. Все измеряемые и расчетные величины заносятся в таблицу результатов измерений.
I.5. ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ РАСТВОРЕНИЯ СОЛИ В ВОДЕ
Цель работы: Экспериментальное определение теплоты растворения соли в воде.
Порядок выполнения эксперимента:
Рассмотрим процесс растворения соли
KCl(тв) + aq = K+aq + Cl aq.
Согласно закону Гесса, этот процесс можно представить в виде отдельных стадий: Сначала происходит разрушение кристаллической решетки твердой соли с образованием газообразных ионов
1. КClтв К+(газ) + |
Cl (газ) |
QP = реш H0 0 |
при этом теплота поглощается (процесс эндотермический). H0
это количество тепла, которое необходимо затратить, чтобы «разорвать» на ионы 1 моль твердой соли.
Далее происходит взаимодействие ионов с водой (гидратация ионов), при этом теплота выделяется (процессы гидратации экзотермические):
2. |
К+ (газ) |
+ aq |
К+aq |
QP = гидр.кат H0. 0 |
3. |
Сl (газ) + aq |
Cl aq |
QP = гидр.ан H0 0, |
|
Суммируя реакции1-3, получим исходную реакцию: |
||||
KCl(тв) |
+ aq |
= K+aq + |
Cl aq, |
|
где aq «бесконечно большое» количество воды, т.е. такое уравнение справедливо для разбавленных растворов, в которых диссоциация прошла полностью. Следовательно, и результирующий тепловой эффект также равен алгебраической сумме тепловых эффектов этих же реакций:
rН0 = реш Н0 + гидр кат Н9 + гидр.ан.Н0
Знак теплового эффекта реакции растворения зависит от соотношения энергии кристаллической решетки и суммарной теплоты гидратации ионов.
10
