
Основы химии нуклеиновых кислот. Нуклеозиды
.pdfИздание учебное
Маслов Михаил Александрович
Серебренникова Галина Андреевна
Основы химии нуклеиновых кислот. Нуклеозиды
Учебное пособие
Подписано в печать ________________ Формат 60х84/16. Бумага писчая.
Отпечатано на ризографе. Уч. изд. листов 1. Тираж 50 экз.
Заказ № _________
Московская государственная академия тонкой химической технологии имени М.В.Ломоносова.
Издательско-полиграфический центр. 119571 Москва, пр. Вернадского 86.
32
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
МОСКОВСКАЯ ГОСУДАРСТВЕННАЯ АКАДЕМИЯ ТОНКОЙ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
имени М.В.Ломоносова
Кафедра химии и технологии биологически активных соединений им. Н.А. Преображенского
М.А. Маслов, Г.А. Серебренникова ОСНОВЫ ХИМИИ НУКЛЕИНОВЫХ КИСЛОТ.
НУКЛЕОЗИДЫ
Учебное пособие
Москва 2011
http://www.mitht.ru/e-library
УДК 547.963.32 ББК 24.239
M 31
Рецензент: к.х.н., доц. Кириллова Ю.Г. (Кафедра биотехнологии и
бионанотехнологии МИТХТ им. М.В.Ломоносова)
М.А. Маслов, Г.А. Серебренникова Основы химии нуклеиновых кислот. Нуклеозиды Учебное пособие
М., МИТХТ им. М.В.Ломоносова, 2011 – 30 с.
Утверждено Библиотечно-издательской комиссией МИТХТ в качестве учебно-методического пособия.
В настоящем учебном пособии представлен материал по одному из разделов биоорганической химии, а именно по структуре и химическим свойствам основных структурных блоков нуклеиновых кислот – гетероциклических оснований и нуклеозидов. Изложены вопросы строения, конфигурации нуклеозидов. Рассмотрены свойства и химические модификации гетероциклических оснований и нуклеозидов. Учебное пособие дополняет учебники и учебные пособия по курсу «Химия и технология биологически активных соединений» и предназначено для студентов 4 курса дневного отделения, обучающихся по направлению 550800 « Химическая технология и биотехнология».
©М.А. Маслов, Г.А. Серебренникова
©МИТХТ им. М. В.Ломоносова, 2011
2 |
31 |
http://www.mitht.ru/e-library
Список литературы
1.Ю. А. Овчинников, Биоорганическая химия, М.: Просвещение, 1987.
2.Nucleic Acids in Chemistry and Biology, Eds. G. M. Blackburn, M. J. Gait, D. Loakes, D. M. Williams, RSC Publishing, Cambridge, 2006
3.Abbreviations and Symbols for Nucleic Acids, Polynucleotides and their Constituents, IUPAC-IUB Commission on Biochemical Nomenclature (CBN)
|
СОДЕРЖАНИЕ |
|
ВВЕДЕНИЕ |
4 |
|
СТРОЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ |
4 |
|
ГЕТЕРОЦИКЛИЧЕСКИЕ ОСНОВАНИЯ |
5 |
|
Редкие (минорные) основания |
6 |
|
Конформация гетероциклических оснований |
7 |
|
Свойства гетероциклических оснований |
7 |
|
НУКЛЕОЗИДЫ |
8 |
|
Строение нуклеозидов |
9 |
|
Номенклатура нуклеозидов |
10 |
|
ХИМИЧЕСКАЯ МОДИФИКАЦИЯ НУКЛЕОЗИДОВ |
11 |
|
ХИМИЧЕСКАЯ МОДИФИКАЦИЯ ПО ГЕТЕРОЦИКЛИЧЕСКИМ |
|
|
ОСНОВАНИЯМ |
12 |
|
1. |
Модификация по остаткам урацила и цитозина. |
12 |
2. |
Селективная модификация тимидина |
14 |
3. |
Галогенирование нуклеозидов |
14 |
4. |
Реакция пиримидиновых оснований с бисульфитом натрия. |
16 |
5. |
Меркурирование |
17 |
6. |
Алкилирование |
17 |
7. |
Ацилирование |
19 |
8. |
Получение тиопроизводных нуклеозидов |
21 |
9. |
Взаимодействие с альдегидами. |
21 |
ХИМИЧЕСКАЯ МОДИФИКАЦИЯ УГЛЕВОДНОГО ФРАГМЕНТА |
23 |
|
1. |
Окисление |
23 |
2. |
Ацилирование и алкилирование |
23 |
3. |
Взаимодействие с карбонильными соединениями |
25 |
4. |
Взаимодействие с силильными производными |
25 |
5. |
Получение 2’,3’-дидезоксинуклеозидов |
26 |
6. |
Гидролиз N-гликозидных связей |
27 |
РЕАКЦИИ ПРОТЕКАЮЩИЕ С УЧАСТИЕМ УГЛЕВОДНОГО И |
|
|
ГЕТЕРОЦИКЛИЧЕСКОГО ФРАГМЕНТОВ |
27 |
|
Список литературы |
30 |
|
30 |
3 |
http://www.mitht.ru/e-library
ВВЕДЕНИЕ
Нуклеиновые кислоты как один из компонентов живой материи были открыты в 1869 году швейцарским ученым Иоганом Мишером. Однако бурное развитие химии и биохимии нуклеиновых кислот началось в конце
40-х - начале 50-х годов ХХ века, когда было установлено, что один из двух главных типов нуклеиновых кислот - дезоксирибонуклеиновая кислота
(ДНК) является носителем наследственной информации. На протяжении второй половины XX века нуклеиновые кислоты были важнейшим объектом исследований химии и биологии. Химики создали методы установления детальной химической структуры нуклеиновых кислот, их искусственного синтеза, изучили их поведение при разных химических воздействиях.
Биохимики направили свои усилия на выяснение многочисленных аспектов функционирования нуклеиновых кислот в живых организмах или выделенных из них системах. Поскольку было выяснено, что строение молекул нуклеиновых кислот специально приспособлено для выполнения некоторых основополагающих биологических функций, область биохимии,
изучающая поведение нуклеиновых кислот в живых и модельных системах,
обособилась в автономную область знания, получившую название молекулярная биология. Многие вопросы биохимии нуклеиновых кислот стали азбукой естествознания, вошли не только в вузовские, но и в школьные учебники. Между тем, изучение нуклеиновых кислот продолжает оставаться одной из самых горячих точек на переднем крае современной науки. Одними из наиболее прецизионных инструментов для изучения нуклеиновых кислот становятся разнообразные химические методы.
СТРОЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ
Нуклеиновые кислоты – важнейшие биополимеры, осуществляющие хранение и передачу генетической информации в живой клетке.
Существуют два типа нуклеиновых кислот – дезоксирибонуклеиновые
4
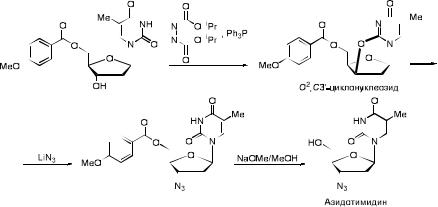
Образование циклонуклеозидов было использовано в синтезе
3'-модифицированных 2',3'-дидезоксинуклеозидов, например, антивирусного препарата азидотимидина.
Азидотимидин – первый анти-ВИЧ препарат, который конкурентно блокирует обратную транскриптазу и избирательно подавляет репликацию вирусной ДНК. Попадая в клетку (как в инфицированную, так и в интактную), при участии, соответственно, клеточных тимидинкиназы,
тимидилаткиназы и неспецифической киназы азидотимидин фосфорилируется с образованием моно-, ди - и трифосфатного соединения.
Азидотимидинтрифосфат обладает структурным сходством с тимидинтрифосфатом и конкурирует с ним в процессе репликации вирусной ДНК. Способность ингибировать обратную транскриптазу ВИЧ в 100-300
раз выше, чем способность подавлять ДНК-полимеразу человека.
Азидотимидин используется в комбинированной терапии ВИЧ-инфекций.
29
http://www.mitht.ru/e-library
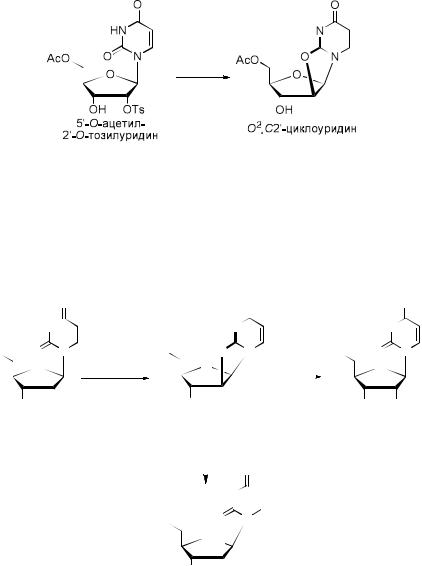
O-тозилуридина в 2’-дезокси-2'-йодуридин. Затем были разработаны многочисленные химические подходы к синтезу циклонуклеозидов с использованием различных конденсирующих агентов.
Взаимодействие циклических нуклеозидов с нуклеофилами в безводных условиях приводит к расщеплению связи O2-C2’ и образованию замещенных нуклеозидов с природной конфигурацией при атоме С-2’.
Кислотный гидролиз в водных условиях приводит к образованию арабинонуклеозидов, многие из которых обладают противовирусной активностью.
|
|
O |
|
|
|
O |
|
|
O |
|
|
HN |
|
|
|
N |
|
HN |
|||
HO |
O |
N |
(PhO)2CO, |
HO |
O |
N |
HO |
O |
N |
|
|
O |
|
|
O |
|
|
|
O |
|
|
|
|
NaHCO3 |
|
|
HX |
|
|
|||
|
OH |
OH |
|
|
OH |
|
|
|
OH |
X |
|
|
|
|
2 |
|
|
|
|
X = F, Cl, I |
|
|
|
|
|
O ,C2'-циклонуклеозид |
|
|
|
|||
 H+ O
H+ O
HN 
HO |
O N |
|
O OH |
||
|
OH
Арабинонуклеозид
28
кислоты (ДНК) и рибонуклеиновые кислоты (РНК). ДНК представляет собой генетический материал большинства организмов. В прокариотических клетках, кроме основной хромосомной ДНК, часто встречаются внехромосомные ДНК – плазмиды. В эукариотических клетках основная масса ДНК расположена в клеточном ядре, где она связана с белками в хромосомах. Эукариотические клетки содержат также ДНК в различных органеллах (митохондриях, хлоропластах). В клетках содержатся матричные
(мРНК), рибосомные РНК (рРНК), транспортные РНК (тРНК) и ряд других.
Кроме того РНК входит в состав многих вирусов.
Нуклеиновые кислоты представляют собой биополимеры, построенные из мономерных звеньев, которые называются нуклеотиды. Каждый нуклеотид состоит из остатков гетероциклического основания, углевода и фосфорной кислоты. Различные нуклеиновые кислоты могут содержать от
80 нуклеотидов, как в случае тРНК, и до 108 нуклеотидных пар – в случае хромосомальной ДНК эукариот. Единицей измерения нуклеиновой кислоты является пара оснований (для двуцепочечных молекул) или основание (для одноцепочечных молекул). Например, хромосома Escherichia coli состоит из
4 106 пар оснований и имеет молекулярную массу 3 109 Да и длину 1.5 мм.
Геномная ДНК клетки человека состоит из 3900 106 пар оснований, а ее длина составляет 990 мм.
ГЕТЕРОЦИКЛИЧЕСКИЕ ОСНОВАНИЯ
Одним из важнейших компонентов нуклеиновых кислот являются гетероциклические основания. Все они представляют собой производные пиримидина и пурина. В подавляющем большинстве случаев нуклеиновые кислоты содержат урацил (встречается только в РНК), тимин (только в ДНК), цитозин, аденин и гуанин. В соответствии с принятой номенклатурой основания могут записываться трехбуквенным кодом, представляющим три первые буквы их латинского названия (приведены в скобках).
5
http://www.mitht.ru/e-library
Основания пиримидинового ряда |
|
|
|
|
|
NH2 |
|||||
3 |
4 |
5 |
3 |
O |
|
3 |
O |
|
|
|
|
N |
|
|
|
5 Me |
3 |
N |
4 |
||||
|
|
HN 4 5 |
HN 4 |
5 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 N |
6 |
2 |
N |
6 |
2 |
N |
6 |
O |
2 |
N 6 |
|
|
1 |
|
O |
|
O |
1 |
|||||
|
|
|
1 |
H |
|
1 |
H |
|
|
H |
|
Пиримидин |
Урацил (Ura) |
Тимин (Thy) |
Цитозин (Cyt) |
||||||||
Основания пуринового ряда
Пурин |
Аденин (Ade) |
Гуанин (Gua) |
Редкие (минорные) основания
Помимо пяти основных гетероциклических оснований в состав нуклеиновых кислот могут входить и другие молекулы. В случае ДНК редкими компонентами являются метилированные основания
5-метилцитозин, 6-N-метиладенин или 6-N,N-диметиладенин. В ДНК некоторых бактериофагов встречается 5-гидроксиметилцитозин. РНК также содержит минорные компоненты, которые в большей степени встречаются в транспортных РНК.
6
6. Гидролиз N-гликозидных связей
N-Гликозидные связи нуклеозидов весьма устойчивы в нейтральных и щелочных средах и расщепляются при этих значениях рН только в жестких условиях. Однако N-гликозидные связи относительно лабильны в кислой среде (гидролиз хлорной кислотой в течение 1 ч при 100 С). При этом скорость гидролиза соединений дезокси-ряда на 2-3 порядка выше скорости гидролиза соединений рибо-ряда. N-гликозидные связи пуриновых оснований значительно лабильнее пиримидиновых, что лежит в основе метода селективного расщепления молекул ДНК по пуриновым звеньям – апуринизация – получившего широкое распространение в структурных исследованиях.
РЕАКЦИИ ПРОТЕКАЮЩИЕ С УЧАСТИЕМ УГЛЕВОДНОГО И
ГЕТЕРОЦИКЛИЧЕСКОГО ФРАГМЕНТОВ
Циклонуклеозиды являются предшественниками фтор-, амино-,
азидозамещенных нуклеозидов, которые находят широкое применение в изучении пространственной структуры РНК, создании антисмысловых олигонуклеотидов, рибозимов, а также соединений с потенциальной биологической активностью. Впервые циклонуклеозиды были получены А.
Тоддом в качестве побочных продуктов при трансформации 5'-O-ацетил-2’-
27
http://www.mitht.ru/e-library
гидроксильными группами, что расширяет стратегические возможности избирательной защиты ОН-групп углеводов. Пентофуранозы дают 3,5-О-
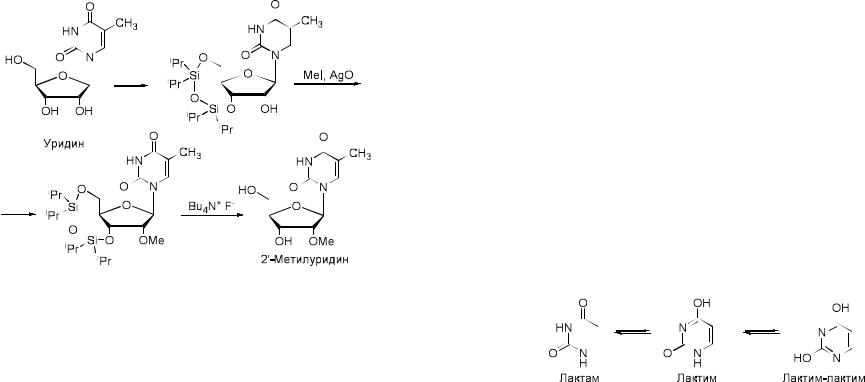
силильные производные, оставляя другие гидроксильные группы свободными для дальнейших модификаций. Удаление силильной защиты достигается действием тетрабутиламмоний фторида. Используя реагент Маркевича можно получать 2’-метилнуклеозиды.
5. Получение 2’,3’-дидезоксинуклеозидов
2’,3’-Дидезоксинуклеозиды были впервые получены А. Тоддом в 1950-
х годах. Позднее для синтезированных соединений была обнаружена противовирусная активность, особенно в отношении ВИЧ-инфекции
(2’,3’-дидезоксицитидин и 2’,3’-дидезоксиинозин). Также
2’,3’-дидезоксинуклеозиды нашли широкое применение в определении нуклеотидной последовательности по методу Сэнгера.
Использование гликозилирования для получения данного класса соединений приводит к образованию аномерной смеси α- и β-нуклеозидов,
поэтому был предложен метод синтеза 2’,3’-дидезоксинуклеозидов через соответсвующие 2’,3’-дидегидро-2’,3’-дидезоксинуклеозиды.
26
Конформация гетероциклических оснований
По данным рентгеноструктурного анализа отклонения от средней плоскости кольца некоторых атомов гетероциклических оснований и экзо-
циклических заместителей незначительно (не более 0.01 нм), то есть основания практически плоские. Исключение представляет
5,6-дигидроурацил, у которого атомы углерода С-5 и С-6 выведены из плоскости цикла.
Свойства гетероциклических оснований
1.Гетероциклические основания не заряжены в физиологическом диапазоне значений рН (от рН 5 до рН 9).
2.Пиримидиновые и пуриновые основания могут существовать в различных таутомерных формах в зависимости от значения рН. Например, в
нейтральных условиях для урацила и тимина характерна кето-енольная таутомерия и существование трех форм: лактам, лактим и лактим-лактим;
предпочтительной является форма лактама.
Кето-енольная таутомерия
Енамин-кетиминная таутомерия присуща гетероциклическим основаниям со свободной экзоциклической аминогруппой, а предпочтительной формой является енамин.
7
http://www.mitht.ru/e-library
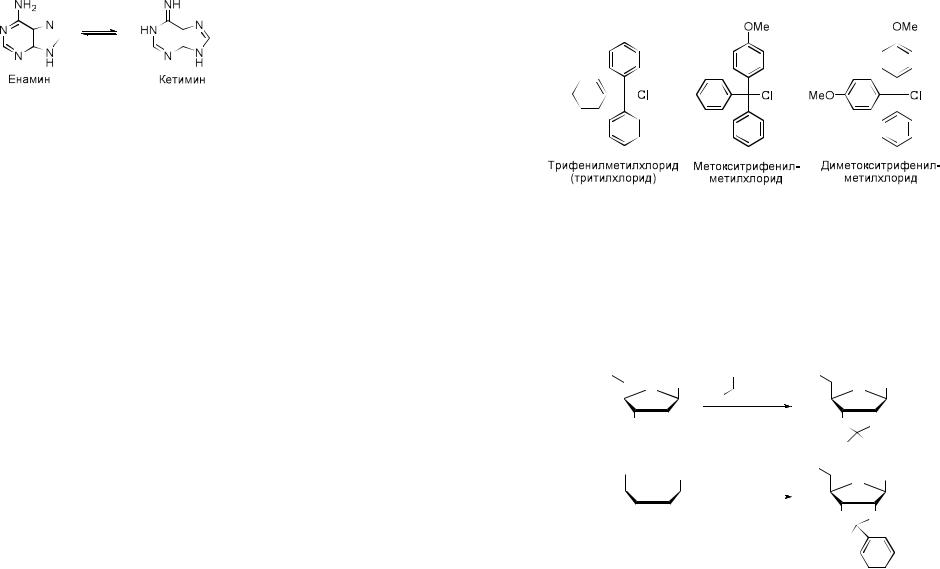
Енамин-кетиминная татомерия
3.Гетероциклические основания поглощают ультрафиолетовый свет в диапазоне 240-280 нм, что может быть использовано для количественного определения оснований.
4.Гидрофобные пуриновые и пиримидиновые основания обладают плохой растворимостью в воде при значении рН близком к нейтральному.
Гидрофобные стекинг-взаимодействия, когда две и более молекул оснований в водной среде располагаются подобно стопке монет, являются одним из главных неспецифических типов взаимодействий в нуклеиновых кислотах. Стекинг-взаимодействия помогают основаниям минимизировать контакт с водной средой и стабилизируют трехмерную структуру кислот.
НУКЛЕОЗИДЫ
В составе нуклеиновых кислот гетероциклические основания связаны с остатком углевода D-рибозы в случае РНК или с 2-дезокси-D-рибозы в случае ДНК, образуя соединения, называемые соответственно
рибонуклеозидами или дезоксирибонуклеоизидами. С помощью периодатного окисления было показано, что оба углевода находятся в циклической фуранозной форме.
8
раз ускоряет деблокирование гидроксильной группы, которое проходит под
действием кислот.
3. Взаимодействие с карбонильными соединениями
Рибонуклеозиды легко вступают в реакцию с альдегидами и кетонами в присутствии кислотных катализаторов, при этом образуются циклические ацетали или кетали. Для защиты вицинальных цис-диольных групп рибонуклеозидов используют взаимодействие с ацетоном или бензальдегидом. Циклические производные легко расщепляются в слабокислой среде.
HO |
B |
O |
HO |
|
B |
|||
O |
+ |
|
|
O |
||||
|
|
Me |
Me, H |
|
|
|
|
|
OH |
OH |
|
|
O |
|
O |
||
|
|
|
|
|
|
Me |
|
Me |
HO |
B |
|
|
|
HO |
|
B |
|
O |
PhCHO, H+ |
|
O |
|||||
OH |
OH |
|
|
|
O |
|
O |
|
|
|
|
|
|
|
H |
|
|
4. Взаимодействие с силильными производными
1,3-Дихлор-1,1,3,3-тетраизопропилдисилоксан (реагент Маркевича) как бифункциональный реагент может одновременно реагировать с двумя
25
http://www.mitht.ru/e-library
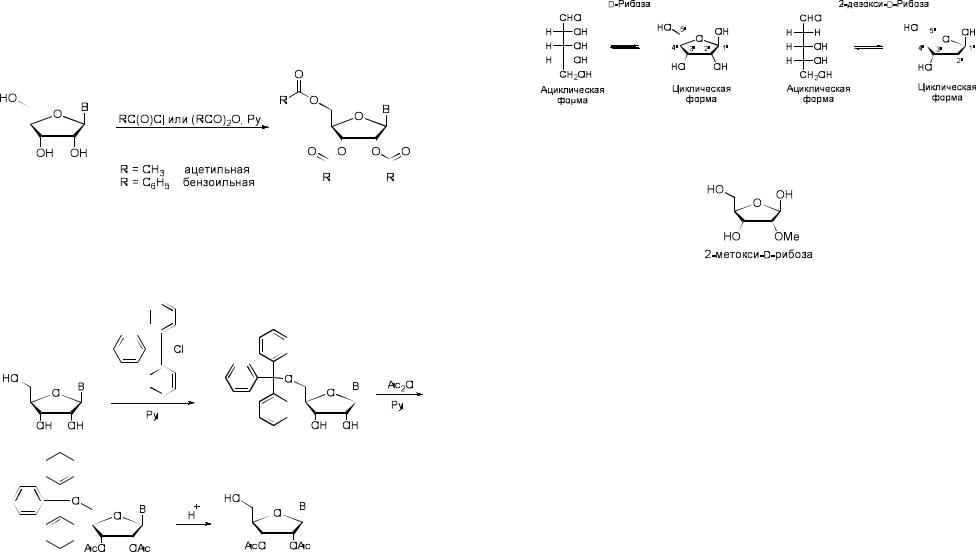
бензойной кислот. В случае цитидина ацилируется его экзоциклическая аминогруппа. Избирательного ацилирования гидроксильных групп можно достичь проведением процесса в ледяной уксусной кислоте.
Из алкилирующих агентов наиболее широкое применение нашли трифенилхлорметан (тритилхлорид) и его производные, селективно взаимодействующие с первичными гидроксильными группами углеводного остатка.
Чаще всего для блокирования 5’-гидроксильных групп используются монометокси- и диметокситрифенилметильные производные. Образуемые ими эфиры гидролизуются в значительно более мягких условиях, чем трифенилметильные. Введение каждой метоксильной группы примерно в 10
24
В качестве минорного углевода в рибосомальных РНК встречается
2-метокси-D-рибоза приблизительно с частотой 1/100 остатков.
Строение нуклеозидов
При доказательстве химического строения нуклеозидов определяются тип гетероциклического основания, природа углеводного компонента, место присоединения его к основанию и конфигурация гликозидного центра.
Тип гетероциклического основания можно определить после жесткого кислотного гидролиза нуклеозидов путем сравнения хроматографических характеристик продуктов гидролиза с референтными образцами гетероциклических оснований, а также с привлечением методов УФ-, ИК- и
ЯМР-спектроскопии.
Идентификация углеводных компонентов проводится после кислотного гидролиза. При этом из пуриновых или предварительно гидрированных по
5,6-двойной связи пиримидиновых рибонуклеозидов образуется D-рибоза. 2-Дезокси-D-рибозу удается выделить только после мягкого кислотного гидролиза, так как дезоксирибонуклеотиды расщепляются гораздо быстрее рибонуклеозидов.
9
http://www.mitht.ru/e-library
Возможность отщепления гетероциклического основания от углевода в условиях мягкого кислотного гидролиза позволила предположить, что нуклеозиды представляют собой N-гликозиды, причем в образовании гликозидной связи участвует один из гетероциклических атомов. С
помощью физико-химических методов анализа было установлено, что в случае пуринов основание соединено с углеводом атомом азота N-9, а в случае пиримидинов – атомом N-1.
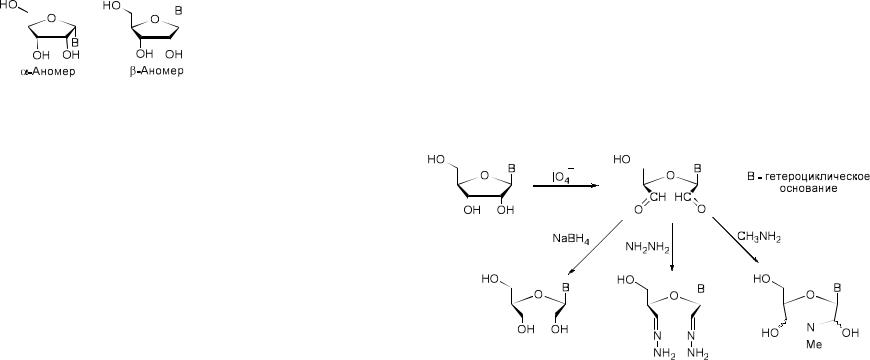
Наличие в циклической форме углевода асимметрического (С-1’) атома углерода обуславливает возможность существования двух различных стереоизомеров.
Стереоизомеры, отличающиеся только конфигурацией гликозидного центра (конфигурация при атоме С-1’), называются аномерами. В
нуклеиновых кислотах D-рибоза и D-дезоксирибоза имеют β–конфигурацию аномерного центра.
Номенклатура нуклеозидов
Согласно правилам ИЮПАК для обозначения компонентов нуклеиновых кислот используются трехбуквенные и однобуквенные символы. Трехбуквенные символы применяются при описании химических процессов, в которые вовлечены гетероциклические основания, нуклеозиды,
нуклеотиды и небольшие олигонуклеотиды. Однобуквенные символы можно использовать только для записи олигонуклеотидов, полинуклеотидов,
их фрагментов или нековалентных структур. Однобуквенные символы не могут использоваться для обозначения нуклеозидов или мононуклеотидов.
Дезоксирибонуклеозиды отличаются от рибонуклеозидов добавлением к
10
фиксации одноцепочечных участков нуклеиновых кислот при изучении их с
помощью электронной микроскопии.
ХИМИЧЕСКАЯ МОДИФИКАЦИЯ УГЛЕВОДНОГО
ФРАГМЕНТА
Углеводно-фосфатный остов определяет конформацию и физико-
химические свойства нуклеиновых кислот.
1. Окисление
Окисление цис-гликольной группы в рибонуклеозидах находит широкое применение в химии нуклеиновых кислот. Реакция проходит под действием солей йодной кислоты и приводит к образованию реакционноспособного диальдегида, который может быть восстановлен до диолов. Также диальдегид может вступать во взаимодействие с гидразидами,
давая гидразоны, и реагировать с первичными аминами с образованием циклических производных.
2. Ацилирование и алкилирование
Гидроксильные группы углеводного остатка легко ацилируются при
действии на нуклеозиды ангидридов или хлорангидридов уксусной или
23
http://www.mitht.ru/e-library
