
Основы химии нуклеиновых кислот. Нуклеозиды
.pdf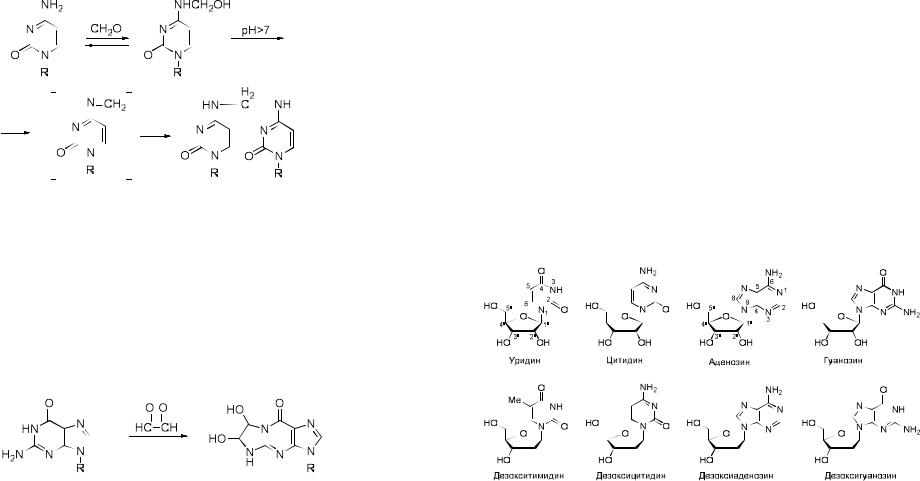
реагировать с экзоциклической аминогруппой другого нуклеозида, давая стабильное бис-(нуклеозидил)метиленовое производное.
При взаимодействии формальдегида с РНК и последующем щелочном гидролизе образуются следующие типы кросс-связанных продуктов: pAdo- CH2-pAdo, pAdo-CH2-pGuo and pGuo-CH2-pGuo.
Широко применяется реакция оснований нуклеиновых кислот с
α-дикарбонильными соединениями, такими, как глиоксаль. Аденин и цитозин при этом дают аминометилольные производные, а гуанин образует трициклический продукт за счет конденсации амино- и иминогрупп с обеими карбонильными группами глиоксаля.
трехбуквенным и однобуквенным символам префикса d. Для обобщенного обозначения любого нуклеозида применяется символ N, для
пиримидинового нуклеозида символ Y, пуринового – R.
Основа- |
Углевод |
Нуклеозид |
Трехбук- |
Однобук- |
ние |
|
|
венный |
венный |
|
|
|
символ |
символ |
Урацил |
D-рибоза |
Уридин |
Urd |
U |
(Ura) |
2-дезокси-D-рибоза |
Дезоксиуридин |
dUrd |
dU |
Цитозин |
D-рибоза |
Цитидин |
Cyd |
C |
(Cyt) |
2-дезокси-D-рибоза |
Дезоксицитидин |
dCyd |
dC |
Тимин |
D-рибоза |
Риботимидин |
Thd |
T |
(Thy) |
2-дезокси-D-рибоза |
Дезокситимидин |
dThd |
dT |
|
|
(Тимидин) |
|
|
Аденин |
D-рибоза |
Аденозин |
Ado |
A |
(Ade) |
2-дезокси-D-рибоза |
Дезоксиаденозин |
dAdo |
dA |
Гуанин |
D-рибоза |
Гуанозин |
Guo |
G |
(Gua) |
2-дезокси-D-рибоза |
Дезоксигуанозин |
dGuo |
dG |
Реакция нуклеиновых кислот с глиоксалем может рассматриваться как специфическая по отношению к гуаниновым звеньям; скорость ее взаимодействия с одноцепочечными полинуклеотидами значительно выше,
чем с двухцепочечными. Реакции с альдегидами широко используется для
22
ХИМИЧЕСКАЯ МОДИФИКАЦИЯНУКЛЕОЗИДОВ
Модифицированные нуклеозиды широко представлены в природе.
Например, все типы транспортной РНК содержат минорные основания, а
большинство бактерий и грибов являются источником нуклеозидов
11
http://www.mitht.ru/e-library

модифицированных как по основанию, так и по углеводному фрагменту.
Такие нуклеозиды, как оказалось, проявляют широкий круг биологической активности, что явилось стимулом к синтезу модифицированных нуклеозидов в химических лабораториях по всему миру. В настоящее время арабиноаналоги аденозина и цитидина используются в качестве противоопухолевых и противовирусных препартов, а 5-йодуридин применяется для лечения герпесной инфекции глаз.
Нуклеозиды представляют собой полифункциональные соединения, в
структуре которых присутствуют гидроксильные и аминогруппы, а также гетероциклические атомы азота гетероцикла, которые под действием различных химических агентов могут подвергаться химической модификации. Особую важность приобретает селективная модифицикация нуклеозидов по определенным функциональным группам или структурным фрагментам, позволяя в дальнейшем установить первичную и пространственную структуры нуклеиновых кислот, проводить искусственные мутации и изучать взаимосвязь между структурой и функцией нуклеиновых кислот.
ХИМИЧЕСКАЯ МОДИФИКАЦИЯПО ГЕТЕРОЦИКЛИЧЕСКИМ
ОСНОВАНИЯМ
1. Модификация по остаткам урацила и цитозина.
Гидразин, его алкильные и ацильные производные, а также гидроксиламин и его О-алкильные производные широко применяются в исследованиях нуклеиновых кислот. В водных растворах при кислых значениях pH эти реагенты специфично взаимодействуют с производными цитозина.
В случае гидразина и его производных наблюдается лишь замещение аминогруппы, тогда как производные гидроксиламина одновременно присоединяются по двойной связи, образуя аддукт.
12
8. Получение тиопроизводных нуклеозидов
Олигонуклеотиды, содержащие тиогуанин, широко используются для изучения взаимодействий РНК или ДНК с белками. Спектральные характеристики тиогуанина (поглощение при 340–350 нм) позволяет его использовать в качестве спектрального зонда при изучении конформационных переходов, а фотоактивация приводит к образованию кросс-связей между фрагментами нуклеиновых кислот, что необходимо для изучения их трехмерных структур.
|
|
O |
|
|
|
|
|
|
|
N |
|
|
|
N |
NH |
|
|
|
|
|
|||
|
|
|
|
|
N |
|
|
||||
HO |
|
N N |
|
NH2 |
(CF3CO)2CO, Py |
O |
NH |
O |
|||
|
|
|
|
|
F3C O |
N |
|
CF3 |
|||
|
|
O |
|
|
|
|
|
N NH |
|||
|
|
|
|
|
|
|
|
O |
O |
|
|
|
OH |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
2-дезоксигуанозин |
|
|
|
S |
F3C |
O |
|
|
|||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
N |
NH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1. NaSH |
|
HO |
N N |
NH2 |
|
|
|
||
|
|
2. NH4OH |
|
|
|
|
|||||
|
|
|
|
|
O |
|
|
|
|
||
OH 2-дезокситиогуанозин
9. Взаимодействие с альдегидами
Реакция аминогрупп гетероциклических оснований нуклеиновых кислот с формальдегидом приводит к образованию аминометилольных соединений. Данная реакция обратима: при удалении формальдегида из реакционной смеси и даже при ее разбавлении наблюдается быстрая регенериция исходных продуктов. В щелочной среде метилольное соединение через промежуточно образующееся основание Шиффа может
21
http://www.mitht.ru/e-library
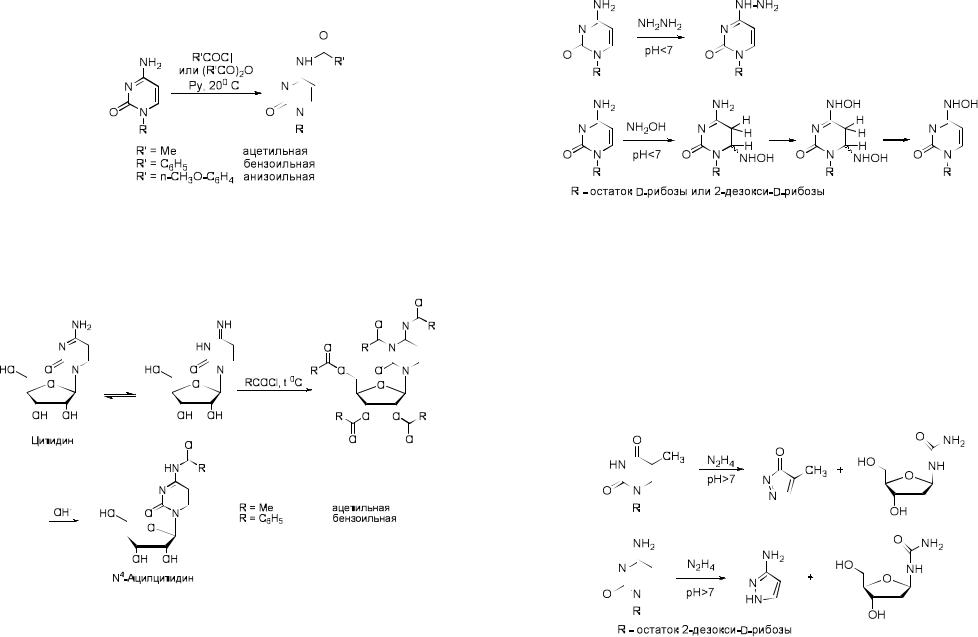
очередь ацилируются экзо-циклические аминогруппы аденина, гуанина и цитозина.
В жестких условиях (при нагревании) по гетероциклическому основанию происходит введение двух ацильных остатков, а последующий мягкий щелочной гидролиз приводит к образованию моноацильного производного нуклеозида.
20
В щелочных условиях реакции с гидразином и гидроксиламином приводят к расщеплению гетероциклических колец пиримидинов,
практически не затрагивая пуриновых оснований. Реакция ДНК с гидразином, сопровождающаяся расщеплением по пиримидиновым звеньям,
используется при определении нуклеотидной последовательности ДНК в методе Максама-Гилберта. При анализе первичной структуры нуклеиновых кислот для специфического расщепления по урацильным или цитозиновым звеньям может быть использована также и реакция с гидроксиламином в щелочной среде.
13
http://www.mitht.ru/e-library
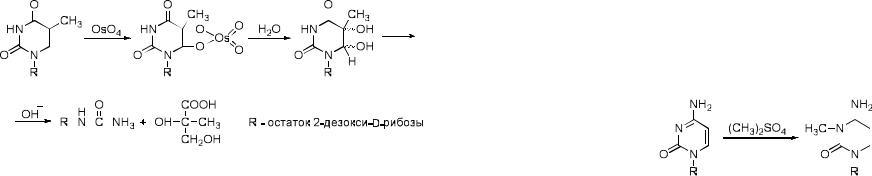
2. Селективная модификация тимидина
Реакция с OsO4, широко применяемая в органической химии для гидроксилирования двойных связей, гладко протекает и в случае пиримидиновых оснований. Скорость реакции возрастает в ряду T > U > C.
Так, тимидин реагирует почти на два порядка быстрее цитидина и в 10 раз быстрее уридина. Поэтому ее можно рассматривать как специфический метод модификации тимидина. Диольные соединения образуются также при взаимодействии пиримидиновых оснований и с такими окислителями как
KMnO4, H2O2. однако, в этом случае быстро происходит разрушение цикла.
Реакция с OsO4 может использоваться для установления положения тимидиновых звеньев при определении первичной структуры ДНК методом Максама-Гилберта.
3. Галогенирование нуклеозидов
Одним из распространенных методов модификации оснований в нуклеиновых кислотах является галогенирование. Уридин, цитидин и их аналоги можно трансформировать в галогенпроизводные, используя бромную воду. В ходе этого превращения образуется 5-бром-6-гидрокси- 5,6-дигидропиримидиновое производное, дегидратация которого приводит к образованию 5-бромзамещенного нуклеозида.
14
В ДНК метилированию подвергаются атомы N-1 и N-3 аденина,
выходящие в малую бороздку В-формы ДНК, и в большей степени атомы
N-7 гуанина, выходящие в большую бороздку. Основания двухцепочечных ДНК, метилированные по атомам N-3 и N-7, продолжают образовывать комплементарные пары, но эффективность их взаимодействия понижается.
7-N-метилгуанин и 3-N-метиладенин легко отщепляются от полидезоксинуклеотидной цепи в результате гидролиза N-гликозидных связей. Далее полинуклеотидная цепь может быть легко расщеплена по модифицированному звену действием щелочи или аминов. Такой метод деградации используется для определения последовательности ДНК
(локализация гуаниновых и адениновых звеньев по методу Максама-
Гилберта).
Единственным продуктом метилирования цитозина является
3-метилцитозин.
Большинство алкилирующих агентов являются первичными канцерогенами – веществами, которые воздействуют напрямую на нуклеиновые кислоты, не требуя предварительной биохимической активации, поэтому при работе с ними необходимо строго соблюдать правила техники безопасности.
7. Ацилирование
В реакцию ацилирования под действием ангидридов и галогенангидридов органических кислот вступают как амино- и
иминогруппы, так и гидроксильные группы углеводных остатков. В первую
19
http://www.mitht.ru/e-library

применяют «мягкие» алкилирующие агенты, такие как диметилсульфат,
метилметансульфонат или метилйодид, которые взаимодействуют с гетероциклическими основаниями по механизму SN2. Алкилирование N-
нитрозо-N-метилмочевиной протекает по механизму SN1 и может затрагивать гидроксильные группы углеводного фрагмента.
Наиболее хорошо изучено взаимодействие нуклеиновых кислот и их компонентов с диметилсульфатом (CH3)2SO4. Эта реакция протекает в мягких условиях в водных растворах. Направление реакции алкилирования определяется природой гетероцикличекого основания и условиями эксперимента. Гуаниновое кольцо в нейтральной среде алкилируется преимущественно по атому N-7, а в щелочной – по атому N-1.
Исчерпывающее метилирование приводит к 1,7-диметилгуанину.
В аденине и его производных все три атома могут подвергаться метилированию, однако скорость реакции убывает в ряду N-1 > N-7 > N-3.
18
Низкая реакционная способность йода требует присутствия кислоты в реакционной смеси, что может приводить к нежелательному гидролизу гликозидной связи, поэтому для введения атома йода используют альтернативные реагенты - ICl or N-йодсукцинимид/дибутилсульфид.
Галогенирование по атому С-8 пуриновых нуклеозидов может быть осуществлено как при помощи бромной воды в присутствии кислоты, так и при помощи N-бромсукцинимида. Другие атомы галогенов вводятся с использованием соответствующих N-галогенсукцинимидов.
Для 5-галогенпиримидинов характерна разнообразная биологическая активность. 5-Йод-2-дезоксиуридин был синтезирован в 1960-х годах и является первым антивирусным коммерческим препаратом для борьбы с вирусом герпеса и ветряной оспы. Механизм действия данного нуклеоизида до сих пор не выяснен, однако известно, что он встраивается в вирусную ДНК и нарушает процессы жизнедеятельности вируса.
15
http://www.mitht.ru/e-library

4. Реакция пиримидиновых оснований с бисульфитом натрия.
Бисульфит-ион способен обратимо присоединяться к С(5)-С(6)-
двойным связям цитозина, урацила и тимина в мягких условиях, образуя соответствующий аддукт, неустойчивый в случае тимина; практическое значение имеют только реакции с урацилом и цитозином. Продукты присоединения к урацилу и цитозину довольно стабильны в нейтральной и кислой средах, но отщепляют бисульфит-ион в щелочной среде.
Важным свойством 5,6-дигидропроизводных цитозина указанного типа является повышенная реакционноспособность аминогруппы, которая легко замещается под действием различных нуклеофильных агентов. Замещение аминогруппы на гидроксигруппу приводит к производному урацила,
которое легко превращается в урацил при слабоосновных значениях pH.
Таким образом, эта реакция дает возможность специфического преобразования цитозиновых колец в урацильные. Модификация нуклеиновых кислот бисульфитом часто используется как способ введения мутационных замен. С этой целью участок ДНК, выбранный для введения
мутаций, превращают в одноцепочечный и затем обрабатывают
16
бисульфитом в условиях неполного дезаминирования. Таким образом,
например, пары G-C могут быть заменены на пары A-T. Специфичность к вторичной структуре используется также для анализа пространственного строения полинуклеотидов. Так, обработка тРНК бисульфитом приводит к модификации только цитозиновых оснований, находящихся в петлях.
5. Меркурирование
Широко распространенная в органической химии реакция непредельных соединений с ацетатом ртути (или хлоридом ртути) в случае нуклеиновых кислот проходит в мягких условиях (вода, pH 6.0-7.0, 40-50 ºС)
и специфична по отношению к пиримидиновым основаниям. Результатом является образование производных 5-ацетоксимеркуриоурацила и
5-ацетоксимеркуриоцитозина.
5-Меркуриопроизводные вследствие легкого обмена атома ртути на атомы галогена или трития используются для получения специфически меченных пиримидиновых оснований нуклеиновых кислот.
6. Алкилирование
Большое значение в химии нуклеиновых кислот имеет реакция алкилирования. С одной стороны, многие алкилирующие агенты являются мутагенами и канцерогенами, а, с другой стороны, реакции аликилирования,
осуществляемые в мягких условиях, широко используются для исследования строения и функций полинуклеотидов. Для алкилирования
17
http://www.mitht.ru/e-library
