4.Обсуждение результатов
Как указывалось в обзоре литературы, основным методом синтеза 1,1-диамино-2,2-динитроэтилен является нитрование азотистых гетероциклов, содержащих в цикле фрагмент –NH-C(CH3)R-NH-, где R=H,CH3, ОСН3, до гемдинитросоединений с последующим их гидролизом. В качестве исходных веществ в этом методе чаще всего используют 2-метилимидазол, 2-метил-2-метоксиимидазолидинон-4,5-дион и 6-гидрокси-2-метилпиримидин-4(3Н)-он.
На первом этапе работы был проведен выбор исходного вещества для дальнейшего нитрования. Так как выход целевого продукта из 2-метил-имидазола по литературным данным [2] невелик, то выбор производился между 2-метил-2-метоксиимидазолидинон-4,5-дионом и 6-гидрокси-2-метилпиримидин-4(3Н)-оном. Для этого был осуществлен их синтез по описанным в литературе [21,23] методикам.
В начале работы по прописи [27] был синтезирован солянокислый ацетамидин, являющийся исходным продуктом для получения 2-метил-2-метоксиимидазолидинон-4,5-диона и 6-гидрокси-2-метилпиримидин-4(3Н)-она. Выход составил 50%, что несколько меньше описанного ранее (80-90%). По нашему мнению, это связано с использованием недостаточно осушенных реактивов.
Далее из солянокислого ацетамидина были синтезированы 6-гидрокси-2-метилпиримидин-4(3Н)-он и 2-метил-2-метокси-имидазолидин-4,5-дион. Обе реакции однотипны и основываются на проведении циклизации в среде метанола в присутствии метилата натрия.
Для получения 6-гидрокси-2-метилпиримидин-4(3Н)-она была проведена конденсация ацетамидина с диэтилмалонатом (схема 4.1).
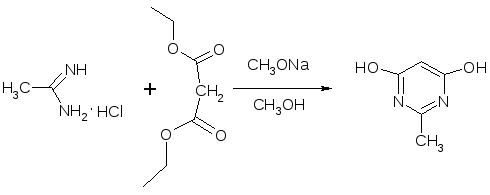
Схема 4.1
Для достижения высокого выхода необходимо применять свежеприготовленный раствор метилата натрия, т.к. при использовании товарного продукта выход едва превышал 50%. Так при использовании свежеприготовленного метанольного раствора метилата натрия с концентрацией 104 г/л достигнут выход 96%, что совпадает с описанным в литературе. Следует отметить простоту выделения целевого вещества. Благодаря низкой растворимости в реакционной массе и в воде, его выделение осуществляли фильтрованием с последующей водной промывкой для удаления хлорида натрия. Полученный продукт имеет чистоту не ниже 99% (по ПМР) и может быть использован без дополнительной очистки.
Синтез 2-метил-2-метоксиимидазолидин-4,5-диона осуществляли, согласно схеме 4.2, путем конденсации ацетамидина с диэтилоксолатом. (поменял местами со схемой)
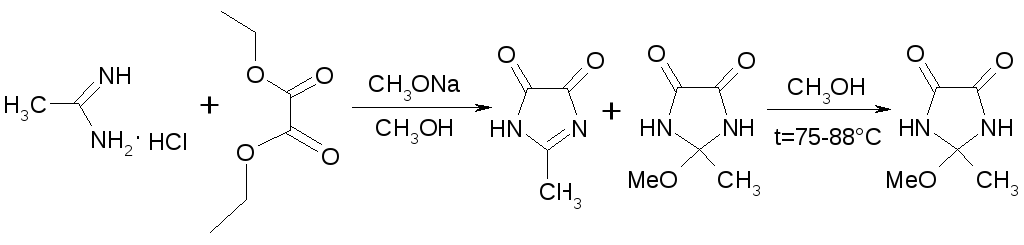 Схема
4.2
Схема
4.2
В этом случае при использовании раствора метилата натрия в метаноле с концентрацией 103 г/л выход целевого продукта составил 46,5 %, что ниже приведённого в литературе [21], где выход составляет 64%. Однако даже последний существенно хуже чем при синтезе 6-гидрокси-2-метилпиримидин-4(3Н)-он. Необходимо отметить, что и выделение целевого соединения в этом случае значительно сложнее. Во-первых, после проведения циклизации образуется смесь 2-метил-2-метоксиимидазолидин-4,5-диона и 2-метил-имидазол-4,5-диона и для завершения реакции требуется дополнительное кипячение в метаноле. Во-вторых, высокая растворимость конечного продукта, как в метаноле, так и воде, приводит к необходимости полной отгонки растворителя из реакционной массы с последующим разделением полученной смеси. Полученное соединение имеет чистоту менее 90% (ПМР) и требует дополнительной очистки.
В связи с низкой технологичностью и меньшим выходом 2-метил-2-метоксиимидазолидин-4,5-диона было принято решение проводить дальнейшие исследования на основе 6-гидрокси-2-метилпиримидин-4(3Н)-она.
Чистота и строение далее используемого 6-гидрокси-2-метилпиримидин-4(3Н)-она подтверждены данными ПМР- и ИК- спектроскопии. В ПМР-спектре присутствуют два сигнала. Сигнал 2,2 м.д. относится к атомам водорода метильной группы, а сигнал 5,0 м.д. - к атому водорода, находящемуся в положении 5. Соотношение интегралов 3 к 1. В ИК- спектре наблюдаются поглощение следующих функциональных групп: 3079 см-1 – NH, 2500-2800 см-1 – OH, 1896 см-1, 1600-1700 см-1 – C=O. На основании этих данных был сделан вывод о том, что 6-гидрокси-2-метилпиримидин-4(3Н)-он существует в кетогидроксиформе (рисунок 4.1), а не в дикето-, или дигидроксиформе, как указывают в [20,21,23] и [22] соответственно.
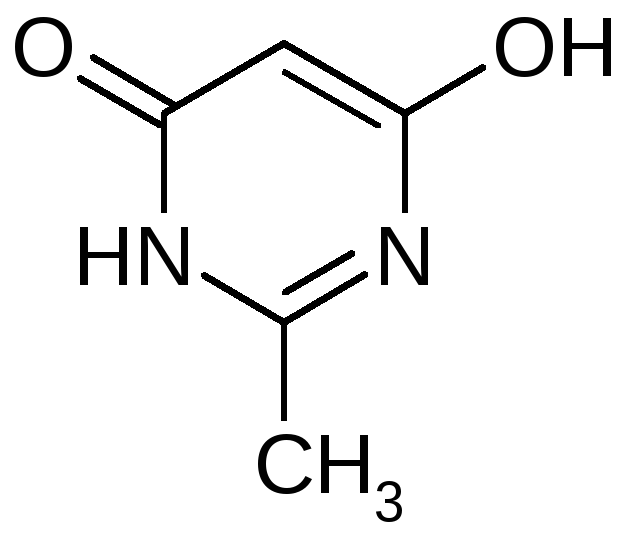
Рисунок 4.1
По литературным данным [23] процесс получения 1,1-диамино-2,2-динитроэтилена из 6-гидрокси-2-метилпиримидин-4(3Н)-она может быть представлен схемой 4.3.
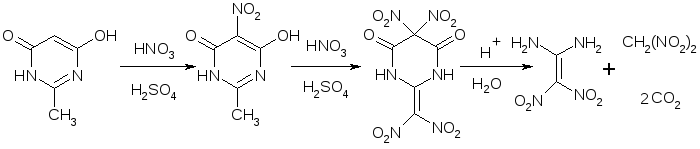 Схема
4.3
Схема
4.3
Она включает в себя минимум три стадии. Поэтому для проведения качественного и количественного анализа реакционных масс по описанным методикам были синтезированы промежуточные и конечный продукты, а именно: 6-гидрокси-2-метил-5-нитропиримидин-4(3Н)-он [22], 2-(динитрометилен)-5,5-динитропиримидин-4,6-(1Н,3Н,5Н)-дион [22] и динитрометан. Строение полученных соединений подтверждено данными ИК- и ПМР- спектроскопии.
По нашим данным мононитропроизводное находится в кето-гидрокси форме и имеет структуру 6-гидрокси-2-метил-5-нитропиримидин-4(3Н)-она. В ПМР- спектре присутствует синглет при 2.32 мд 3 Н, относящийся к атомам водорода метильной группы, и два размытых сигнала: 3.4 мд, 1Н и 13.2 м.д, 1 Н, которые могут быть отнесены к О-Н и N-H протонам соответственно. В ИК спектре присутствуют полосы колебаний следующих функциональных групп: 3611 см-1 - N-H, широкая полоса в районе 2500-3000 см-1 – О-Н (атом водорода которой находятся во взаимодействии с нитрогруппой), 1695 см-1 – С=О и 1613 см-1, 1368 см-1 (симметричных и антисимметричных колебания нитрогруппы). Структура тетранитропроизводного в виде 2-(динитрометилен)-5,5-динитропиримидин-4,6-(1Н,3Н,5Н)-диона подтверждена данными ИК спектроскопии. Присутствуют полосы колебаний следующих функциональных групп: 3163 см-1 - NH, 1785 и 1751 см-1 – С=О, колебания четырёх нитрогрупп характеризуются пиками в области от 1245 до 1616 см-1.
В [22] сообщается о низкой стабильности тетранитропроизводного; авторы сообщают, что оно разлагается при комнатной температуре за несколько часов. Для более надежной оценки его термостабильности был проведен анализ методом ДСК, который зафиксировал температуру разложения 117 °С (рисунок 4.2). Однако на открытом воздухе наблюдается его достаточно быстрое разложение, кристаллы «расплываются». Возможно этот эффект связан с его гидролизом за счет влаги воздуха.
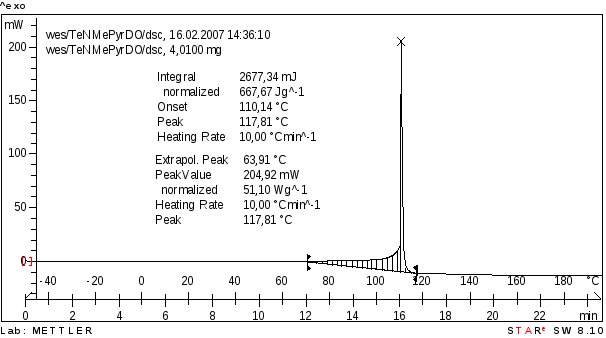
Рисунок 4.2 Данные ДСК анализа 2-(динитрометилен)-5,5-динитропиримидин-4,6-(1Н,3Н,5Н)-диона
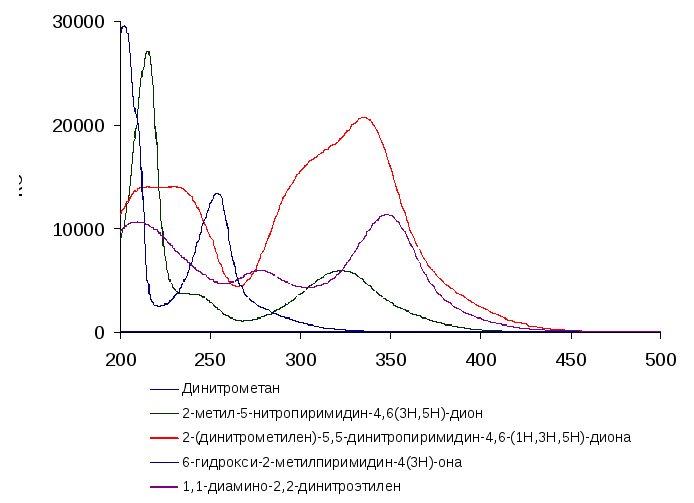
Для полученных соединений в растворе 1,8 % серной кислоты были сняты спектры в ультрафилетовой и видимой областях (рисунок 4.3) и определены коэффициенты экстинкции. Одновременно была оценена стабильность 6-гидрокси-2-метил-5-нитропиримидин-4(3Н)-она, 2-(динитрометилен)-5,5-динитропиримидин-4,6-(1Н,3Н,5Н)-диона, 1,1-диамино-2,2-диаминоэтилена и динитрометана в этой среде.
|
|
|
Рисунок 4.3 УФ-спектры компонентов, присутствующих в смеси при синтезе ДАДНЭ |
На рисунке исправить формулы соединений- ввести дополнительные штрихи . На рисунке только 4 кривых, а соединений 5. Разобраться или убрать пятое вещество с рисунка
Было установлено, что все исследованные растворы за исключением тетранитропроизводного стабильны. Последнее в данных условиях медленно гидролизуется до 1,1-диамино-2,2-диаминоэтилена, однако за 15 минут изменение оптической плотности составило не более 1%, что делает возможным его количественное определение при условии немедленного снятия спектров растворов.
Из рисунка 4.3 видно, что спектры компонентов, могущих присутствовать в реакционной смеси существенно отличаются, поэтому стало возможным определять количественный состава смеси по суммарному спектру. При этом поглощение динитрометана не учитывалось, так как в рабочем диапазоне длин волн (250-500 нм) оно пренебрежимо мало.
Может быть следует привести таблицу с максимумами поглощения и коэффициентами экстинции на максимуме для всех приведенных на рис.4.3 соединений, иначе максимум при 354 нм, на стр 6 не с чем сравнивать.
Состав смеси рассчитывался, используя закон Ламберта-Бугера-Беера и принцип аддитивности оптических плотностей:
Σ Dλ1=Dλ11+Dλ12+Dλ13+Dλ14
Σ Dλ2=Dλ21+Dλ22+Dλ23+Dλ24
……………………………………………
ΣDλn=Dλn1+Dλn2+Dλn3+Dλn4
Dλn =Ci*E λni,где
C-концентрация,
D-оптическая плотность,
E-коэффициент экстинкции i-го компонента на каждой из длин волн
Для увеличения точности расчетов использовали полные спектры в табличном виде в диапазоне 250-500 нм. Решение полученной системы уравнений производилось численным методом.