
ДЗ Химия / Занятие 6
.docЗАНЯТИЕ №6
Методические указания для студентов
по теме «Окисление и восстановление биоорганических соединений»
Цель занятия: Изучить способы и механизмы осуществления окислительно-восстановительных реакций органических веществ в организме человека.
Значение изучения темы: Реакции окисления и восстановления имеют большое значение в качестве ключевых процессов, определяющих метаболизм (катаболизм) пищевых веществ в организме человека. Реакции окислительного гидроксилирования лежат в основе детоксикации ксенобиотиков, в том числе лекарственных веществ.
I. Теоретические вопросы
1. Определение реакций окисления и восстановления. Какие соединения являются окислителем, восстановителем. Окислительно-восстановительные пары.
Конкретные способы передачи электронов в реакциях окисления-восстановления.
-
Одноэлектронный перенос в окислительно-восстановительной паре металлов переменной валентности (Fe2+ - Fe3+, Fe3+ - Fe2+, Cu2+ - Cu+, Mn3+ - Mn2+).
-
Перенос атома водорода (свободнорадикальные реакции окисления, сопровождающиеся гомолитическим разрывом связей)
-
Перенос электронов от донора к акцептору в виде гидридиона Н-.
-
Прямое взаимодействие с кислородом с образованием ковалентных связей с атомом кислорода - на примере реакций эпоксидирования, гидроксилирования (Окисление непредельных соединений).
-
Реакции окисления-восстановления, обратимо протекающие в парах органических кислот (чаще их ионов): сукцинат (янтарная кислота) - фумарат (фумаровая к-та); малат (соль яблочной кислоты) - оксалоацетат (щавелевоуксусная кислота); лактат (молочная) - пируват (пировиноградная), изоцитрат (изолимонная)- оксалосукцинат (2-оксо-3-карбксиглутаровая кислота). Реакции имеют место в цикле Кребса (сопряжены с синтезом АТФ).
-
Реакции обратимого окисления – восстановления тиолов, образование дисульфидов (на примере окисления цистеина в цистин, дигидролипоевой кислоты в липоевую).
-
Окисление аминов. Окислительное дезаминирование, реакции восстановления нитросоединений до аминов.
II. Обучающие упражнения
Задание 1. Способы переноса электронов в окислительно-восстановительных реакциях в биоорганической химии.
Вариант ответа: а) В организме человека одноэлектронный перенос осуществляется в активном центре ферментов (каталазы, гемоглобина, цитохромов, супероксиддисмутаз) в окислительно-восстановительных парах:

При этом восстановитель отдает электроны, окислитель - принимает их.
б) Перенос атома водорода (свободно - радикальные реакции окисления).
Свободно-радикальные процессы окисления, сопровождающиеся переносом водорода, имеют важное значение как реакции неферментативного окисления липидов. Неконтролируемый процесс свободно-радикального окисления липидов ведет к возникновению ряда патологических заболеваний.
в) Перенос электронов от донора к акцептору в виде гидрид-иона Н-.
В результате реакции окисления происходит перенос гидрид-иона от субстрата
согласно схеме:

г) Прямое взаимодействие с кислородом с образованием ковалентных связей с атомом кислорода - на примере реакций эпоксидирования, гидроксилирования

эпоксид гликоль
Задание 2. Показать реакции окислительного дезаминирования аминокислот в общем виде.
Вариант ответа:
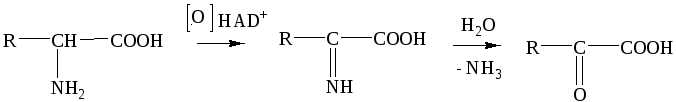
-
аминокислота
имин
кетокислота
III. Задания для самостоятельной работы
Задание 1. Напишите продукты и механизм гидроксилирования фенилаланина. Какое значение имеют реакции гидроксилирования в организме человека?
Задание 2. Написать продукты в следующей цепочке превращений, назвать их.
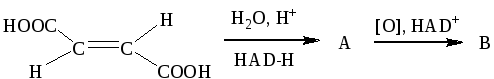
(щавелевоуксусная кислота)
Задание 3. Привести реакции окисления - восстановления в системе органических кислот: фумаровая-янтарная; ацетоуксусная – яблочная; пировиноградная - молочная.
Задание 4. Напишите формулу 2-оксобутандиовой (щавелевоуксусной) кислоты, которая является одним из продуктов углеводного обмена. Напишите схему реакции восстановления кислоты и назовите продукт восстановления.
IV. Выполнение самостоятельной аудиторной работы «Окисление и восстановление биоорганических соединений»
V. Подведение итогов занятия
VI. Домашнее задание: «Важнейшие редокс-системы организма»
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Основная литература
1. Тюкавкина Н.А., Бауков Ю.И. , Зурабян С.Э. .Биоорганическая химия. Учебник. ГЭОТАР-Медиа. 2010 – 416 с.
2. Тюкавкина Н.А., Бауков Ю.И., Зурабян С.Э. .Биоорганическая химия. Учебник. М., ГЭОТАР-Медиа.- 2009 – 416 с.
Дополнительная литература
1. Попков В.А., Пузаков С.А. Общая химия. Учебник для вузов, - М., ГЭОТАР - Медиа, 2007 - 976 с.
2. Биоорганическая химия: руководство к практическим занятиям: учебное пособие / ред. Н.А. Тюкавкина, Бауков Ю.И., Зурабян С.Э. - М., ГЭОТАР - Медиа, 2010 г. – 168 с.
Методическая рекомендация переработана15 января 2012г.
Зав. кафедрой общей Сторожок Н.М.
и биоорганической химии, д.х.н., профессор
