
- •Глава 1. Введение
- •1.1. Термодинамика и ее метод
- •1.2. Параметры состояния
- •1.3. Понятие о термодинамическом процессе
- •1.4. Идеальный газ. Законы идеального газа
- •1.5. Понятие о смесях. Смеси идеальных газов
- •1.6. Понятие о теплоемкости
- •Глава 2. Первый закон термодинамики
- •2.1. Теплота. Опыт Джоуля. Эквивалентность теплоты и работы
- •2.2. Закон сохранения и превращения энергии
- •2.3. Внутренняя энергия и внешняя работа
- •2.4. Уравнение первого закона термодинамики
- •2.5. Энтальпия
- •2.6. Уравнение первого закона термодинамики для потока
- •Глава 3. Второй закон термодинамики
- •3.1. Циклы. Понятие термического КПД. Источники теплоты
- •3.2. Обратимые и необратимые процессы
- •3.3. Формулировки второго закона термодинамики
- •3.4. Цикл Карно. Теорема Карно
- •3.5. Термодинамическая шкала температур
- •3.6. Энтропия
- •3.7. Изменение энтропии в необратимых процессах
- •3.8. Объединенное уравнение первого и второго законов термодинамики
- •3.9. Энтропия и термодинамическая вероятность
- •3.10. Обратимость и производство работы
- •Глава 4. Дифференциальные уравнения термодинамики
- •4.1. Основные математические методы
- •4.2. Уравнения Максвелла
- •4.3. Частные производные внутренней энергии и энтальпии
- •4.4. Теплоемкости
- •Глава 5. Равновесие термодинамических систем и фазовые переходы
- •5.1. Гомогенные и гетерогенные термодинамические системы
- •5.2. Термодинамическое равновесие
- •5.3. Условия устойчивости и равновесия в изолированной однородной системе
- •5.4. Условия фазового равновесия
- •5.5. Фазовые переходы
- •5.7. Устойчивость фаз
- •5.8. Фазовые переходы при неодинаковых давлениях
- •Глава 6. Термодинамические свойства веществ
- •6.1. Термические и калорические свойства твердых тел
- •6.2. Термические и калорические свойства жидкостей
- •6.3. Опыт Эндрюса. Критическая точка. Уравнение Ван-дер-Ваальса
- •6.4. Термические и калорические свойства реальных газов. Уравнения состояния реальных газов
- •6.5. Термодинамические свойства веществ на линии фазовых переходов. Двухфазные системы
- •6.6. Свойства вещества в критической точке
- •6.7. Методы расчета энтропии вещества
- •6.8. Термодинамические диаграммы состояния вещества
- •6.9. Термодинамические свойства вещества в метастабильном состоянии
- •Глава 7. Основные термодинамические процессы
- •7.1. Изохорный процесс
- •7.2. Изобарный процесс
- •7.3. Изотермический процесс
- •7.4. Адиабатный процесс
- •7.5. Политропные процессы
- •7.7. Адиабатное расширение реального газа в вакуум (процесс Джоуля)
- •7.8. Процессы смешения
- •7.9. Процессы сжатия в компрессоре
- •Глава 8. Процессы течения газов и жидкостей
- •8.1. Основные уравнения процессов течения
- •8.2. Скорость звука
- •8.3. Истечение из суживающихся сопл
- •8.4. Переход через скорость звука. Сопло Лаваля
- •8.5. Адиабатное течение с трением
- •8.6. Общие закономерности течения. Закон обращения воздействий
- •8.7. Температура адиабатного торможения
- •9.1. О методах анализа эффективности циклов
- •9.2. Методы сравнения термических КПД обратимых циклов
- •9.3. Метод коэффициентов полезного действия в анализе необратимых циклов
- •Глава 10. Теплосиловые газовые циклы
- •10.1. Циклы поршневых двигателей внутреннего сгорания
- •10.2. Циклы газотурбинных установок
- •10.3. Циклы реактивных двигателей
- •Глава 11. Теплосиловые паровые циклы
- •11.1. Цикл Карно
- •11.2. Цикл Ренкина
- •11.3. Анализ цикла Ренкина с учетом потерь от необратимости
- •11.4. Цикл с промежуточным перегревом пара
- •11.5. Регенеративный цикл
- •11.6. Бинарные циклы
- •11.7. Циклы парогазовых установок
- •11.8. Теплофикационные циклы
- •Глава 12. Теплосиловые циклы прямого преобразования теплоты в электроэнергию
- •12.1. Цикл термоэлектрической установки
- •12.2. Цикл термоэлектронного преобразователя
- •12.3. Цикл МГД-установки
- •Глава 13. Холодильные циклы
- •13.1. Обратные тепловые циклы и процессы. Холодильные установки
- •13.2. Цикл воздушной холодильной установки
- •13.3. Цикл парокомпрессионной холодильной установки
- •13.4. Цикл пароэжекторной холодильной установки
- •13.5. Понятие о цикле абсорбционной холодильной установки
- •13.6. Цикл термоэлектрической холодильной установки
- •13.7. Принцип работы теплового насоса
- •13.8. Методы сжижения газов
- •Глава 14. Влажный воздух
- •14.1. Основные понятия
- •14.2. Н, d-диаграмма влажного воздуха
- •Глава 15. Основы химической термодинамики
- •15.1. Термохимия. Закон Гесса. Уравнение Кирхгофа
- •15.2. Химическое равновесие и второй закон термодинамики
- •15.3. Константа равновесия и степень диссоциации
- •15.4. Тепловой закон Нернста
Глава 7. Основные термодинамические процессы
7.1.Изохорный процесс
7.2.Изобарный процесс
7.3.Изотермический процесс
7.4.Адиабатный процесс
7.5.Политропный процесс
7.6.Дросселирование. Эффект Джоуля-Томсона
7.7.Адиабатное расширение реального газа в вакуум (процесс Джоуля)
7.8.Процессы смешения
7.9.Процессы сжатия в компрессоре

Г л а в а с е д ь м а я
ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
7.1. Изохорный процесс
Рассмотрим основные термодинамические процессы, выясним их закономерности и установим соотношения, связывающие между собой параметры состояния вещества в этих процессах.
Рассмотрим изохорный процесс, осуществляемый от некоторого состояния 1, в котором рабочее тело имеет давление р1, температуру Т1 и объем V, до состоя-
ния 2. (Вид изохор реального газа в р, T-диаграмме изображен на рис. 7.1.) Там же показаны изохоры в р, v-; T, v- и Т, s-диаграммах. Для того чтобы определить параметры состояния 2, нужно знать один из параметров в точке 2 (например, давление р2 или температуру Т2 и т.д.). Поскольку состояние изменяется по
изохоре, следовательно, оказывается заданным еще один параметр состояния — объем V. Зная V и Т2 (или V и р2, или V и S2 и т.д.), с помощью диаграмм состоя-
ния, таблиц термодинамических свойств данного вещества или уравнения состояния можно определить все остальные параметры, характеризующие состояние рабочего тела в точке 2.
Параметры состояния идеального газа на изохоре связаны соотношением (1.16)
p2 |
T2 |
---- |
= ----- . |
p1 |
T1 |
В идеальном газе повышение температуры (нагрев газа) в сосуде постоянного объема всегда приводит к росту давления, причем давление растет тем быстрее, чем меньше значение v на данной изохоре (это следует из гиперболического характера изотермы идеального газа в р, v-диаграмме).
Нагрев реальных газов и жидкостей также приводит к росту давления, причем давление в жидкости растет значительно быстрее, чем в газе (см. р, T-диа- грамму на рис. 7.1).
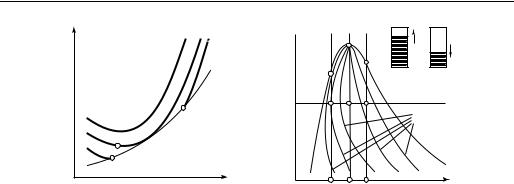
Интересно отметить любопытную особенность, присущую изохорам воды при низких температурах. Как уже отмечалось ранее, при температуре 3,98 °С плотность воды при атмосферном давлении проходит через максимум. Детальное рассмотрение показывает, что в этой области температур изохоры воды имеют вид, показанный на рис. 7.2; изохоры v ≤ 1,000000 мл/г проходят через минимум вблизи точки с температурой 3,98 °С (обозначим точку минимума А), причем изохора v = 1,000000 мл/г касается линии насыщения; слева от точек минимума изохоры имеют отрицательный
наклон, т.е. (∂p ⁄ ∂T)v < 0. Изохоры воды v > 1,000000 мл/г (вплоть до значения v =
= 1,000132 мл/г, соответствующего тройной точке) имеют ту особенность, что дважды пересекают линию насыщения — с положительным и отрицательным наклоном.
p |
Изохоры |
p Изохоры |
T Изохоры |
T |
Изохоры |
|
|
™ |
™ |
|
|
|
|
K |
K |
|
|
|
|
|
|
|
K
K |
T |
v |
v |
s |
Рис. 7.1
215
Г л а в а 7. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
p |
|
|
|
|
Изохоры |
|
|
|
|
|
|
000 |
мл/г |
|
|
|
|
1,000 |
|
|
|
|
|
ß |
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
|
|
|
|
A |
|
насыщения |
|||
|
|
|
|
|
|
|
|
|
Линия |
|
|
|
|
T
Рис. 7.2
T  K
K
Tb
Ta |
1 |
2 |
12
x = const
v1 k vкр vкр v2 jvкр |
v |
Рис. 7.3
Таким образом, при осуществлении изохорного процесса в воде при Т < ТА нагревание системы будет приводить к уменьшению в ней давления. При повышении температуры система, соответствующая изохорам 1,000000< v < 1,000132 мл/г, будет переходить из однофазного состояния в двухфазное и затем вновь в однофазное.
Отметим некоторые характерные особенности, присущие изохорному процессу, осуществляемому в двухфазной среде. Рассмотрим нагрев сосуда постоянного объема V, в котором заключена жидкость (например, вода) в равновесии со своим насыщенным паром. Обозначим через G массу воды и ее пара, находящихся в сосуде. В этом случае удельный объем v двухфазной смеси, заполняющей сосуд, будет равен V/G. Рассмотрим два случая: первый, когда в сосуд залито такое количество воды, что удельный объем двухфазной смеси v1
меньше критического удельного объема vкр, и второй, когда v2 > vкр (рис. 7.3).
Выясним, как будет изменяться состояние пароводяной смеси в каждом из этих сосудов при изохорном нагреве от одной и той же температуры Т. Состояние смеси в каждом из сосудов удобно изобразить в Т, v-диаграмме. Здесь точка 1 соответствует состоянию пароводяной смеси в первом сосуде до нагрева (удельный объем v1, температура Т), точка 2 — состоянию во втором сосуде до нагрева
(v2, T ). Степень сухости смеси х в каждом из сосудов определяется соотношением
vдф – v′ x = -------------------- ,
v″ – v″
где v′′ и v′ — удельные объемы соответственно сухого насыщенного пара
и воды на линии насыщения при температуре Т; vдф — удельный объем двухфазной смеси в сосуде (в данном случае v1 или v2).
В процессе изохорного нагрева будет изменяться соотношение между количеством воды и пара в сосуде, т.е. будет изменяться степень сухости х двухфазной смеси. Как видно из рис. 7.3, при v1 = const вначале dx > 0, а затем dx < 0;
при v > vкр всегда dx > 0. По достижении некоторой температуры Та весь сосуд оказывается заполненным водой, и при дальнейшем нагреве изохора v1 = const проходит в области жидкости (Та — это температура, при которой удельный объем воды на линии насыщения v′ оказывается равным v1). Иную картину наблюдаем при повышении температуры во втором сосуде: на изохоре v2 =
= const нагрев сопровождается увеличением степени сухости х смеси, происходит испарение воды в сосуде и уровень воды понижается. По достижении температуры Тb (температура, при которой v′′ становится равным v2) весь сосуд
216

7.1. Изохорный процесс
оказывается заполненным сухим насыщенным паром и дальнейший нагрев происходит уже в области перегретого пара. Наконец, если бы сосуд был заполнен таким количеством жидкости, которое соответствовало бы удельному объему vкр, то при нагреве такой смеси до критической температуры Tкр мениск, разде-
ляющий жидкость и пар, исчез бы вблизи середины сосуда.
Р а б о т а р а с ш и р е н и я системы в изохорном процессе равна нулю. Из соотношения
2
l1-2 = ∫p dv |
|
1 |
|
очевидно, что для изохорного процесса, когда v = const, |
|
l1-2 = 0. |
(7.1) |
К о л и ч е с т в о т е п л о т ы , сообщаемой системе при нагреве в изохорном процессе, определяется из уравнения первого закона термодинамики
dq = du + pdv; так как для изохорного процесса dv = 0, то
dq = du
и, следовательно, количество теплоты, сообщаемой системе при нагреве от состояния 1 (параметры этого состояния v, T1) до состояния 2 (параметры v, T2),
равно разности внутренних энергий u2 и u1:
q1-2 = u2(v, T2) – u1(v, T1). |
(7.2) |
Разность внутренних энергий двух состояний на изохоре определяется следующим образом. Из очевидного соотношения
|
|
|
|
T2 |
|
|
u2( |
v |
, T2 ) – u1( |
v |
, T1 ) = ∫ |
∂u |
dT |
∂T |
||||||
|
|
|
------ |
|
v
T1
получаем с учетом (2.44):
T2
u2 (v, T2 ) – u1(v, T1 ) = ∫ cvdT .
T1
(7.3)
(7.4)
Таким образом, соотношение (7.2) для количества теплоты в изохорном процессе может быть записано в следующем виде:
T2 |
|
q1-2 = ∫ cvdT . |
(7.5) |
T1 |
|
Если воспользоваться понятием о средней теплоемкости cсрv , то это соотношение можно представить в следующем виде:
q |
1-2 |
= cср (T |
2 |
– T |
1 |
) . |
(7.6) |
|
v |
|
|
|
Наконец, для случая, когда теплоемкость в рассматриваемом интервале температур постоянна, имеем:
q1-2 = cp(T2 – T1). |
(7.7) |
217
