
- •Глава 1. Введение
- •1.1. Термодинамика и ее метод
- •1.2. Параметры состояния
- •1.3. Понятие о термодинамическом процессе
- •1.4. Идеальный газ. Законы идеального газа
- •1.5. Понятие о смесях. Смеси идеальных газов
- •1.6. Понятие о теплоемкости
- •Глава 2. Первый закон термодинамики
- •2.1. Теплота. Опыт Джоуля. Эквивалентность теплоты и работы
- •2.2. Закон сохранения и превращения энергии
- •2.3. Внутренняя энергия и внешняя работа
- •2.4. Уравнение первого закона термодинамики
- •2.5. Энтальпия
- •2.6. Уравнение первого закона термодинамики для потока
- •Глава 3. Второй закон термодинамики
- •3.1. Циклы. Понятие термического КПД. Источники теплоты
- •3.2. Обратимые и необратимые процессы
- •3.3. Формулировки второго закона термодинамики
- •3.4. Цикл Карно. Теорема Карно
- •3.5. Термодинамическая шкала температур
- •3.6. Энтропия
- •3.7. Изменение энтропии в необратимых процессах
- •3.8. Объединенное уравнение первого и второго законов термодинамики
- •3.9. Энтропия и термодинамическая вероятность
- •3.10. Обратимость и производство работы
- •Глава 4. Дифференциальные уравнения термодинамики
- •4.1. Основные математические методы
- •4.2. Уравнения Максвелла
- •4.3. Частные производные внутренней энергии и энтальпии
- •4.4. Теплоемкости
- •Глава 5. Равновесие термодинамических систем и фазовые переходы
- •5.1. Гомогенные и гетерогенные термодинамические системы
- •5.2. Термодинамическое равновесие
- •5.3. Условия устойчивости и равновесия в изолированной однородной системе
- •5.4. Условия фазового равновесия
- •5.5. Фазовые переходы
- •5.7. Устойчивость фаз
- •5.8. Фазовые переходы при неодинаковых давлениях
- •Глава 6. Термодинамические свойства веществ
- •6.1. Термические и калорические свойства твердых тел
- •6.2. Термические и калорические свойства жидкостей
- •6.3. Опыт Эндрюса. Критическая точка. Уравнение Ван-дер-Ваальса
- •6.4. Термические и калорические свойства реальных газов. Уравнения состояния реальных газов
- •6.5. Термодинамические свойства веществ на линии фазовых переходов. Двухфазные системы
- •6.6. Свойства вещества в критической точке
- •6.7. Методы расчета энтропии вещества
- •6.8. Термодинамические диаграммы состояния вещества
- •6.9. Термодинамические свойства вещества в метастабильном состоянии
- •Глава 7. Основные термодинамические процессы
- •7.1. Изохорный процесс
- •7.2. Изобарный процесс
- •7.3. Изотермический процесс
- •7.4. Адиабатный процесс
- •7.5. Политропные процессы
- •7.7. Адиабатное расширение реального газа в вакуум (процесс Джоуля)
- •7.8. Процессы смешения
- •7.9. Процессы сжатия в компрессоре
- •Глава 8. Процессы течения газов и жидкостей
- •8.1. Основные уравнения процессов течения
- •8.2. Скорость звука
- •8.3. Истечение из суживающихся сопл
- •8.4. Переход через скорость звука. Сопло Лаваля
- •8.5. Адиабатное течение с трением
- •8.6. Общие закономерности течения. Закон обращения воздействий
- •8.7. Температура адиабатного торможения
- •9.1. О методах анализа эффективности циклов
- •9.2. Методы сравнения термических КПД обратимых циклов
- •9.3. Метод коэффициентов полезного действия в анализе необратимых циклов
- •Глава 10. Теплосиловые газовые циклы
- •10.1. Циклы поршневых двигателей внутреннего сгорания
- •10.2. Циклы газотурбинных установок
- •10.3. Циклы реактивных двигателей
- •Глава 11. Теплосиловые паровые циклы
- •11.1. Цикл Карно
- •11.2. Цикл Ренкина
- •11.3. Анализ цикла Ренкина с учетом потерь от необратимости
- •11.4. Цикл с промежуточным перегревом пара
- •11.5. Регенеративный цикл
- •11.6. Бинарные циклы
- •11.7. Циклы парогазовых установок
- •11.8. Теплофикационные циклы
- •Глава 12. Теплосиловые циклы прямого преобразования теплоты в электроэнергию
- •12.1. Цикл термоэлектрической установки
- •12.2. Цикл термоэлектронного преобразователя
- •12.3. Цикл МГД-установки
- •Глава 13. Холодильные циклы
- •13.1. Обратные тепловые циклы и процессы. Холодильные установки
- •13.2. Цикл воздушной холодильной установки
- •13.3. Цикл парокомпрессионной холодильной установки
- •13.4. Цикл пароэжекторной холодильной установки
- •13.5. Понятие о цикле абсорбционной холодильной установки
- •13.6. Цикл термоэлектрической холодильной установки
- •13.7. Принцип работы теплового насоса
- •13.8. Методы сжижения газов
- •Глава 14. Влажный воздух
- •14.1. Основные понятия
- •14.2. Н, d-диаграмма влажного воздуха
- •Глава 15. Основы химической термодинамики
- •15.1. Термохимия. Закон Гесса. Уравнение Кирхгофа
- •15.2. Химическое равновесие и второй закон термодинамики
- •15.3. Константа равновесия и степень диссоциации
- •15.4. Тепловой закон Нернста

7.7. Адиабатное расширение реального газа в вакуум (процесс Джоуля)
Приравнивая между собой правые части уравнений (7.143) и (7.146), получаем:
|
|
T |
∂v |
|
dT * |
– v |
|
|
|
-------- |
- |
|
--------- |
||
α * |
dT |
= |
∂T * p dT |
, |
|||
|
|
|
|
||||
h |
dT * |
|
c |
* |
dT * |
|
|
|
|
|
p |
---------dT |
|
||
|
|
|
|
|
|||
|
|
|
|
|
|
||
откуда после несложных преобразований имеем: |
|
||||||
|
|
|
∂v |
|
|
|
|
|
|
|
--------- |
|
|
||
|
d ln T = |
∂T * |
p |
dT |
* . |
||
|
|
*c * |
|||||
|
|
v + α |
|
|
|||
|
|
|
h |
p |
|
|
|
(7.147)
(7.148)
Интегрируя это уравнение и потенцируя полученный результат, находим:
|
|
|
|
|
|
T2* |
|
∂v |
|
|
|
|
|
|
|
|
|
|
∫ |
|
--------- |
p |
|
|
|
T |
|
= T |
|
exp |
|
∂T * |
dT |
* |
(7.149) |
|||
|
|
---------------------- |
. |
|||||||||
|
2 |
|
1 |
|
|
v + α *c * |
|
|
|
|||
|
|
|
|
|
|
* |
|
h |
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
Если известно значение термодинамической температуры Т1 при температуре по практической шкале T1* , то с помощью этого соотношения можно найти значение термодинамической температуры T2, соответствующее любой другой точке практической шкалы.
Если при какой-либо температуре принято, что T1 = T1* (единственная реперная
точка), то уравнение (7.149) позволяет установить значение термодинамической температуры в любой точке шкалы.
7.7. Адиабатное расширение реального газа в вакуум (процесс Джоуля)
Рассмотрим еще один типичный необратимый процесс в реальном газе — адиабатное расширение газа в вакуум без отдачи внешней работы.
Ранее, в § 2.4, мы рассмотрели этот процесс применительно к идеальному газу. Напомним, что экспериментальное изучение процесса адиабатного расширения без отдачи внешней работы газа, близкого к идеальному, позволило ГейЛюссаку, а затем Джоулю установить, что температура идеального газа в результате этого процесса не изменяется; это в свою очередь позволило установить важное свойство идеального газа — независимость внутренней энергии от объема.
Выясним теперь закономерности процесса адиабатного расширения реального газа в вакуум.
Схема осуществления процесса остается прежней: рассматривается сосуд, разделенный выдвигающейся перегородкой на две части — одну, имеющую объем V1 (эта часть сосуда заполнена газом, его температура T1), и другую, име-
ющую объем Vвак (в этой части сосуда создан вакуум) (рис. 7.17, а). Сосуд снаб-
жен идеальной теплоизоляцией, исключающей теплообмен с внешней средой. Перегородка выдвигается, и газ расширяется в объем Vвак; в результате расши-
рения давление газа уменьшается, а его объем становится равным всему объему сосуда: V2 = V1 + Vвак (рис. 7.17, б).
Выясним, как изменяются в результате опыта температура газа и его энтропия. Напомним, что, как показано в § 2.3, в случае, когда давление внутри системы (в данном случае давление газа в объеме V1) не равно давлению окружаю-
щей среды (в данном случае в объеме Vвак ), т.е. когда процесс расширения сис-
247
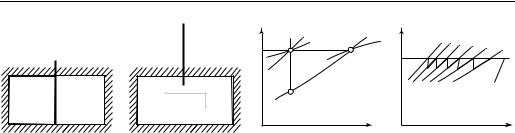
Г л а в а 7. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
V1,T1,p1 |
p = 0 |
|
Vвак |
||
|
а)
V2,T2,p2 |
б)
u |
v1 |
|
|
|
u |
v1 v |
2 |
v |
3 |
|
1 |
T |
1 |
2 |
T |
|
|
|
vn |
||
|
2 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v2 |
|
|
|
|
|
|
u=const |
|
|
|
|
|
|
|
|
|
|
|
2 ′ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
s |
|
|
|
|
|
s |
|
в) |
|
|
|
г) |
|
|
|||
Рис. 7.17 |
|
|
|
|
|
|
|
|
|
|
темы происходит неравновесно, дифференциал работы расширения следует записывать в виде pcdV, где рс — давление окружающей среды; следовательно,
уравнение первого закона термодинамики (2.40) для случая неравновесного процесса расширения может быть записано в виде
dQ = dU + pc dV. |
(7.150) |
Применительно к рассматриваемому процессу адиабатного (dQ = 0) расширения реального газа в вакуум (рс = 0 и, следовательно, dL = pcdV = 0 — газ рас-
ширяется, не совершая работы) получаем отсюда:
dU = 0 |
(7.151) |
и, следовательно,
U = const,
т.е. в процессе адиабатного расширения газа в вакуум внутренняя энергия газа остается неизменной (применительно к идеальному газу этот вывод уже был получен ранее, в § 2.4, при рассмотрении опыта Гей-Люссака—Джоуля).
В процессе расширения в вакуум газ вначале приобретает кинетическую энергию за счет убыли внутренней энергии. Затем в результате полного торможения потока газа по окончании его перетекания в ранее вакуумированную часть сосуда внутренняя энергия восстанавливается до начального значения. Этот процесс иллюстрируется рис. 7.17, в, где на участке 1-2′ происходит уменьшение внутренней энергии, в результате которого возникает кинетическая энергия перемещения рабочего тела, а на участке 2′-2 происходит восстановление внутренней энергии в результате процесса торможения. В этом процессе u1 = u2, т.е. внутренняя энергия газа по окончании процесса равна внутренней энергии до начала процесса, хотя в течение самого процесса расширения в соответствии со сказанным выше внутренняя энергия газа вначале уменьшается, а затем возрастает до прежнего значения. В связи с этим очевидна некоторая условность равенства (7.151). Однако если представить себе каскад подобных элементарных процессов, т.е. процессов заполнения рабочим телом большого количества последовательно подключаемых вакуумированных элементарных сосудов, то в пределе процесс будет стремиться к dU = 0 (рис. 7.17, г).
Вновь подчеркнем важное обстоятельство, уже отмечавшееся в предыдущем параграфе. Для того чтобы иметь возможность воспользоваться для расчета изменения температуры и энтропии дифференциальными уравнениями термодинамики, которые, как известно, справедливы только для обратимых процессов, мы должны «подобрать» схему обратимого процесса, переводящего рассматриваемую систему из исходного состояния 1 в конечное состояние 2. Поскольку эти состояния характеризуются одним и тем же значением внутренней энергии газа U, то в качестве такого процесса, переводящего газ из состояния 1 в состояние 2, может быть использован любой обратимый процесс, в котором внутренняя энергия системы остается постоянной. [Понятно, что, поскольку обратимое расширение газа обязательно сопровождается совершением работы,
248

7.7. Адиабатное расширение реального газа в вакуум (процесс Джоуля)
этот обратимый процесс не будет адиабатным — ведь для того чтобы сохранить внутреннюю энергию постоянной, нужно будет подводить к газу теплоту, равную работе расширения газа: из уравнения первого закона термодинамики (2.40)
dQ = dU + pdV
для dU = 0 получаем
dQ = pdV.]
С учетом этого замечания перейдем к вычислению изменения T и s газа в рассматриваемом процессе.
Изменение температуры газа при изменении объема в процессе U = const определяется очевидным соотношением
V2 |
|
|
|
|
T2 (U, V2 ) – T1(U, V1 ) = ∫ |
∂T |
|
|
|
------ |
|
dV , |
(7.152) |
|
∂V |
||||
V1 |
|
U |
|
|
|
|
|
|
|
или, если перейти к удельным величинам,
|
v2 |
|
∫ |
T2(u, v2 ) – T1(u, v1 ) = |
|
|
|
|
v1 |
∂T |
|
|
v |
|
|
------ |
|
d |
. |
(7.152а) |
|
∂v |
|
||||
|
u |
|
|
|
|
Фигурирующую в этом соотношении частную производную (∂T / ∂v)u можно преобразовать следующим образом:
∂T |
|
|
∂T |
|
∂u |
|
|
------ |
|
= – |
------ |
|
----- |
. |
(7.153) |
∂v |
∂u |
∂v |
|||||
|
u |
|
|
v |
T |
|
|
С учетом (2.44) и (4.25) получаем отсюда:
|
|
|
p – T |
|
-----∂p- |
|
|
|
∂T |
|
|
|
|
∂T v |
|
|
|
|
------------------------------- |
|
|
|||||
------ |
|
= |
. |
(7.153а) |
||||
∂v |
|
c |
|
|
||||
|
u |
|
|
v |
|
|
|
|
Подставляя найденное значение (∂T/∂v)u в уравнение (7.152а), получаем:
|
|
|
|
|
|
|
|
|
v2 |
p – T -----∂p- |
|
|
|
|
|
|
|
|
|
|
∫ |
|
|
|
|
|
|
|
|
|
|
|
cv |
|
|
T |
|
(u, v |
|
) – T |
|
(u, v |
|
) = |
|
∂T v |
(7.154) |
2 |
2 |
1 |
1 |
|
------------------------------- dv . |
||||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
v1 |
|
|
Это соотношение показывает, что в общем случае температура газа при адиабатном расширении в вакуум уменьшается; поскольку для реального вещества всегда
∂u |
|
= T |
∂p |
|
– p > 0 |
и сv > 0, |
------ |
T |
------ |
v |
|||
∂v |
|
∂T |
|
|
то, следовательно, в рассматриваемом процессе
Т2 < Т1.
Для идеального газа, как показано в § 2.4, адиабатное расширение в вакуум не сопровождается изменением температуры. В самом деле, поскольку для идеального газа в соответствии с уравнением (2.47)
∂u |
|
ид |
------ |
|
= 0 , |
∂v |
T |
|
249

Г л а в а 7. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
то, как видно из (7.153),
∂T |
|
ид |
------ |
|
= 0 . |
∂v |
u |
|
Располагая значениями v2 и T2, нетрудно (с помощью диаграмм состояния или таблиц термодинамических свойств) найти давление газа р2 в сосуде после
расширения.
Изменение энтропии газа в рассматриваемом процессе определяется очевидным соотношением
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v2 |
|
|
|
|
|
|
|
|
|
|
|
v |
|
|
|
|
|
|
v |
|
|
|
|
∂s |
|
|
v |
|
|
s |
2(u, |
2 ) – s1 |
(u, |
1 ) |
= ∫ |
------ |
|
d |
. |
(7.155) |
|||||||||||
|
|
∂v |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v1 |
|
u |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
С учетом уравнения (4.41) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
∂s |
|
|
|
p |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
------ |
|
= |
---- |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
∂v |
T |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
u |
|
|
|
|
|
|
|
|
|
|
получаем: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∫ T |
|
|
|
|
|
|
|
s |
|
(u, v |
|
) – s |
|
(u, |
|
|
) = |
|
p |
dv . |
|
(7.156) |
||||||
|
2 |
2 |
1 |
v |
1 |
|
----- |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v1 |
|
|
|
|
|
|
Интеграл уравнения (7.156) вычисляется с помощью таблиц термодинамических свойств газов [строится зависимость p ⁄ T = f (v) для u = const, которая затем интегрируется в пределах от v1 до v2].
Поскольку интеграл, стоящий в правой части этого равенства, всегда положителен, то, следовательно, всегда s2 > s1, т.е. энтропия в процессе Джоуля,
являющемся типично необратимым процессом, возрастает.
Для идеального газа, подставляя величину p ⁄ T из уравнения Клапейрона
p |
R |
|
|
|
----- |
= -- , |
|
|
|
T |
v |
|
|
|
получаем из (7.156): |
|
|
|
|
|
v |
2 |
|
|
s2(u, v2) – s1(u, v1) = R ln ------ |
, |
(7.157) |
||
v1
отсюда для G кг газа имеем:
V2
S2 – S1 = G R ln ----- .
V1
7.8.Процессы смешения
Вразличных устройствах и аппаратах часто приходится иметь дело со смешением различных газов (жидкостей) или же разных порций одного и того же газа (жидкости) при различных параметрах обоих компонентов. При рассмотрении процессов смешения задача обычно состоит в определении параметров состояния смеси по известным параметрам состояния компонентов, составляющих эту смесь. Решение этой задачи будет различным в зависимости от тех условий, при которых осуществляется этот процесс. Различные способы осуществления процесса смешения рассмотрены ниже.
Мы ограничимся здесь рассмотрением процессов смешения одного и того же газа (жидкости) при различных параметрах смешивающихся порций вещества.
250

7.8. Процессы смешения
Поскольку в настоящей книге мы не касаемся вопросов термодинамики растворов, не будем рассматривать процессы смешения различных газов и жидкостей.
Процесс смешения будем рассматривать происходящим без подвода теплоты к веществам или отвода от них при смешении, т.е. адиабатно. Что же касается смешения при наличии подвода теплоты, то очевидно, что его можно мысленно расчленить на два этапа — смешение без подвода теплоты и затем подвод теплоты к получаемой смеси. Таким образом, неадиабатное смешение может быть сведено к адиабатному с последующим теплообменом.
Процесс смешения в постоянном объеме. Рассмотрим процесс смешения, происходящий в некотором сосуде с постоянным объемом V. Пусть этот сосуд разделен перегородкой на два отсека, в одном из которых находится газ (жидкость) с параметрами p1, v1, T1, u1, в другом — тот же газ (жидкость) с парамет-
рами р2, v2, T2, и2 (рис. 7.18, а). Массу газа в одном отсеке и объем этого отсека обозначим соответственно G1 и V1, а в другом отсеке — G2 и V2. Очевидно, что
если убрать перегородку, разделяющую эти отсеки, то произойдет смешение обеих частей газа. В результате смешения давление, температура и плотность газа по всему объему сосуда выравняются (рис. 7.18, б). Значения параметров состояния газа после смешения обозначим р, v, T, и.
Поскольку, как мы условились, рассматриваем процесс смешения в сосуде, снабженном адиабатной оболочкой, и поскольку объем сосуда постоянен, то очевидно, что в данном случае мы имеем дело с изолированной термодинамической системой, подробно рассмотренной в гл. 5. Напомним, что в такой системе, в соответствии с (5.79)—(5.81)
V = V1 + V2 = const;
U = U1 + U2 = const. Масса газа после смешения
G = G1 + G2.
Из (5.81) и (5.80) следует, что |
|
u1G1 + u2G2 = u(G1 + G2). |
(7.158) |
Внутренняя энергия газа после смешения определяется следующим образом:
u1G1 |
+ u2G2 |
(7.159) |
u = -------------------------------- . |
||
G1 |
+ G2 |
|
Далее по аналогии с предыдущим из (5.79) и (5.80) следует:
v1G1 + v2G2
v = --------------------------------- .
G1 + G2
Рассматриваемый процесс смешения является существенно необратимым. В самом деле, для того чтобы вновь разделить газ в сосуде на две части, имеющие существенно различные температуры и давления, надо было бы затратить внешнюю работу, тогда как процесс смешения (выравнивания температур и давлений) идет самопроизвольно. Как и во всяком необратимом процессе, в рассматриваемом процессе смешения энтропия возрастает. Этот вывод очевиден и из иных соображений: поскольку, как показано в гл. 3, любые процессы в изолированной термодинамической системе приводят к увеличению энтропии системы, очевидно, что и в рассматриваемом нами процессе смешения энтропия газа возрастает.
(7.160)
V1 V2
p1, T1, v1, u1 p2, T2, v2, u2
G1 G2
а)
V
p, T, v, u
G
б)
Рис. 7.18
251

Г л а в а 7. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
Что касается остальных параметров газа после смешения (р, Т ), то для реальных газов и жидкостей они аналитически в общем виде через значения параметров первой и второй частей рассматриваемой системы (т.е. компонентов смеси) определены быть не могут. Для их определения можно воспользоваться u, v-диа- граммой, на которой нанесены изобары и изотермы, или u, T-диаграммой с нанесенными на ней изохорами и изобарами; определив с помощью соотношений (7.159) и (7.160) u и v газа после смешения, из диаграмм можно найти р, Т, s.
Значения Т и v газа после смешения могут быть непосредственно выражены через известные значения параметров состояния смешиваемых порций газа только для идеального газа.
В этом случае температура газа после смешения Т определяется следующим образом. Для идеального газа, теплоемкость которого постоянна,
u1 = cvT1; u2 = cvT2 и u = cvT |
(7.161) |
(для идеальных газов, теплоемкость которых меняется с температурой, в этих соотношениях будет фигурировать средняя теплоемкость cсрv )1).
С учетом этого обстоятельства получаем из (7.158):
G1T1 |
+ G2T2 |
(7.162) |
T = --------------------------------- . |
||
G1 |
+ G2 |
|
Давление газа после смешения р определяется по уравнению Клапейрона
(G1 + G2 )RT |
, |
(7.163) |
p = --------------------------------- |
V
где Т — температура газа после смешения, определяемая соотношением (7.162); V — объем сосуда; (G1 + G2) — суммарная масса газа; R — газовая постоянная
смеси, определяемая уравнением (1.59).
Зная Т и р этого идеального газа после смешения, нетрудно определить его энтропию с помощью соотношения (6.105).
Процесс смешения в потоке. Важной разновидностью процессов смешения является смешение в потоке, которое можно представить себе следующим образом (рис. 7.19). По трубопроводу А в камеру смешения поступает газ (жидкость), параметры состояния которого р1, v1, T1, h1, а по трубопроводу В — газ
(жидкость) с параметрами р2, v2, T2, h2. Расход газа через трубопровод А равен G1, через трубопровод В — G2. На входе в камеру смешения эти газовые потоки
дросселируются, с тем чтобы давление в камере смешения р было меньше, чем давления р1 и p2 (если бы р было больше одного из давлений, например p > p1,
то тогда из камеры смешения газ устремился бы в трубопровод А).
|
|
|
A |
I |
|
|
|
|
|
|
|
|
|||
G1 |
|
|
|
|
|
|
|
|
III |
||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
||||||||
|
p1, v1, T1, h1 |
|
|
|
|
|
|
C |
|
|
G |
||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||||||||
|
|
|
B |
II |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||
G2 |
|
|
|
|
p, v, T, h |
||||||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
p2, v2, T2, h2 |
|
|
|
|
|
|
|
|
||||||
Рис. 7.19
1) В данном случае, как видно из (7.161), внутренняя энергия идеального газа отсчитывается от 0 К. Следует, однако, подчеркнуть, что выбор начала отсчета никак не сказывается на результатах приводимого расчета величины Т.
252

7.8. Процессы смешения
Следует подчеркнуть, что давление p в камере смешения может быть выбрано различным в зависимости от степени раскрытия вентилей на трубопроводах А и В; этим процесс смешения в потоке существенно отличается от рассмотренного выше смешения в объеме, где давление смеси однозначно определяется исходными параметрами смешиваемых порций газа.
Из камеры смешения газ, имеющий параметры р, v, T, отводится по трубопроводу С. Расход газа в трубопроводе С обозначим G. Очевидно, что
G = G1 + G2.
Как и прежде, считаем, что процесс смешения происходит адиабатно — камера смешения снабжена идеальной теплоизоляцией.
Смешение в потоке, естественно, также является необратимым процессом. При этом дополнительная необратимость возникает в том случае, когда скорости потоков первого и второго газов различны. Однако для большинства технически важных процессов скорости газовых потоков достаточно малы, так что кинетической энергией этих потоков можно пренебречь.
Для того чтобы выяснить основные закономерности процесса смешения в потоке, используем тот же способ, что и при анализе процесса дросселирования: мысленно выделим в трубопроводах А, В и С сечения потоков (I, II и III на рис. 7.19).
Поскольку газ в трубопроводах движется, то, естественно, зафиксированные нами сечения (или невесомые поршни) I, II и III перемещаются вдоль труб. Площади сечения трубопроводов A, В и С (т.е. площади сечения поршней I, II и III) обозначим соответственно Σ1, Σ2 и Σ3.
За некоторый промежуток времени поршень I переместится на расстояние l1, поршень II — на расстояние l2, поршень III — на расстояние l3.
Для перемещения поршня I на расстояние l1 должна быть совершена работа
LI = p1l1Σ1. |
(7.164) |
Обозначим: |
|
V1 = l1Σ1, |
(7.165) |
при этом V1 — объем газа, вытесненный поршнем I за рассматриваемый промежуток времени. Поскольку
V1 = v1G1, |
(7.166) |
то |
|
L1 = p1v1G1. |
(7.167) |
Аналогичным образом можно показать, что работа, совершаемая для перемещения поршня II, равна
LII = p2v2G2 |
(7.168) |
и работа, которую совершает, перемещаясь, поршень III, равна |
|
LIII = pvG. |
(7.169) |
В общем совершается работа, равная |
|
L = LIII – (LI + LII). |
|
С учетом (7.167), (7.168) и (7.169) получаем: |
|
L = pvG – p1v1G1 – p2v2G2. |
(7.170) |
Вместе с тем известно, что работа в адиабатном процессе может быть произведена только за счет уменьшения внутренней энергии системы:
L = uG – (u1G1 + u2G2). |
(7.171) |
253

Г л а в а 7. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
Приравнивая между собой правые части уравнений (7.170) и (7.171), получаем:
(u + pv)G = (u1 + p1v1)G1 + (u2 + p2v2)G2, |
(7.172) |
или |
|
hG = h1G1 + h2G2. |
(7.173) |
Отсюда следует, что энтальпия смеси, полученной в результате смешения в потоке, определяется следующим образом:
h1G1 + h2G2 |
(7.174) |
h = -------------------------------- . |
G
Зная энтальпию h и давление p газа после смешения, с помощью диаграмм состояния газа h,T ; h, p; h, s можно найти остальные параметры смеси (Т, v, s и др.).
В случае смешения потоков идеального газа, имеющих различные параметры, величины v и Т могут быть выражены аналитически, через известные значения параметров смешиваемых потоков газа.
Поскольку для идеального газа, теплоемкость которого постоянна,
h1 = cpT1; h2 = cpT2 и h = cpT |
(7.175) |
(для идеального газа, теплоемкость которого зависит от температуры, в этих
соотношениях будет фигурировать средняя теплоемкость |
c |
ср ) 1), с учетом |
|
|
p |
(7.175) получаем из (7.174): |
|
|
T1G1 + T2G2 |
|
(7.176) |
T = --------------------------------- . |
|
|
G |
|
|
Зная определенную таким образом температуру Т газа и давление p газа в камере смешения, с помощью уравнения Клапейрона нетрудно определить удельный объем газа после смешения:
RT |
, |
(7.177) |
v = ------ |
p
где R — газовая постоянная смеси, определяемая по уравнению (1.59). Энтропия идеального газа однозначно определяется его температурой и дав-
лением.
Смешение при заполнении объема. Третьей важной разновидностью процессов смешения является так называемое смешение при заполнении объема, когда в сосуд постоянного объема V1, содержащий газ (жид-
p2, v2, T2,
G2, V2
l2
V1
G1, p1, v1, T1
Рис. 7.20
кость) с параметрами p1, v1, T1 (массу газа в сосуде обозначим G1), вводится по трубопроводу некоторое определенное количество того же газа (жидкости) с параметрами p2, v2, T2 (массу газа, вводимого в сосуд, обозначим G2) (рис. 7.20). Понятно, что давление p2 должно быть больше, чем p1.
По-прежнему рассматриваем случай адиабатного смешения. Обозначим сечение трубопровода, по которому к сосуду подводится газ, через Σ, объем, занимаемый G2 кг
газа при давлении p2 и температуре Т2, — через V2, а длину
трубопровода, которую занимает вводимая в сосуд масса газа, — через l2. С помощью рассуждений, аналогичных
изложенным при рассмотрении предыдущего способа сме-
1) Энтальпия здесь отсчитывается от 0 К.
254

7.8. Процессы смешения
шения, получим, что работа, которая должна быть совершена для того, чтобы
ввести в сосуд газ, находящийся в трубопроводе, равна: |
|
LII = Σæl2 p2 = V2 p2 = v2 p2 G2 . |
(7.178) |
Поскольку объем сосуда постоянен, очевидно, что ни газ в сосуде до смешения, ни газ в сосуде после смешения, давление которого возрастает по сравнению с давлением p1, работы не совершают.
Таким образом, в рассматриваемом процессе смешения совершается лишь
работа, производимая над газом, находящимся в сосуде до смешения: |
|
L = –LII = – p2v2G2 . |
(7.179) |
Однако, как и во всяком адиабатном процессе, в рассматриваемом процессе работа может быть проведена только за счет уменьшения внутренней энергии
системы: |
|
L = (u1G1 + u2G2) – uG, |
(7.180) |
где u1, u2 и u — внутренние энергии соответственно газа в сосуде до смешения, газа в трубопроводе и газа после смешения; G — масса смеси; очевидно, что
G = G1 + G2 . |
|
Приравнивая правые части уравнений (7.179) и (7.180), получаем: |
|
uG = u1G1 + (u2 + p2v2)G2, |
(7.181) |
или |
|
uG = u1G1 + h2G2, |
(7.182) |
откуда |
|
u1G1 + h2G2 |
(7.183) |
u = -------------------------------- . |
|
G1 + G2 |
|
Поскольку известен объем сосуда V1 и масса смеси (G1 + G2), нетрудно опре- |
|
делить удельный объем смеси: |
|
V1 |
(7.184) |
v = -------------------- . |
|
G1 + G2 |
|
Зная u и v, с помощью диаграмм состояния можно определить остальные параметры смеси (р, Т, s).
Для идеальных газов методом, аналогичным примененному для других способов смешения, можно получить соотношение для расчета Т и р газа после смешения по известным значениям p1, Т1, p2 и T2.
Поскольку для идеального газа (теплоемкость считаем не зависящей от тем-
пературы) |
|
u1 = cvT1; h2 = cpT2; u = cvT, |
(7.185) |
получаем из (7.182): |
|
T1G1 + kT2G2 |
(7.186) |
T = ------------------------------------ , |
|
G1 + G2 |
|
где k — показатель изоэнтропы идеального газа, определяемый по уравнению (7.55). Давление газа после смешения p определяем из уравнения Клапейрона:
p = (G |
|
+ G |
RT |
(7.187) |
|
|
) ------ . |
||||
|
1 |
2 |
V |
1 |
|
|
|
|
|
|
|
Зная Т и p, нетрудно найти энтропию этого идеального газа.
255
