
Хурсан - Лекции по квантовой механике и квантовой химии / 08Lecture-07
.pdf
Лекция 7.
Свойства водородоподобного атома.
7.1.Энергия атомных орбиталей.
Всоответствии с постулатами квантовой механики знание полной волновой функции системы позволяет вычислять ее свойства. Рассмотрим вычисление некоторых важнейших характеристик. Полная энергия атома водорода вычисляется из уравнения
|
|
ˆ |
dq = r |
2 |
sinθ dr dθ dϕ. |
|
|
||||
E = ∫Ψ HΨdq, |
|
||||
Аналогично можно вычислить энергии отдельных орбиталей. Например, энергия 1S-орбитали определяется из выражения:
* ˆ |
* |
|
1 1/ 2 |
Z |
3 / 2 |
|
|
Zr |
|||
E1S = ∫Ψ1S HΨ1S dq, |
Ψ1S = Ψ1S |
= |
|
|
|
|
|
|
− |
|
|
|
|
|
|||||||||
π |
|
|
|
exp |
|
. |
|||||
|
|
|
|
a0 |
|
|
|
a0 |
|||
где Ψ1S = (1/π)1/2(Z/a0)3/2exp(-Z r/a0).
Учтем, что Ψ1S не зависит от θ и ϕ, поэтому интегралы по этим переменным дадут постоянный множитель 4π. Интегрирование по dr приводит к табличному интегралу вида
∞ |
n! |
|
|
∫xn exp(−kx)dx = |
. |
||
n+1 |
|||
0 |
k |
||
Отсюда несложно получить выражение для энергии электрона в 1S состоянии водородоподобного атома:
E1S = − Z 2 mee4 .
2h2
Заметим, что все множители правой части этого уравнения суть постоянные величины, поэтому энергия основного состояния электрона в атоме водорода (Z = 1) есть важнейшая физическая константа:
|
|
m |
e4 |
|
9.1095 10−28 (4.8032 10 |
−10 )4 |
|
E |
= − |
e |
|
= − |
|
|
= |
|
|
|
|
||||
1S |
|
2h2 |
|
2 (1.0546 10−27 )2 |
|
|
|
|
|
|
|
|
|||
= 2.1799 10−11 эрг =13.6058 эВ.
Аналогично можно получить выражения для энергий других электронных состояний водородоподобного атома. В общем случае:
En = − Z 2 m2 ee24 ,
2h n
что в точности совпадает с формулой Бора для энергий электрона на «разрешенных» орбитах классического атома водорода. Приведенный пример показывает объективность оценок орбитальных параметров в рамках квантовой

2
механики. Более того, данное уравнение позволяет делать оценки энергии электрона в соответствующих ионах многоэлектронных атомов. Ниже приведены результаты расчета и их сравнение с экспериментальными данными, показывающее их прекрасное соответствие друг другу
Частица |
Энергия 1S состояния, эВ |
|
He+ |
расчет |
эксперимент |
-54.42 |
-54.416 |
|
Li2+ |
-122.45 |
-122.451 |
Be3+ |
-217.69 |
-217.713 |
B4+ |
-340.15 |
-340.217 |
Заметим, что выражение для энергии не содержит квантовых чисел l и m. Это означает, что все орбитали электрона атома водорода, имеющие одинаковое квантовое число (например, 3S, 3P, 3D) имеют одинаковую энергию. Такие орбитали называются «вырожденными». Далее мы увидим, что вырождение исчезает, если перейти от водорода к атомам, имеющим более одного электрона.
7.2. Расстояние между электроном и ядром.
Другие свойства атома водорода можно вычислить согласно постулату V как среднее значение физической величины:
< >≡ = ∫Ψ ˆ Ψ = Ψ ˆ Ψ
A A A dq A
Найдем среднее расстояние между ядром и электроном в основном состоянии атома водорода. Используя данное уравнение и выражение для Ψ1S, имеем:
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
1 |
|
3 ∞ |
3 |
|
|
2r |
2ππ |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
r1S = ∫Ψ1S |
r Ψ1S dq = |
|
|
|
∫r |
|
− |
|
|||||||||||||||
π |
|
|
|
|
|
exp |
|
dr ∫∫sinθ dθ dϕ = |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
a0 |
|
0 |
|
|
|
a0 0 0 |
||||
|
|
|
4π |
|
|
|
3 ∞ |
|
|
|
2r |
|
|
|
|
|
|
|
|
|
|
||
= |
|
1 |
|
|
∫r |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
− |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
exp |
a0 |
|
dr. |
|
|
|
|
|
|
|
||||||||
|
|
|
π |
a0 |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Последний интеграл является табличным и равен (6a0)4/16. Следовательно,
|
|
|
|
4 6 a4 |
|
3 |
|
|
|
||
|
r |
|
= |
|
|
0 |
= |
|
a |
|
. |
|
|
16 a03 |
|
|
|||||||
|
1S |
|
|
2 |
|
0 |
|
||||
В общем виде среднее расстояние между электроном и ядром для различных n и l водородоподобного атома определяется формулой
|
r |
|
= a |
|
n2 |
|
3 |
− |
l(l +1) |
|
|
|
|
|
|
|
|
. |
|||
|
|
0 Z |
2 |
2n2 |
||||||
|
nl |
|
|
|
|
|||||
Интересно сравнить среднее расстояние r1S с наиболее вероятным положением электрона в атоме, определяемом радиальной функцией распределения.
3
|
2 |
|
2 |
|
r |
2 |
|
|
2r |
|
P10 (r) =[R10 (r)] |
r |
= N |
|
|
− |
|
||||
|
|
|
|
exp |
|
, |
||||
|
|
|
3 |
a0 |
||||||
|
|
|
|
|
a0 |
|
|
|
||
N – постоянный множитель.
Максимальное значение этой функции, соответствующее наиболее вероятному положению электрона, можно найти из свойства экстремума:
dP (r) |
|
2r |
|
|
2r |
|
r |
|
|
|
10 |
= N |
|
|
− |
|
|
− |
|
|
= 0, rвер = a0 . |
|
3 |
|
|
|||||||
dr |
exp |
|
1 |
a0 |
|
|||||
|
a0 |
|
|
a0 |
|
|
|
|||
Несовпадение наиболее вероятного и среднего расстояний электрона от ядра обусловлено несимметричностью радиальной функции распределения относительно своего максимума. По этой причине, в любом атоме и для любых состояний электрона среднее расстояние всегда будет превышать наиболее вероятное.
7.3. Спектр водородоподобного атома.
Поглощение и испускание света, следовательно, и спектральные переходы атома подчиняются правилу частот Бора:
hν = Ek – Ei,
где Ek и Ei – уровни энергии, соответствующие состояниям с волновыми функциями Ψk и Ψi. Учитывая выражение для энергии АО, получим, что частота кванта поглощаемого света в результате перехода из состояния с главным квантовым числом ni в более высокоэнергетическое состояние с главным квантовым числом nk определяется соотношением:
|
Z |
2 |
mee |
4 |
1 |
1 |
|
||
hν = |
|
|
|
|
|||||
|
|
|
|
|
− |
|
. |
||
|
2h2 |
|
n2 |
n2 |
|||||
|
|
|
|
|
|
i |
|
k |
|
И наоборот, возбужденный водородоподобный атом, в котором электрон находится в высокоэнергетическом состоянии Ψk, дезактивируется, переходя в более устойчивое состояние Ψi. Частота кванта испускаемого света определяется по приведенному выше соотношению.
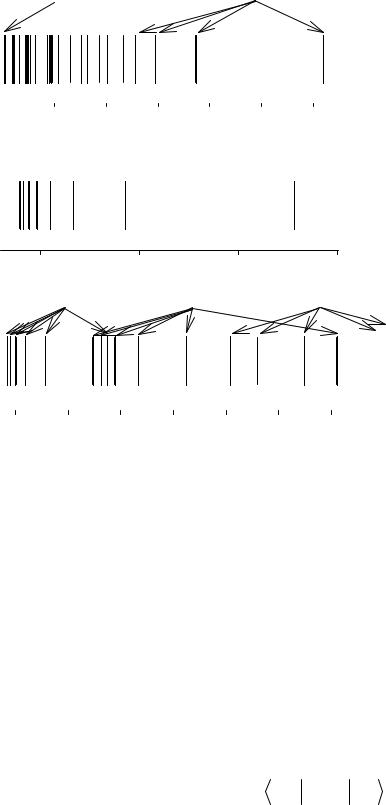
В спектроскопии хорошо изучен спектр испускания атомарного водорода. Он состоит из нескольких спектральных серий, волновые числа которых определяются формулой:
4
Серия Лаймана |
Серия Хамфри |
|
|
|
|
|
|
λ, нм |
2000 |
4000 |
6000 |
8000 |
10000 |
12000 |
Серия Бальмера
400 |
500 |
600 |
700 |
Серия Пашена Серия БрэкетаСерия Пфунда
|
1 |
|
1 |
|
|
|
− |
|
|||
2 |
2 |
||||
ν = R |
, |
||||
ni |
|
nk |
|
||
R – постоянная Ридберга (введена шведским физиком Й.Р. Ридбергом в 1890 году), ni и nk – целые числа. Как видно из сравнения двух последних уравнений, квантовая механика объясняет закономерности спектра испускания атома водорода, раскрывает физический смысл чисел ni и nk и постоянной Ридберга:
|
|
|
|
|
|
|
R = |
2π 2 mee4 |
|
|
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
|
|
ch3 |
||
1000 |
1500 |
2000 |
2500 |
3000 |
3500 |
4000 |
c – скорость света в ва- |
||
|
|
|
|
|
|
|
кууме. |
|
|
|
Для каждой спектральной серии ni постоянно, а числа, определяющие |
||||||||
верхние уровни, nk = ni + 1, ni + 2,… Так, для ni = 1 и nk = 2, 3,… получается серия Лаймана, частоты линий которой лежат в далекой УФ-области; при ni = 2 и nk = 3, 4,… получается серия Бальмера, ее линии лежат в видимой и ближней УФ областях; при ni = 3 и nk = 4, 5,… – серия Пашена, расположенная в ИК-области. В далекой ИК-области лежат серии Брэкета (ni = 4), Пфунда (ni = 5) и Хамфри (ni = 6). Формула для спектральных серий водородоподобных атомов отличается от приведенной выше коэффициентом Z2, как это и следует из результатов квантовомеханического описания.
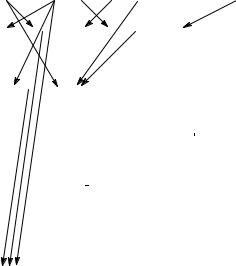
Спектры атомов характеризуются не только значениями поглощаемых или излучаемых квантов света, но и вероятностями этих процессов, отражающихся в большей или меньшей интенсивности свечения или поглощения света. Вероятность электронного перехода линейно зависит от энергии перехода и квадратично от величиныr дипольного момента перехода:
Dki = Ψk ∑rvµ Ψi ,
µ
5
S |
|
|
|
P |
|
|
|
|
|
|
|
D |
|
F |
где rµ – радиус-вектор µ-го электрона |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в атоме. Переходы, для которых Dki = |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 являются запрещенными, поэтому |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в спектроскопии |
важное |
значение |
|
|
|
|
|
|
|
|
Серия Бальмера |
|
|
|
имеют правила отбора для разре- |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
шенных переходов. Из приведенного |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
уравнения следует, что в спектрах |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
водородоподобных |
атомов разре- |
|
|
|
|
|
|
|
|
∆l = 1 |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
шенными являются переходы, удов- |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
летворяющие условию ∆l = ±1. Та- |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ким образом, в спектрах одноэлек- |
||
|
Серия Лаймана |
|
|
|
тронных атомов проявляются пере- |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ходы из S-состояния |
только в |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
P-состояние, из P- в S- и D-состояния и т.д. Остальные переходы запрещены и не регистрируются в спектрах.
