
_2_2_2014_doc
.pdf
104
3.3.1.ДИСПРОПОРЦИОНИРОВАНИЕ (МЕТАТЕЗИС) ОЛЕФИНОВ
Реакция диспропорционирования (метатезис) состоит в обмене алкилиденовыми остатками между двумя молекулами олефинов:
|
|
|
|
|
|
|
|
|
R2 |
|
|
|
|
|
R5 |
|
R1 |
R2 |
R5 |
R6 |
|
|
|
R1 |
|
|
|
|
|
R6 |
|||
|
|
|
+ |
|
|
|||||||||||
|
|
|
+ |
|
|
|
|
|
R4 |
|
|
R7 |
||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
R4 |
R3 |
R8 |
R7 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
R3 |
(3.43) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R8 |
||
За открытие процесса метатезиса олефинов Роберт Граббс, Ричард Шрок и Ив Шовен были удостоены Нобелевской премии в области химии в
2005 году. |
что |
реакция |
катализируется |
алкилиденовыми |
Установлено, |
(карбеновыми) комплексами, которые, например, образуются по реакции
трансметаллирования с последующими стадиями -элиминирования и восстановительного элиминирования:
WVICl6 + C2H5AlCl2 C2H5WVICl5 + AlCl3 |
(3.44) |
|
C2H5WVICl5 CH3-CH=WVIHCl5 |
CH3-CH=WIVCl4 + HCl |
|
Сначала по обменной реакции с алкилалюминием из хлорида |
||
вольфрама (VI) образуется |
алкильный комплекс, который |
далее, в |
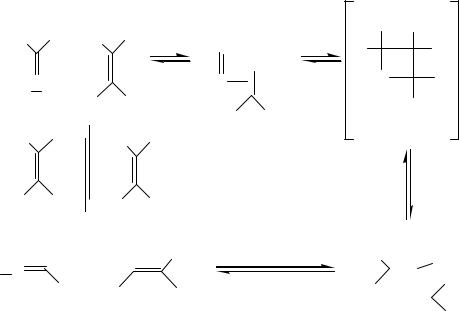
результате реакции -элиминирования, превращается в карбеновый (этилиденовый) комплекс. Карбеновый комплекс стабилизируется благодаря последующей реакции восстановительного элиминирования HCl. Образовавшийся комплекс вольфрама (IV) имеет вакантное координационное место, способное принять олефин. Каталитический цикл для реакции (3.43) выглядит следующим образом:
105
R1 R2 R5 R6
+
Mn

 R7 R8 R1 R2
R7 R8 R1 R2  R3
R3
+ -
R4 R3  R7
R7

 Mn
Mn  R7 + R2
R7 + R2 R8 R1
R8 R1
R1 R2 R5 Mn
R2 R5 Mn  R6
R6
R7 R8
R4
R8
R5
R6
R2 R5
R1 R6
Mn+2 R8
R7
R2 |
|
|
|
R5 |
R6 |
|||
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
R1 |
|
|
n |
|
R7 |
|||
|
|
|
|
|||||
|
M |
|
|
|
|
(3.45) |
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
R8 |
Вначале на вакантное место в комплексе координируется молекула олефина. Затем через переходное состояние, являющееся результатом реакции окислительного сочетания карбенового и олефинового лигандов, образуются новые карбеновый и олефиновый лиганды. Новый олефин затем диссоциирует в раствор.
В промышленном масштабе используются как гомогенные, так и гетерогенные катализаторы метатезиса олефинов.
Реакции, протекающие по механизму метатезиса можно схематично классифицировать на следующие типы:
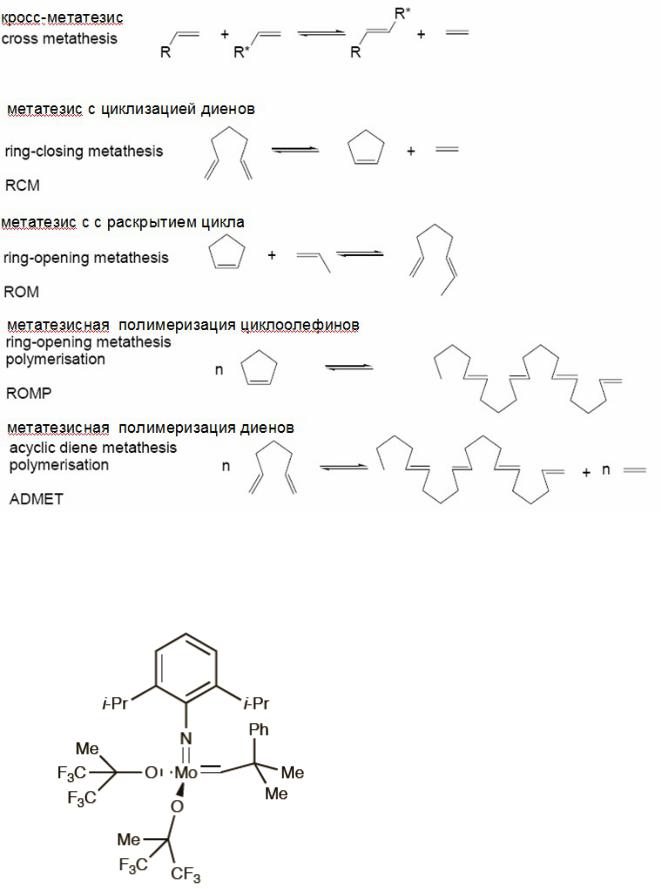
106
Из гомогенных катализаторов метатезиса наиболее изучены следующие:
Катализаторы Шрока с металлами Mo, W и Re, например:
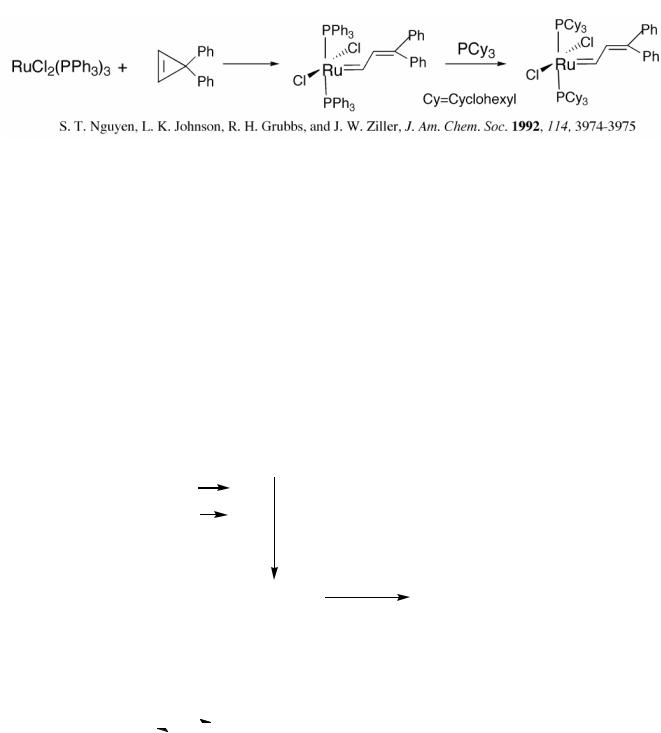
107
Катализаторы Граббса на основе Ru, получаемые по схеме:
Катализаторы Шрока значительно активнее и более пригодны для стерео-специфических синтезов по сравнению с катализаторами Граббса, но их недостатком является высокая чувствительность к кислороду и функциональным группам (спиртовым, кислотным и пр.). Менее активные рутениевые катализаторы (Граббса) отличаются высокой химической стойкостью к кислороду и различным функциональным группам, поэтому спектр их применения шире.
Из гетерогенных катализаторов наиболее известны системы
Re2O7/Al2O3, MoO3/Al2O3 и WO3/SiO2(Al2O3).
Реакции, протекающие по механизму метатезиса применяются в промышленности в процессах как основного органического синтеза
(получение линейных -олефинов (SHOP-process); Три-Олефин; специальные полимеры), так и тонкого органического синтеза (фармацевтические и биологически-активные вещества).
Примеры промышленных процессов на основе реакции метатезиса:
1) SHOP-process, катализатор метатезиса Re2O7/Al2O3:
n > 18 |
C18-C=C |
|
|
|
|
C9-C=C-C9 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
C-C=C-C |
|
|
|
n < 12 |
C-C-C=C |
|
|
|
|||||
|
|
|
|
||||||
|
n = 10-14 |
2C9-C=C-C |
+ H2C=CH2 |
||||||
|
|
|
2C9-C=C n = 9-13 |
||||||
|
|
|
|||||||
-H2C=CHCH3
2)Процесс Триолефин, катализатор WO3/SiO2:
CH3CH=CH2 |
|
CHCH3 |
CH2 |
||||
+ |
|
||||||
|
|
|
CHCH3 |
+ |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|||
CH3CH=CH2 |
|
|
|
CH2 |
|||
Эта гибкая технология может быть легко переориентирована в ту или другую сторону обратимой реакции в зависимости от конъюнктуры рынка. Примечательно, что первые производства (с 1966 г.) были запущены с целью производства дефицитных в то время этилена и 2- бутена. С 1985 года ситуация поменялась и процессы теперь настроены на производство пропилена полимеризационной чистоты.
3) Процесс получения , -диенов (например, гексадиена-1,5 и декадиена-1,9) метатезисом циклоолефинов с этиленом на алюморениевом катализаторе по схеме:
108

 + CH2=CH2
+ CH2=CH2  CH2=CH
CH2=CH 





 CH=CH2
CH=CH2
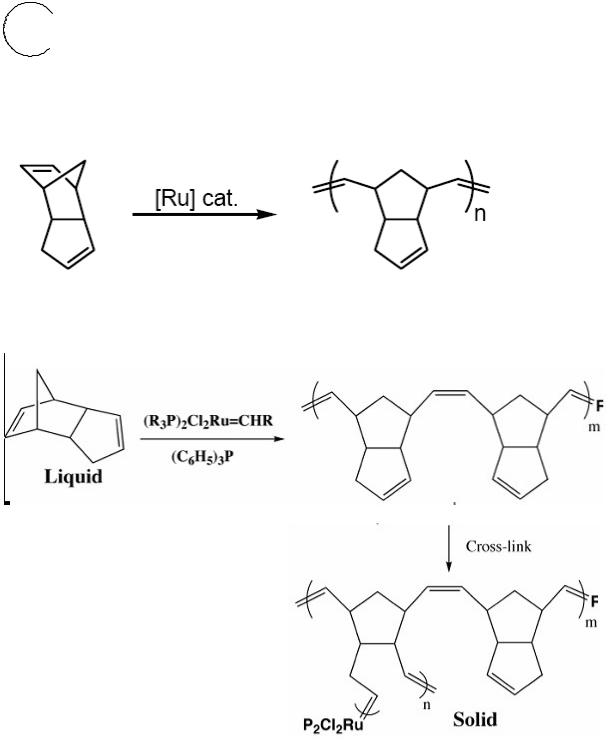
4) Получение высокопрочного конструкционного полимера из дициклопентадиена по реакции ROMP (Ring-Opening Metathesis Polymerization) на гомогенном рутениевом катализаторе:
На стадии внедрения находятся промышленные процессы «зеленой химии» в которых в качестве сырья используются возобновляемые ресурсы, а реакции метатезиса протекают в присутствии Ruкатализаторов:
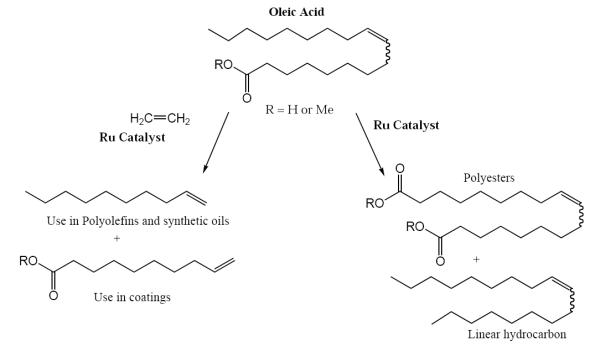
109
3.3.2.ОКИСЛЕНИЕ
Существует два основных механизма реакций окисления, катализируемых комплексами переходных металлов: гимолитический и гетеролитический.
3.3.2.1.РАДИКАЛЬНО-ЦЕПНОЕ ОКИСЛЕНИЕ (ГОМОЛИТИЧЕСКИЙ МЕХАНИЗМ)
Радикально-цепное окисление органических соединений катализируется соединениями средне жестких металлов в высокой степени оксиления M+n, способных восстанавливаться до степени окисления на 1 меньшую M+(n-1). Чаще всего используют соединения Mn+3 и Co+3. Механизм таких реакций заключается в образовании радикалов при разрыве связи в органическом реагенте с одновременным восстановлением металла. Фактически, катализатор ускоряет лишь стадию зарождения цепи (образования радикалов).
В промышленности по такому механизму окисляют, в частности, ацетальдегид до уксусной кислоты, применяя в качестве катализатора органо-растворимые соли Mn+3 или Co+3. Каталитический цикл протекает через следующие стадии:
110
|
0.5H2O |
|
H3CHC |
O |
H3CC |
O |
|
|
M+3 |
M+3 |
OOH |
||
|
0.25O2 |
|
M+2 + H+ |
M+2 + H+ |
H CC |
O |
|
|
|
||||
|
|
|
|
|
3 |
OO |
|
|
|
|
|
|
|
O |
|
O |
H3CC |
O |
|
|
|
|
|
|
|||
2H3CC |
H3CC |
OOH |
|
O2 |
|
|
OH |
|
|
|
|
||
|
H3CHC O |
|
|
|
|
|
|
H3CHC |
O |
H3CC |
O |
|
(3.46) |
|
OO |
|
||||
|
|
|
|
|
|
|
Вначале |
гомолитически |
рвется |
связь |
С-Н при |
карбонильном |
|
углероде ацетальдегида, давая радикал водорода и ацильный радикал. Атом водорода окисляется катионом металла (М+3) до протона, а металл при этом восстанавливается до М+2. Ацил-радикал присоединяет молекулу кислорода образуя перацетат-радикал, который отрывает атом водорода от молекулы ацетальдегида, давая молекулу надуксусной кислоты и новый ацил-радикал (цикл по ацил-радикалу замыкается). Надуксусная кислота, являясь очень сильным окислителем, окисляет ацетальдегид, в результате чего образуются две молекулы продукта - уксусной кислоты. Каталитический цикл по металлу замыкается окислением М+2 до М+3 либо кислородом, либо перацетат-радикалом.
При наличии соединений меди в качестве сокатализатора протекает реакция образования уксусного ангидрида за счет превращения ацилрадикала в координационной сфере Cu+2:
H2O |
Cu+2(OOCCH3)2 |
O |
|
H3CC |
O
H3CC OH
OH
HOCu+2OOCCH3 H3CC  Cu+2(OOCCH3)2
Cu+2(OOCCH3)2
O
O
|
|
|
|
H3CC |
O |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
C |
|
|
|
|
H3 |
|
|
|
|
C |
|
|
|
|
|
+ |
|
|
|
|
O |
|
+ |
|
O |
|
H3CC |
|
H CC |
|
||
OH |
|
|
|
3 |
|
|
|
|
|
|
|
Cu+1OOCCH3
O H3CC OOH
OOH
O H3CC O
O
H3CC
O
(3.47)
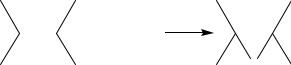
111
Ацил-радикал входит в координационную сферу ацетата меди (II), где отдает свой электрон иону меди и соединяется с ацетат-анионом, образуя продукт реакции - уксусный ангидрид. Ацетата меди (I) окисляется надуксусной кислотой до основного ацетата меди (II), который на завершающей стадии цикла по обменной реакции с уксусной кислотой снова превращается в ацетата меди (II). В промышленности таким способом осуществляют процесс совместного получения уксусной кислоты и уксусного ангидрида из ацетальдегида.
3.3.2.2.ГЕТЕРОЛИТИЧЕСКИЙ МЕХАНИЗМ ОКИСЛЕНИЯ
Окисление органических соединений по гетеролитическому механизму осуществляется внутри координационной сферы комплекса металла. Примерами промышленно важных процессов, протекающих по такому механизму, являются эпоксидирование непредельных соединений органическими гидропероксидами и окисление этилена до ацетальдегида.
3.3.5.2.1.Эпоксидирование олефинов органическими гидроперекоксидами
Реакцию |
эпоксидирования |
|
олефинов |
органическими |
|||||
гидропероксидами: |
|
|
|
|
|
|
|
||
|
|
|
|
+ ROOH |
|
|
|
+ ROH |
(3.48) |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
O |
||
|
|
|
|
|
|
|
|
||
катализируют комплексы жестких металлов: Mo, W, Ti в высоких
степенях окисления (+4) - (+6). |
цикла |
– |
активация |
||
Ключевая |
стадия |
каталитического |
|||
гидропероксида в координационной сфере металла за счет передачи электронной плотности от атома кислорода гидроперексида к металлу, в результате чего второй атом кислорода приобретает электрофильные
свойства и способность взаимодействовать с -электронами олефина, образуя эпоксид. Механизм, предложенный Шелдоном в 1973 г [18], приведен на рисунке ниже:
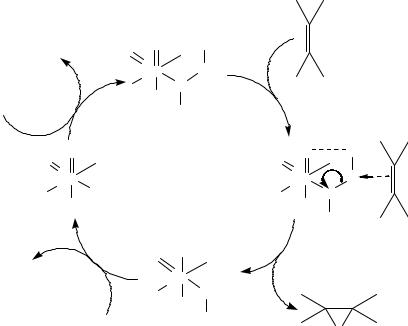
S
ROOH
O O
Mo
S
S
ROH
S
112
O |
O |
|
H |
|
|
|
|
|
|
|
|
|
Mo |
O |
O |
|
|
|
S |
|
|
|
|
|
|
R |
|
|
|
|
|
|
O |
O |
H |
|
|
|
|
|
|
|
|
|
|
Mo |
O |
|
|
|
|
S |
O |
|
|
|
|
|
R |
|
O |
OH |
|
|
|
|
|
|
|
|
|
|
|
Mo |
O |
|
|
|
|
S |
|
|
|
|
|
R |
|
(3.49) |
|
|
|
|
|
|
O |
где S – лабильный лиганд.
Позднее Шарплесс [19], на основании влияния стерического фактора, предположил, что гидропероксид координируется с центральным атомом через дальний по отношению к углероду атом кислорода (см. рис. ниже путь А). Еще один альтернативный механизм предложил Мимон (Mimoun) [20-24]. Согласно этому механизму находящийся в координнационной сфере олефин далее вступает в скорость-лимитирующую
реакцию |
внедрения |
по |
связи |
металл-кислород. |
Образовавшийся |
псевдоциклический |
диоксометаллоциклопентан быстро |
распадается с |
|||
образованием продукта эпоксидирования (см. рис. ниже путь Б).
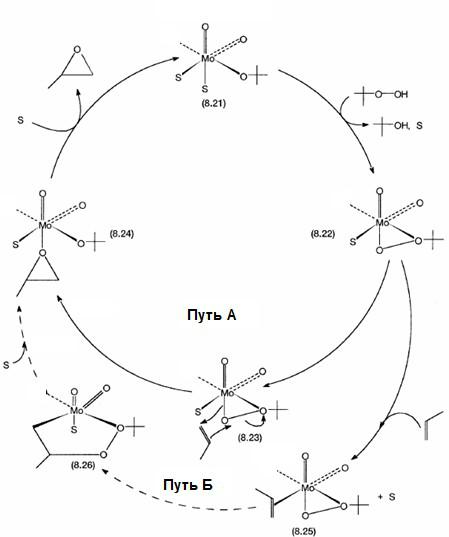
113
Рис. Альтернативные механизмы эпоксидирования пропилена третбутилгидропероксидом на молибденовом катализаторе.
Следует обратить внимание, что для активации «жесткого» кислородного атома эффективны комплексы «жестких» металлов.
Факторы, влияющие на эффективность катализаторов эпоксидирования.
Увеличение льюисовской кислотности металла (жесткости) увеличивает эффективность катализа. Поэтому комплексы MoVI активнее комплексов WVI.
Электронно-акцепторные лиганды также увеличивают эффективность катализатора. Например, ацетилацетонатный комплекс молибдена [MoO2(acac)2] активнее гликолевого комплекса [MoO2(diol)2] из-за сильных электроно-акцепторных свойств ацетилацетона (обусловленных
обратным -связыванием с *-разрыхляющими орбиталями карбонильных групп.
3.3.5.2.2. Окисление этилена до ацетальдегида
