
Органическая химия - Лекции - МГУ - Ненайденко - 2004 / Лекция 25 - Металлокомплексный анализ
.pdf
Лекция 25
Металлокомплексный катализ

Электронное и пространственное строение комплексов. Правила подсчета электронов. Основные типы реакций комплексов: диссоциацияассоциация, лигандный обмен, окислительное присоединение, восстановительное элиминирование, миграция, внедрение. Каталитический цикл. Реакция Хека.

Эти реакции не происходят без Pd -катализатора!
Ph |
Br |
бензол |
Ph |
SCH2CH3 |
|
+ Li+ -SCH2CH3 |
Pd(PPh3)4 |
|
+ Li+ Br- |
H |
H |
H |
H |
|
|
|
|
|
93 % |
катализаторы
|
|
|
H3C |
|
CH3 |
|
|
|
Pd P |
|
86 % |
CH3 |
|
|
|
|
|
H |
H |
3 |
4 |
+ |
|
|
+ |
|
|
|
|
|
|
CH3CN, Et3N |
|
HBr |
|
Br |
H |
H |
|
||
|
|
||||
|
|
|
125 °C, 18 ч |
нейтрализуется Et3N |
|
|
|
|
|
||

Металлокомплексы могут быть заряженными и нейтральными
PPh |
|
PPh3 |
3 |
|
|
Cl Rh PPh |
3 |
Ph3P Pd PPh3 |
|
|
|
PPh |
|
PPh3 |
3 |
|
|
катализатор Уилкинсона тетракис(трифенилфосфинопалладий)
Cl |
NH3 |
H3N |
NH3 |
3+ |
|
NH3 |
|||||
Co |
|||||
|
Pt |
|
|
||
Cl |
NH3 |
H3N |
NH3 |
NH3 |
|
цис-диаминодихлорплатина(II) |
|
|
|||
cis -platin, противоопухолевый препарат |
гексааминокобальт(III) ион |
||||
нейтральный комплекс |
комплексный ион |
||||
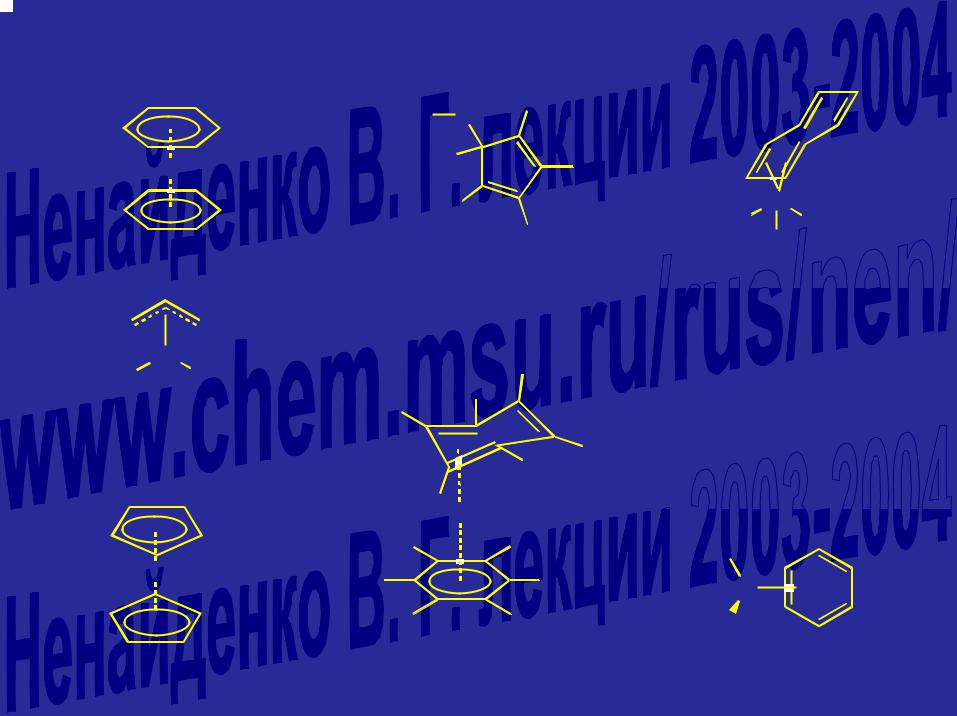
Гаптность металлокомплексов – число центров лиганда, связанных с металлом |
|||||
|
|
Et3P |
Cu |
H |
|
|
|
|
|
||
|
Cr |
|
H |
H |
|
|
|
|
|
||
|
|
|
H |
|
Fe |
|
|
|
H |
OC COCO |
|
бис−(η6-бензол)-хром (0) |
|
|
|||
|
|
(η1-циклопентадиенил)(триэтил- |
η4-(циклооктатетраен)трикарбо- |
||
|
|
фосфин)-медь(I) |
|
нилжелезо (0) |
|
|
Cl Pd PPh3 |
|
|
CH3 |
|
|
|
H3C |
CH3 |
|
|
3 |
-аллил)(трифенилфосфин)- |
|
|
|
|
(η |
|
|
CH3 |
|
|
палладий(II)-хлорид |
|
|
|
||
|
|
|
|
CH3 |
|
|
|
H3C Ru |
|
|
|
|
Fe |
H3C |
|
CH3 |
R3P |
|
H3C |
|
CH3 |
Ni |
|
|
|
|
|||
|
|
H3C |
|
CH3 |
R P |
|
|
|
|
|
3 |
бис−(η5-циклопентадиенил)- |
(η6-гексаметилбензол)(η4- |
(η2-бензол)-бис- |
|||
железо(II) (ферроцен) |
гексаметилбензол)рутений(0) |
(триалкилфосфин)никель(0) |
|||

|
|
|
|
|
|
|
|
Характеристики лигандов |
|
число |
||||
|
|
|
|
|
|
|
|
|
|
|
|
формальный заряд |
валентных |
|
анионные лиганды |
|
|
|
|
|
|
электронов |
|||||||
|
|
|
|
|
|
|
|
|
||||||
Cl Br |
|
I CN |
OR H |
алкил |
|
|
|
|
|
-1 |
2 |
|||
нейтральные σ−донорные |
|
|
|
|
|
|
|
|
||||||
|
P |
R |
|
N |
R |
|
O |
S |
|
C |
N |
C |
0 |
2 |
R |
|
R |
|
R |
R |
R |
R |
|
|
|
|
|
||
R |
|
R |
O |
C |
N |
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
R |
R |
|
|
ненасыщенные σ- или π-донорные |
|
|
гапность |
|
|
|
|
|||||||
арил, σ-аллил |
|
|
|
|
|
|
η1 |
|
|
-1 |
2 |
|||
алкены |
|
|
|
|
|
|
|
|
η2 |
|
|
0 |
2 |
|
π-аллил катион |
|
|
|
|
|
|
η3 |
|
|
+1 |
2 |
|||
π-аллил анион |
|
|
|
|
|
|
η3 |
|
|
-1 |
4 |
|||
сопряжённый диен |
|
|
|
|
η4 |
|
|
0 |
4 |
|||||
диенил, циклопентадиенил (анионы) |
|
η5 |
|
|
-1 |
6 |
||||||||
арены, |
триены |
|
|
|
|
|
|
η6 |
|
|
0 |
6 |
||
триенил, циклогептатриенил (анионы) |
|
η7 |
|
|
-1 |
8 |
||||||||
циклооктатетраен |
|
|
|
|
|
η8 |
|
|
0 |
8 |
||||
карбен, нитрен, O2 |
|
|
|
|
η1 |
|
|
0 |
2 |
|||||

Лиганд |
|
Название |
Аббревиатура |
Тип |
электоны |
||
H3N: |
|
|
амино |
|
L |
2 |
|
H2O: |
|
аква |
|
L |
2 |
||
R3P: (R = алкил, арил) |
триалкилфосфино |
|
L |
2 |
|||
|
|
|
триарилфосфино |
|
L |
2 |
|
:С=O: |
|
карбонил |
CO |
L |
2 |
||
H2C=CH 2 |
этилен |
|
L |
2 |
|||
CH3C |
N |
ацетонитрил |
MeCN |
L |
2 |
||
|
|
|
бензол |
|
L |
6 |
|
F-, Cl-, Br-, I- |
галогено (хлоро) |
X |
X |
2 |
|||
H- |
O |
|
гидридо |
|
X |
2 |
|
|
|
ацетато |
AcO |
X |
2 |
||
H3C C O |
|||||||
|
|
|
|
||||
R:- ( H3C:- ) |
алкил (метил) |
|
X |
2 |
|||
C |
N |
|
циано |
CN |
X |
2 |
|
H2C |
H |
CH3 |
аллил |
|
LX |
4** |
|
C |
|
||||||
|
|
|
циклопентадиенил |
Cp |
L2X |
6 |
|

Устойчивые комплексы имеют 18 (16) электронов
Группа |
IVB (4) |
VB (5) |
VIB (6) |
VIIB (7) |
VIIIB (8, 9, 10) |
1A (11) |
||
Число валентных |
|
|
|
|
|
|
|
|
электронов |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
3d |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
4d |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
5d |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
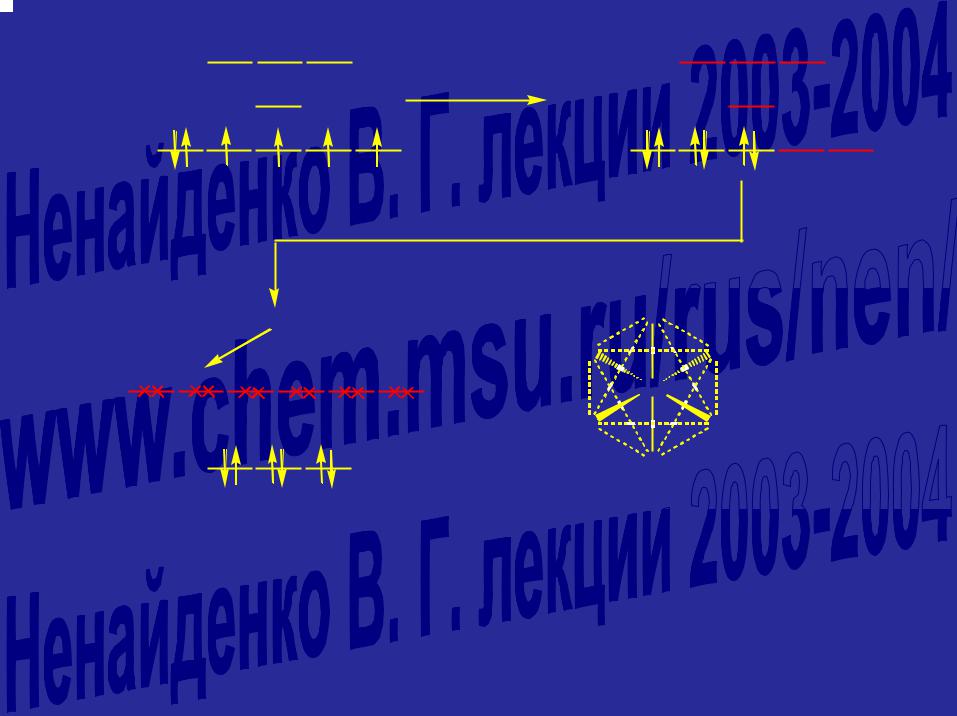
Негибридизованный Co3+(d6)
4p |
спаривание |
4p |
4s |
электронов |
4s |
|
||
3d6 |
|
3d6 |
(a) |
|
(b) |
|
N |
электороны цианида |
C |
NC |
CN |
d2sp3 |
Co |
NC |
CN |
3d6 |
C |
незадействованы в гибридизации |
N |
|
|
(c) |
(d) |
Орбитальная картина [Co(CN)6]3-, 18-ти электронный комплексный ион.
а) Электронная конфигурация Co3+.
b) Электроны объединены в пары.
с) Пустые орбитали гибридизованы в шесть эквивалентных d2sp3 орбиталей.

энергия
Cl |
NH3 |
|
Pt |
Cl |
NH3 |
квадратный плоский
6p
пустые, негибридизованы
электроны лигандов
dsp2 гибридные
5d8
