
Катализ / Вопросы - Козловский - 2004 / Вопросы для самоконтроля
.docВопросы для самоконтроля:
-
При гетерогенно-каталитическом гидрировании двойных связей в растительном масле, катализируемом суспендированным Ni в реакторе с мешалкой при скорости вращения мешалки 150 об/мин наблюдаемая энергия активации составила 15 кДж/моль, а при скорости вращения 2000 об/мин - 90 кДж/моль. Объяснить этот эффект.
-
В некоторой гетерогенно-каталитической реакции снижение температуры процесса с 400 оС до 300 оС привело к значительному увеличению наблюдаемой энергии активации. Объяснить этот эффект.
-
Энтальпия адсорбции азота на Fe -147 кДж/моль, а на Pd -12 кДж/моль. Какой тип адсорбции (физ-/хим-) осуществляется?
-
Кинетическое уравнение гетерогенно-каталитической реакции (А + В Р) имеет первый порядок по А и обратный порядок по В. По какому из известных механизмов может протекать эти реакция? Объяснить.
-
Объяснить почему часто наблюдаются вулканоподобные зависимости относительной каталитической активности в рядах переходных металлов в различных гетерогенно-каталитических реакциях.
-
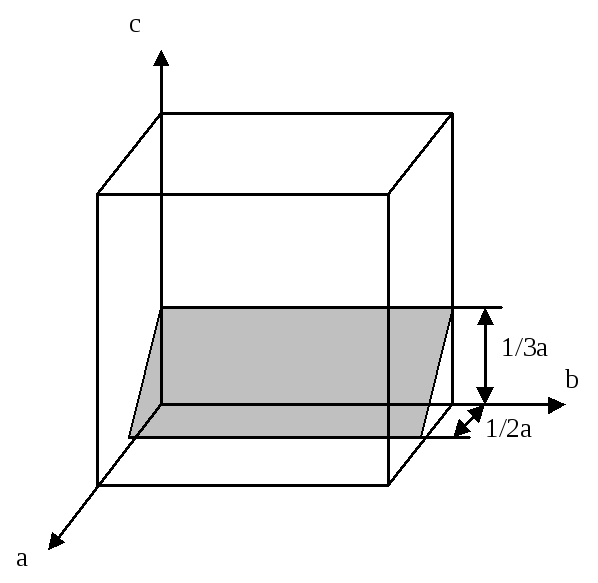
Что отражают индексы Миллера? Изобразить в трехмерном координатном пространстве расположение кристаллографичесой плоскости (203).
-
Каковы причины различия в каталитической активности разных кристаллографических плоскостей одного и того же катализатора в одной и той же реакции?
-
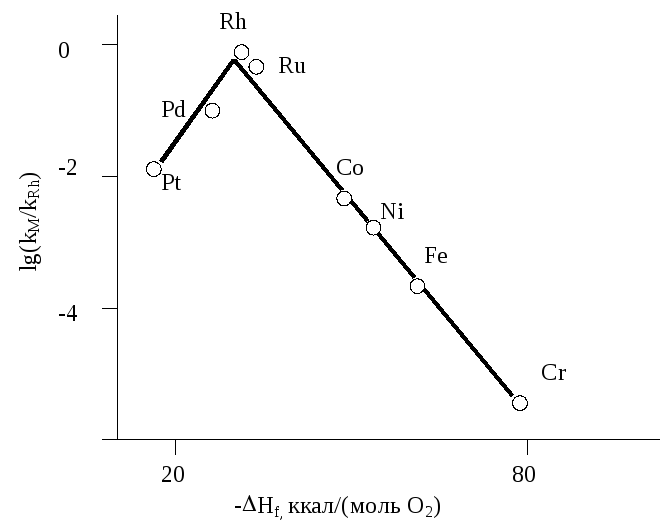
Объяснить следующий характер зависимости каталитической активности переходных металлов в реакции гидрирования этилена от энтальпии образования высшего оксида соответствующего металла:
Ответы:
-
При низкой скорости вращения мешалки лимитирующей стадией процесса являлась внешняя диффузия (т.е. реакция протекала во внешнедиффузионной области). Скорость процесса лимитировалась скоростью диффузии через приповерхностный слой, которая характеризуется низкими значениями наблюдаемой энергии активации. При увеличении скорости вращения мешалки возросла линейная скорость движения внешней фазы вдоль поверхности катализатора и скорость диффузии резко увеличилась и превысила скорость химической реакции на поверхности катализатора. Таким образом реакция стала протекать в кинетической области. Лимитирующей стадией стало химическое превращение, имеющее высокую энергию активации.
-
При температуре 400 оС реакция протекала в диффузионной области (т.е. лимитирующей стадией была диффузия реагентов к активным центрам, а скорость химической реакции на много выше). Поэтому наблюдаемая энергия активации находилась в диапазоне, характерном для диффузионных процессов (5-20 кДж/моль). При снижении температуры скорость химической реакции уменьшилась в гораздо большей степени, чем скорость диффузии, так как энергия активации диффузии в несколько раз меньше, чем энергия активации химической реакции (для которой характерны значения 80-120 кДж/моль), а скорости и диффузии, и химической реакции экспоненциально зависят от температуры (ri exp(-Ei/(RT)). Таким образом скорость химической реакции стала меньше скорости диффузии (т.е. стала лимитирующей стадией) и процесс перешел в кинетическую область. Соответственно, наблюдаемая энергия активации стала близка к значению энергии активации химической стадии.
-
На железе протекает хемосорбция азота, а на палладии - физадсорбция. Для хемосорбции характерны высокие значения тепловых эффектов (близкие к тепловым эффектам химических реакций), а для физадсорбции - низкие значения (близкие к тепловым эффектам конденсации).
-
Вероятно реакция протекает по механизму Лэнгмюра-Хиншельвуда. Оба реагента хемосорбируются на поверхности катализатора, затем протекает химическая реакция на поверхности и десорбция продуктов реакции. В этом случае общее кинетическое уравнение выглядит так:
rЭФ = (kKАРАKВРВ)/(1 + KАРА + KВРВ)2
В данной реакции реагент В адсорбируется гораздо сильнее реагента А, то есть KВРВ >> (1 + KАРА ). В этом случае общее кинетическое уравнение принимает вид:
rЭФ = (kKАРАKВРВ)/( KВРВ)2 = kKАРА/( KВРВ) = kЭФРА/РВ
т.е. первый порядок по А и обратный порядок по В.
-
Как правило теплота адсорбции газов уменьшается в рядах переходных металлов слева направо. Это говорит о том, что энергия связи адсорбат-адсорбент (и стабильность поверхностного комплекса) также уменьшается в том же направлении. Поэтому в левой части ряда металлы образуют слишком устойчивые и поэтому мало реакционноспособные поверхностные комплексы с реагентами (Рис. 5.16 - большой тепловой эффект адсорбции приводит к высокой энергии активации реакции и к снижению скорости). А металлы в правой части ряда, напротив, образуют слабую связь с адсорбатом, что является причиной низкой поверхностной концентрации адсорбата и слабой его активации. Все это является причиной низкой каталитической активности. Поэтому наиболее активные металлы часто расположены в центральной части ряда.
-
Индексы Миллера для кристаллографической плоскости показывают, какие и сколько кристаллографических осей элементарной кристаллической решетки пересекает данная плоскость. Численно они равны обратным значениям длин отсекаемых отрезков, выраженных целыми относительными числами. Индекс (203) означает, что длины отрезков пересечения с осями а, в, с соотносятся как: (1/2):():(1/3). Длина отрезка () - означает, что ось "в" не пересекается плоскостью. Таким образом кристаллографическая плоскость распологается в кристалличесой решетке следующим образом: Параллельна оси "в", ось "а" пересекает на расстоянии половины длины ребра кубической ячейки, а ось "с" на расстоянии 1/3 длины ребра кубической ячейки.
-
Причины различия в каталитической активности разных кристаллографических плоскостей одного и того же катализатора в одной и той же реакции заключаются в следующем: 1) Различное взаимное расположение атомов на разных плоскостях; 2) Различные расстояния между атомами на разных плоскостях; 3) Различная координационная ненасыщенность атомов поверхности на разных плоскостях.
-
Известно, что зависимость каталитической активности переходных металлов в различных реакциях от теплоты адсорбции реагентов имеет вулкано-подобный (экстремальный) характер. Это объясняется тем, что высокие значения теплоты адсорбции сопровождают образование слишком устойчивых поверхностных соединений, которые трудно превращаются в продукты реакции. Низкие теплоты адсорбции характеризуют слабое взаимодействие катализатора и реагента. При этом степень активации реагента и его поверхностная концентрация низки, поэтому скорость реакции так же низка. Поэтому наиболее активны бывают металлы с некоторой средней (оптимальной) теплотой адсорбции реагентов. Известно также, что для многих веществ (адсорбатов) соблюдается линейная корреляция начальных теплот адсорбции на переходных металлах с энтальпией образования высших оксидов этих же металлов. Поэтому, зависимости каталитической активности переходных металлов от энтальпии образования высшего оксида соответствующего металла имеют также вулкано-подобный (экстремальный) характер. Что и наблюдается в данном примере - реакции гидрирования этилена.
