
Trojan_teplotechnic
.pdf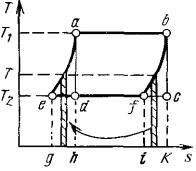
31
КПД цикла Карно зависит только от абсолютных температур горячего и холодного источников. Увеличить КПД цикла
можно либо за счет увеличения температуры горячего источника, либо за счет уменьшения температуры холодного.
3.4 Обобщенный (регенеративный) цикл Карно
При наличии только двух источников теплоты с температурами Т1 и Т2 можно осуществить более сложный цикл, если использовать регенерацию теплоты. Сущность ее заключается в следующем.
Рассмотрим цикл abfe на рисунке 3.5, состоящий из двух изотерм аb и fe и двух произвольных равновесных процессов bf и еа, линии которых эквидистантны в Т,s – диаграмме.
Рисунок 3.5. – Обобщенный (регенеративный) цикл Карно.
Для равновесного нагрева рабочего тела по линии еа и охлаждения по линии bf нужно располагать бесконечно большим количеством источников теплоты, чтобы при каждой температуре в диапазоне Т2 – Т1 теплообмен между источником теплоты и рабочим телом протекал обратимо. Однако можно осуществить процесс так, чтобы теплота δq, выделяющаяся при охлаждении тела при
температуре Т по линии bf, затрачивалась на нагрев тела при той же температуре по линии еа. Если линии еа и bf эквидистантны, то количества отданной при охлаждении (площадь ifbk) и полученной при нагреве (площадь geah) теплоты одинаковы, т.е. теплота, выделенная при охлаждении по линии bf, полностью используется (регенерируется) по линии еа.
От горячего источника при температуре Т1 по-прежнему подводится теплота q1, эквивалентная площади habk, и к холодному источнику при температуре Т2 отводится теплота q2, соответствующая площади gefi.
Термический КПД данного цикла
ηt = |
q |
− q |
2 |
= |
T1 |
(sk − sh ) −T2 |
(si − sg ) |
, |
1 |
|
|
|
|
||||
|
q1 |
|
|
T1 (sk − sh ) |
||||
|
|
|
|
|
|
|||
но sk – sh = si – sg вследствие эквидистантности кривых bf и ea, поэтому
ηt |
= |
T1 −T2 |
. |
|
|||
|
|
T1 |
|
Таким образом, обратимые циклы, подобные рассмотренному и осуществляемые так же, как и цикл Карно между двумя источниками теплоты, имеют КПД, равный КПД цикла Карно. Они на-
зываются обобщенными (регенеративными) циклами Карно.
3.5 Обратный цикл Карно
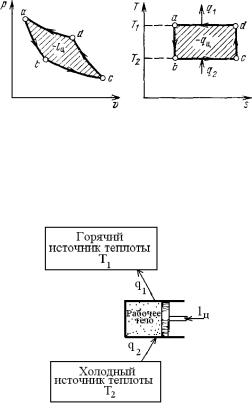
Осуществим обратимый цикл Кар- |
шее расширение происходит по изотерме, |
но в обратном направлении. Рабочее тело |
и рабочее тело отбирает от нижнего ис- |
с начальными параметрами точки а (ри- |
точника с температурой Т2 теплоту q2. |
сунок 3.6) расширяется адиабатно, со- |
Далее газ подвергается сжатию сначала |
вершая работу расширения за счет внут- |
по адиабате, и его температура от Т2 по- |
ренней энергии, и охлаждается от темпе- |
вышается до T1, а затем – по изотерме |
ратуры Т1 до температуры Т2. Дальней- |
(Т1 = const). При этом рабочее тело отдает |
32
верхнему источнику с температурой T1 количество теплоты q1.
Рисунок 3.6. – Обратный цикл Карно в р,v – и Т,s – диаграммах.
Общая схема преобразования энергии показана на рисунке 3.7.
Рисунок 3.7. – Термодинамическая схема холодильной машины.
Поскольку в обратном цикле сжатие рабочего тела происходит при более высокой температуре, чем расширение, работа сжатия, совершаемая внешними силами, больше работы расширения на величину площади abсd, ограниченной контуром цикла. Эта работа превращается в теплоту и вместе с теплотой q2 передается верхнему источнику. Таким образом, затратив на осуществление обратного цикла работу lц, можно перенести теплоту от источника с низкой температурой
к источнику с более высокой температурой, при этом нижний источник отдаст количество теплоты q2, а верхний получит количество теплоты q1 = q2 + lц.
Обратный цикл Карно является идеальным циклом холодильных установок.
В холодильной установке рабочими телами служат, как правило, пары легкокипящих жидкостей – фреона, аммиака и т.п. Процесс «перекачки теплоты» от тел, помещенных в холодильную камеру, к окружающей среде происходит за счет затрат электроэнергии.
Эффективность холодильной установки оценивается холодильным коэффициентом, определяемым как отношение количества теплоты, отнятой за цикл от холодильной камеры, к затраченной в цикле работе:
ε = q2/ lц = q2/ (q1 – q2). |
(3.8) |
Для обратного цикла Карно
ε =Т2/ (Т1 –Т2). |
(3.9) |
Заметим, что чем меньше разность температур между холодильной камерой и окружающей средой, тем меньше нужно затратить энергии для передачи теплоты от холодного тела к горячему и тем выше холодильный коэффициент.
Используя обратный цикл Карно, рассмотрим еще одну формулировку второго закона термодинамики, которую в то же время, что и В. Томсон, предложил Р. Клаузиус: теплота не может самопроизвольно (без компенсации) переходить от тел с более низкой к телам с более высокой температурой.
3.6 Аналитическое выражение второго закона |
|
|
Рассмотрим принципиальные от- |
поршень. |
|
личия необратимых процессов от обра- |
Расширение будет |
обратимым |
тимых на примере расширения газа в ци- |
(равновесным) только в том случае, если |
|
линдре под поршнем (рисунок 3.8), полу- |
температура газа Т равна температуре |
|
чающего теплоту δq от источника с тем- |
источника (T = T1), внешняя сила Р равна |
|
пературой T1 и совершающего работу |
давлению газа на поршень (P = pF) и при |
|
против внешней силы Р, удерживающей |
расширении газа нет ни |
внешнего, ни |
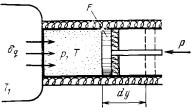
33
внутреннего трения. Работа расширения газа в этом случае равна δlобр = Рdy = pdv, а изменение энтропии рабочего тела в таком процессе dsобр = δq/T.
Невыполнение хотя бы одного из указанных условий делает расширение газа необратимым. Если необратимость вызвана трением поршня о стенки цилиндра, то работа δ1, совершаемая против внешней силы Р, оказывается меньше, чем p dv, так как часть ее затрачивается на преодоление трения и переходит в теплоту δqтр. Она воспринимается газом вместе с подведенной теплотой δq, в результате чего возрастание энтропии газа в необратимом процессе ds = (δq+δqтр)/Т оказывается больше, чем в обратимом при том же количестве подведенной от источника теплоты δq.
Рисунок 3.8. – К определению изменения энтропии в процессах.
Если необратимость вызвана отсутствием механического равновесия (P < pF), поршень будет двигаться ускоренно. Быстрое движение поршня вызывает появление вихрей в газе, затухающих под действием внутреннего трения, в результате чего часть работы расширения опять превращается в теплоту δqтр. Работа против внешней силы снова получается меньше, а возрастание энтропии - больше, чем в обратимом процессе с тем же количеством теплоты δq.
Если необратимость вызвана теплообменом при конечной разности температур (температура газа Т меньше температуры источника T1), то возрастание энтропии рабочего тела ds = δq/T оказы-
вается больше, чем dso6p = δq/T1 в обратимом процессе из-за снижения темпера-
туры газа. При том же положении поршня, т.е. заданном удельном объеме v,
меньшей температуре газа соответствует меньшее его давление р. Соответственно меньше должна быть и уравновешивающая сила Р': P' = p'F<P = pF. Работа расширения против этой силы δl = P'dy = p'dv < p dv.
Итак, необратимость всегда приводит к увеличению энтропии рабочего тела при том же количестве подведенной теплоты и к потере части работы. В общем виде это можно записать следующим образом:
ds = δq/ T + dsнеобр; δl = p dv - δlнеобр,
причем dsнеоб и δlнеобр всегда положительны.
Ранее было показано, что для обратимых процессов справедливо соотношение ds = δq/Т. Разобранный пример достаточно наглядно показывает, что в необратимых процессах ds > δq/T, если под δq понимать количество подведенной к системе или отведенной от нее теплоты. Обе записи являются аналитическим выражением второго закона термодинамики:
ds = δ q /T −в |
обратимых |
|
|
|
|
|
|
|
процессах; |
|
(3.10) |
ds > δ q /T −в |
|
|
|
необратимых |
|
||
|
процессах. |
|
|
|
|
|
|
|
|
|
|
Для изолированных систем, которые по определению не обмениваются теплотой с окружающей средой (δq = 0), эти выражения приобретают вид:
ds ≥ 0. |
(3.11) |
Если в адиабатно – изолированной системе осуществляются равновесные процессы, то энтропия системы остается постоянной.
Самопроизвольные (а значит, и необратимые) процессы в изолированной системе всегда приводят к увеличению энтропии. Это положение представляет

|
34 |
собой наиболее общую формулировку |
названием принципа возрастания энт- |
второго начала термодинамики для не- |
ропии. |
равновесных процессов, известную под |
|
4 Основные термодинамические процессы в газах и парах
4.1 Термодинамические процессы идеальных газов в закрытых системах
Основными процессами, весьма важными и в теоретическом, и в прикладном отношениях, являются изохорный, протекающий при постоянном объеме; изобарный, протекающий при постоянном давлении; изотермический, происходящий при постоянной температуре; адиабатный – процесс, при котором отсутствует теплообмен с окружающей средой, и политропный, удовлетворяющий уравнению p vn = const.
Метод исследования процессов, не зависящий от их особенностей и являющийся общим, состоит в следующем:
1)выводится уравнение процесса, устанавливающее связь между начальными и конечными параметрами рабочего тела в данном процессе;
2)вычисляется работа изменения объема газа;
3)определяется количество теплоты, подведенной (или отведенной) к газу в процессе;
4)определяется изменение внутренней энергии системы в процессе;
5)определяется изменение энтропии системы в процессе.
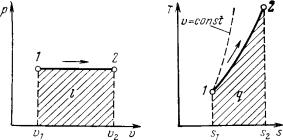
Изохорный процесс. При изохор-
ном процессе выполняется условие dv = 0 или v = const. Из уравнения состояния идеального газа (1.3) следует, что
p/T = R/ v =const,
т.е. давление газа прямо пропорционально его абсолютной температуре:
р2/ р1 = T2/ T1. |
(4.1) |
На рисунке 4.1 представлен график процесса.
Работа расширения в этом процессе равна нулю, так как dv = 0.
Количество теплоты, подведенной к рабочему телу в процессе 12 при cv = const, определяется из соотношения
(2.23):
T2
q = ∫cv dT = cv (T2 −T1 ). (4.2)
T1
Рисунок 4.1. – Изображение изохорного процесса в р,v– и Т,s – координатах.
При переменной теплоемкости
q = c t2 (t −t ) =
vm t1 2 1
= с |
vm |
t2 |
t |
2 |
−c |
vm |
t1 |
t |
1 |
, |
(4.3) |
|
0 |
|
|
0 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
где c t2 – средняя массовая изохорная
vm t1
теплоемкость в интервале температур от
t1 до t2.
Так как l = 0, то в соответствии с первым законом термодинамики ∆u = q
и
∆u = cv (T2 |
−T1 ) |
|
при |
cv |
|
|
|
|||||
|
= const; |
(4.4) |
||||||||||
|
|
|
t2 (t |
|
|
|
|
|
|
|
||
∆u = c |
|
|
|
−t |
) |
при |
с |
|
= var. |
|
||
|
|
|
|
|
||||||||
|
vm |
|
t1 |
|
2 |
1 |
|
|
|
v |
|
|
|
|
|
|
|
|
|
||||||
Поскольку внутренняя энергия является функцией состояния тела, то формулы (4.4) справедливы для любого термодинамического процесса идеального газа.
35
Изменение энтропии в изохорном процессе определяется по формуле (3.2):
2 |
δ q |
2 |
dT |
|
T2 |
|
|
s2 − s1 = ∫ |
= cv ∫ |
= cv ln |
, (4.5) |
||||
T |
T |
T |
|||||
1 |
|
1 |
|
1 |
|
||
т.е. зависимость энтропии от температуры в изохорном процессе при cv = const имеет логарифмический характер (см. рисунок 4.1).
Изобарный процесс. Изобарным называется процесс, происходящий при постоянном давлении. Из уравнения состояния идеального газа (1.3) при p = const находим:
v/ T = R/ p = const,
или
v2/ v1 = T2/ T1, |
(4.6) |
т.е. в изобарном процессе объем газа пропорционален его абсолютной температуре (закон Гей-Люссака). На рисунке 4.2 изображен график процесса.
Рисунок 4.2. – Изображение изобарного процесса в р,v – и Т,s – координатах.
Из выражения (2.6) следует, что
v2
l = ∫ pdv = p(v2 −v1 ). (4.7)
v1
Так как pv1 = R T1 и pv2 =R T2, то одновременно
l = R (T2 – T1). |
(4.8) |
Количество теплоты, сообщаемое газу при нагревании (или отдаваемое им
при охлаждении), находим из уравнения
(2.23):
|
|
|
|
T2 |
|
|
|
|
|
|
q = ∫cp dT = cpm |
t2 |
(t2 |
−t1 ) , (4.9) |
|
|
|
|
t1 |
||||
|
|
|
|
T1 |
|
|
|
где |
cpm |
|
t |
– средняя массовая изобарная |
|||
|
|||||||
|
t2 |
||||||
|
|
|
1 |
|
|
|
|
теплоемкость в интервале температур от t1 до t2; при ср = const.
q = cp (t2 –t1). |
(4.10) |
Изменение энтропии при ср = сonst согласно (3.2) равно:
s2 – s1 = cp ln (T2/ T1), |
(4.11) |
т.е. температурная зависимость энтропии при изобарном процессе тоже имеет логарифмический характер, но поскольку cp > cv, то изобара в Т,s – диаграмме идет более полого, чем изохора.
Изотермический процесс. При изотермическом процессе температура постоянна, следовательно,
p v = R T = const,
или
p2/ p1 = v1/ v2, |
(4.12) |
т.е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – падает (закон Бойля – Мариотта).
Графиком изотермического процесса в р,v – координатах, как показывает уравнение (4.12), является равнобокая гипербола, для которой координатные оси служат асимптотами (рисунок 4.3).
Работа процесса:
|
v2 |
|
v2 |
|
dv |
|
|
|
|
∫ |
|
∫ |
|
|
|
||
l = |
|
pdv = |
|
RT |
v |
= RT ln(v |
2 |
/ v ) = |
|
|
|
||||||
|
|
|
|
|
|
|
1 |
|
|
v1 |
|
v1 |
|
|
|
|
|
|
|
= RT ln( p1 / p2 ) |
|
(4.13) |
||||
Так как температура не меняется, то внутренняя энергия идеального газа в
36
данном процессе остается постоянной (∆u = 0) и вся подводимая к газу теплота полностью превращается в работу расширения:
q = l. |
(4.14) |
При изотермическом сжатии от газа отводится теплота в количестве, равном затраченной на сжатие работе.
Рисунок 4.3. – Изображение изотермического процесса в p,v и T,s – координатах.
Из соотношений (3.2), (4.13) и (4.14) следует, что изменение энтропии в изотермическом процессе выражается формулой
2
s2 − s1 = ∫δq / T = q / T =
1
= R ln( p1 / p2 ) = R ln(v2 / v1 ) . (4.15)
Адиабатный процесс. Процесс,
происходящий без теплообмена с окружающей средой, называется адиабатным. Согласно определению δq = 0, для того чтобы осуществить такой процесс, следует либо теплоизолировать газ, т.е. поместить его в адиабатную оболочку, либо провести процесс настолько быстро, чтобы изменение температуры газа, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа. Как правило, это возможно, ибо теплообмен происходит значительно медленнее, чем сжатие или расширение газа.
Уравнения первого закона термодинамики для адиабатного процесса принимают вид:
сp dT – v dp = 0 и cv dT + p dv = 0.
Поделив первое уравнение на второе, получим:
сp dT |
= − |
vdp |
, или k |
dv |
= − |
dp |
. |
|
cv dT |
pdv |
v |
p |
|||||
|
|
|
|
Интегрируя последнее уравнение при условии, что k = cp/ cv = const, находим:
v2 |
p2 |
k ∫dv / v = −∫dp / p и |
|
v1 |
p1 |
k ln(v2 / v1 ) = ln( p1 / p2 ) .
После потенцирования имеем:
(v2/ v1)k = p1/ p2,
или
p vk |
= |
p |
2 |
vk . |
(4.16) |
|
1 |
1 |
|
|
2 |
|
|
Это и есть уравнения адиабаты идеального газа при постоянном отношении теплоемкостей (k = const). Величина
k = cp/ cv |
(4.17) |
называется показателем адиабаты (см. таблицу 2.1). Подставив сp = сv + R, по-
лучим k = 1+ R / сv.
Рисунок 4.4. – Изображение адиабатного процесса в p,v – и T,s – координатах.
Поскольку k > 1, то в координатах р,v (рисунок 4.4) линия адиабаты идет круче линии изотермы: при адиабатном расширении давление понижается быстрее, чем при изотермическом, так как в процессе расширения уменьшается тем-

37
пература газа.
Определив из уравнения состояния, написанного для состояний 1 и 2, отношение объемов или давлений и подставив их в (4.16), получим уравнение адиабатного процесса в форме, выражающей зависимость температуры от объема или давления:
T / T = (v / v |
2 |
)k −1 |
; |
|
||||
2 |
1 |
1 |
|
|
|
|
|
|
T / T = ( p |
|
/ p ) |
k −1 |
|
||||
2 |
k |
. |
(4.18) |
|||||
2 |
1 |
|
1 |
|
|
|
||
Работа расширения при адиабатном процессе согласно первому закону термодинамики совершается за счет уменьшения внутренней энергии и может быть вычислена по одной из следующих формул:
l = – ∆u = сv (Т1 – Т2) =
R |
|
RT |
|
|
P |
|
k −1 |
|
|
|||
|
|
k |
|
|
; (4.19) |
|||||||
|
|
(T1 −T2 ) = |
1 |
|
|
2 |
|
|
|
|||
k −1 |
|
k −1 |
|
1 |
− |
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
так как p1v1 = RT1 и p2v2 = RT2, то
l= k 1−1 ( p1v1 − p2 v2 ) . (4.20)
Вданном процессе теплообмен газа с окружающей средой исключается,
поэтому q = 0. Выражение с = δq/ dT показывает, что теплоемкость адиабатного процесса равна нулю.
Поскольку при адиабатном процессе δq = 0, энтропия рабочего тела не изменяется (ds = 0 и s = const). Следовательно, на Т,s – диаграмме адиабатный процесс изображается вертикалью.
Политропный процесс и его обобщающее значение. Политропным называется процесс, который описывается уравнением
pvn = const. |
(4.21) |
Показатель политропы п может принимать любое численное значение в пределах от – ∞ до + ∞, но для данного
процесса он является величиной постоянной.
Из уравнения (4.21) и уравнения Клапейрона нетрудно получить выражения, устанавливающие связь между р, v и Т в любых двух точках на политропе, аналогично тому, как это было сделано для адиабаты:
p2/ p1 = (v1/ v2)n; T2/ T1 =(v1/ v2)n-1;
T / T = ( p |
|
/ p ) |
n−1 |
|
||
2 |
n |
. |
(4.22) |
|||
2 |
1 |
1 |
|
|
|
|
Работа расширения газа в политропном процессе
v2
l = ∫ pdv .
v1
Так как для политропы в соответствии с (4.22)
p = p1 (v1/ v)n,
то
|
|
|
|
|
|
v |
|
|
|
p1v1 |
|
|
|
|
|
|||
|
l = p1v1n ∫2 dv / vn = |
|
|
[1− |
|
|||||||||||||
n −1 |
|
|||||||||||||||||
|
|
|
|
|
|
v1 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
n−1 |
|
|
p1v1 |
|
|
|
p2 |
|
n−1 |
|
|
||||
|
|
|
|
n |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|||||||||||
|
v1 |
|
|
] = |
|
|
|
|
|
|
|
|
. (4.23) |
|||||
|
|
|
n −1 |
p |
|
|
||||||||||||
− v |
|
|
|
|
1 |
− |
|
|
|
|
||||||||
|
2 |
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В случае идеального газа уравнения (4.23) можно преобразовать к виду
l = |
R |
(T |
|
−T |
); |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
n −1 |
1 |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
p1v1 |
|
|
|
|
T 2 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
l = |
|
− |
|
|
|
|
|
|
|
|
||||||||
|
|
1 |
|
|
|
; |
|
|
|
|
|
|
||||||
n −1 |
|
T |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
(4.24) |
||
|
RT1 |
|
|
|
|
P2 |
|
|
n−1 |
|
|
|||||||
|
|
|
|
n |
|
|
|
|
||||||||||
l = |
|
− |
|
|
|
|
|
|
|
|
||||||||
|
1 |
|
|
|
|
|
|
|
|
; |
|
|||||||
n −1 |
|
P |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l = |
( p v |
− p |
v |
2 |
). |
|
||||||||||||
|
|
|||||||||||||||||
|
n −1 |
|
1 |
|
1 |
|
|
2 |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Количество подведенного (или отведенного) в процессе тепла можно определить с помощью уравнения первого за-
38
кона термодинамики:
q = (u2 – u1) + l.
Поскольку
и2 – и1 = сv (Т2 – Т1 ), l = 1 −Rn (T2 −T1 ) ,
то
q = c |
v |
|
n − k |
(T −T ) = |
||||
|
|
n −1 |
||||||
|
|
|
2 |
1 |
||||
= cn (T2 |
−T1 ) , |
(4.25) |
||||||
где |
|
|
|
|
|
|
n − k |
|
c |
n |
= c |
v |
|
(4.26) |
|||
|
n −1 |
|||||||
|
|
|
|
|
||||
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cп = const, поэтому политропный процесс иногда определяют как процесс с постоянной теплоемкостью. Изменение энтропии
|
|
|
2 δq |
|
T |
= |
|
∆s = ∫ T = cn ln T |
|||||||
|
|
|
|
|
2 |
|
|
|
|
1 |
|
1 |
|
||
= c |
v |
|
n − k |
×ln |
T2 |
. |
(4.27) |
|
n −1 |
|
|||||
|
|
|
T |
|
|||
|
|
|
|
|
1 |
|
|
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность термодинамических процессов. Нетрудно убедиться, что:
для изохорного процесса n = ± ∞,
cn = cv;
для изобарного процесса п = 0,
cп = cр,
для изотермического процесса
n = 1, cn = ∞;
для адиабатного процесса n = k,
cn = 0.
На рисунке 4.5 показано взаимное расположение на р,v – и Т,s – диаграммах
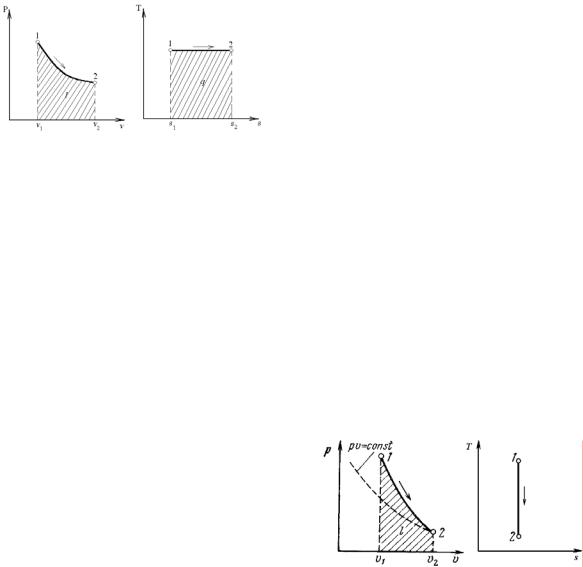
политропных процессов с разными значениями показателя политропы. Все процессы начинаются в одной точке.
Рисунок 4.5. – Изображение основных термодинамических процессов идеального газа в р,v – и Т,s – координатах.
Изохора (n = ±∞) делит поле диаграммы на две области: процессы, находящиеся правее изохоры, характеризуются положительной работой, так как сопровождаются расширением рабочего тела; для процессов, расположенных левее изохоры, характерна отрицательная работа.
Процессы, расположенные правее и выше адиабаты (n = k), идут с подводом теплоты к рабочему телу; процессы, лежащие левее и ниже адиабаты, протекают с отводом теплоты.
Для процессов, расположенных над изотермой (n = 1), характерно увеличение внутренней энергии газа; процессы, расположенные под изотермой, сопровождаются уменьшением внутренней энергии.
Процессы, расположенные между адиабатой и изотермой, имеют отрицательную теплоемкость, так как δq и du (а следовательно, и dT) имеют в этой области противоположные знаки. В таких процессах l > q , поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела.
4.2.Термодинамические процессы реальных газов
Вкачестве реального газа рас- и прежде всего в теплоэнергетике, где он
смотрим водяной пар, который широко |
является основным рабочим телом. По- |
используется во многих отраслях техники |
этому исследование термодинамических |
39
свойств воды и водяного пара имеет большое практическое значение.
Процесс парообразования. Основные понятия и определения. Рас-
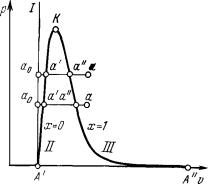
смотрим процесс получения пара. Для этого 1 кг воды при температуре 0 ˚С поместим в цилиндр с подвижным поршнем. Приложим к. поршню извне некоторую постоянную силу Р. Тогда при площади поршня F давление будет постоянным и равным p = P/F. Будем изображать процесс парообразования, т.е. процесс превращения вещества из жидкого состояния в газообразное в р,v – диаграмме (рисунок 4.6).
Рисунок 4.6. – p,v – диаграмма водяного пара.
Начальное состояние воды, находящейся под давлением р и имеющей температуру 0 ˚С, изобразится на диаграмме точкой ao. При подводе теплоты к воде ее температура постепенно повышается до тех пор, пока не достигнет температуры кипения ts, соответствующей данному давлению. При этом удельный объем жидкости сначала уменьшается, достигает минимального значения при t = 4 ˚С, а затем начинает возрастать. Состояние жидкости, доведенной до температуры кипения, изображается на диаграмме точкой а'.
При дальнейшем подводе теплоты начинается кипение воды с сильным увеличением объема. В цилиндре теперь находится двухфазная среда – смесь воды и пара, называемая влажным насыщенным паром. По мере подвода теплоты количество жидкой фазы уменьшается, а паровой – растет. Температура cмеси при
этом остается неизменной и равной ts, так как вся теплота расходуется на испарение жидкой фазы. Следовательно, процесс парообразования на этой стадии является изобарно – изотермическим. Наконец, в некоторый момент времени последняя капля воды превращается в пар, и цилиндр оказывается заполненным только паром, который называется сухим насыщенным. Состояние его изображается точкой а".
Насыщенным называется пар, находящийся в термическом и динамическом равновесии с жидкостью, из которой он образуется. Динамическое равновесие заключается в том, что количество молекул, вылетающих из воды в паровое пространство, равно количеству молекул, конденсирующихся на ее поверхности. В паровом пространстве при этом равновесном состоянии находится максимально возможное при данной температуре число молекул. Пар является насыщенным в том смысле, что при изотермическом сжатии часть его сконденсируется без изменения давления и плотности. При увеличении температуры количество молекул, обладающих энергией, достаточной для вылета в паровое пространство увеличивается. Равновесие восстанавливается за счет возрастания давления пара, которое ведет к увеличению его плотности и, следовательно, количества молекул, в единицу времени конденсирующихся на поверхности воды. Отсюда следует, что давление насыщенного пара является монотонно возрастающей функцией его температуры, или, что тоже самое, температура насыщенного пара есть монотонно возрастающая функция его давления.
При увеличении объема над поверхностью жидкости, имеющей температуру насыщения, некоторое количество жидкости переходит в пар, при уменьшении объема «излишний» пар снова переходит в жидкость, но в обоих случаях давление пара остается постоянным.
Насыщенный пар, в котором отсутствуют взвешенные частицы жидкой фазы, называется сухим насыщенным па-
40
ром. Его удельный объем и температура являются функциями давления. Поэтому состояние сухого пара можно задать любым из параметров – давлением, удельным объемом или температурой.
Двухфазная смесь, представляющая собой пар со взвешенными в нем капельками жидкости, называется влаж-
ным насыщенным паром. Массовая доля сухого насыщенного пара во влажном называется степенью сухости пара и обозначается буквой х. Массовая доля кипящей воды во влажном паре, равная
1 – х, называется степенью влажности.
Для кипящей жидкости х = 0, а для сухого насыщенного пара х = 1. Состояние влажного пара характеризуется двумя параметрами: давлением (или температурой насыщения ts, определяющей это давление) и степенью сухости пара.
При сообщении сухому пару теплоты при том же давлении его температура будет увеличиваться, пар будет перегреваться. Точка а изображает состояние перегретого пара и в зависимости от температуры пара может лежать на разных расстояниях от точки а". Таким образом, перегретым называется пар, температура которого превышает температуру насыщенного пара того же давления.
Так как удельный объем перегретого пара при том же давлении больше, чем насыщенного, то в единице объема перегретого пара содержится меньшее количество молекул, значит, он обладает меньшей плотностью. При изотермическом сжатии его давление и плотность возрастают, т.е. он является ненасыщенным. Состояние перегретого пара, как и любого газа, определяется двумя любыми независимыми параметрами.
Если рассмотреть процесс парообразования при более высоком давлении, то можно заметить следующие изменения. Точка а0, соответствующая состоянию 1 кг воды при 0 ˚С и новом давлении, остается почти на той же вертикали, так как вода практически несжимаема. Точка а' смещается вправо, ибо с ростом давления увеличивается темпера-
тура кипения, а жидкость при повышении температуры расширяется. Что же касается пара (точка а"), то несмотря на увеличение температуры кипения удельный объем пара все-таки падает из-за более сильного влияния растущего давления.
Поскольку удельный объем жидкости растет, а пара падает, то при постоянном увеличении давления мы достигнем такой точки, в которой удельные объемы жидкости и пара сравняются. Эта точка называется критической. Так как все различия между газом и жидкостью связаны с разницей в плотности (или удельном объеме), то в критической точке свойства жидкости и. газа становятся одинаковыми. Для воды параметры кри-
тической точки |
К |
составляют: |
ркр |
= |
= 221,29·105 Па, |
tкр = 374,15 ˚С, |
vкр |
= |
|
= 0,00326 м3/кг. |
|
|
|
|
Критическая |
температура |
– |
это |
|
максимально возможная температура сосуществования жидкости и насыщенного пара. При температурах, больших критической, возможно существование только перегретого пара. Все газы являются сильно перегретыми парами. Чем выше температура перегрева (при данном давлении), тем ближе газ по своим свойствам к идеальному газу.
Наименьшим давлением, при котором еще возможно равновесие воды и насыщенного пара, является давление, соответствующее тройной точке. Под последней понимается то единственное состояние, в котором могут одновременно находиться в равновесии пар, вода и лед (точка А' на рисунке 4.6). Параметры тройной точки для воды: р0 = 611 Па, t0 = 0,01 ˚С, v0 = 0,001 м3/кг. Процесс па-
рообразования, происходящий при абсолютном давлении р0 = 611 Па, показан на диаграмме изобарой А'А", которая практически совпадает с осью абсцисс. При более низких давлениях пар может сосуществовать лишь в равновесии со льдом. Процесс образования пара непосредственно из льда называется сублимацией.
Если теперь соединить одноименные точки плавными кривыми, то полу-
чим нулевую изотерму I, каждая точка
