
- •10.Диссоциация воды, ионное произведение воды. РН растворов. Водно-электролитный баланс в организме человека. РН биологических жидкостей.
- •11.Буферные растворы, классификация буферных растворов. Механизм буферного действия. РН буферных растворов. Уравнение Хендериксона-Хоссельбаха для буферных растворов кислотного и основного типов.
- •12.Буферные растворы. Буферная емкость. Буферные системы в организме человека, их роль в поддержании гомеостаза рН. Буферные системы крови.
- •17.Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Температурный коэффициент химических и биохимических процессов. Понятие об энергии активации
- •18.Обратимые и необратимые реакции. Константа равновесия. Принцип Ле-Шателье.
- •19.Поверхностные явления. Поверхностное натяжение жидкостей. Поверхностно-активные и поверхностно-неактивные вещества. Правило Дюкло-Траубе. Сорбционные процессы: адсорбция, абсорбция, хемосорбция.
- •20.Адсорбция на поверхности раздела жидкость-газ и жидкость-жидкость. Уравнение Гиббса. Ориентация молекул в поверхностном слое. Представления о структуре биологических мембран.
- •21.Адсорбция на поверхности раздела твердое вещество-газ. Факторы, определяющие адсорбцию на поверхности твердого тела. Уравнение Ленгмюра. Физическая и химическая адсорбция.
- •23.Дисперсные системы. Классификация дисперсных систем по степени дисперсности. Коллоидное состояние. Лиофильные и лиофобные коллоидные системы.
- •26.Понятие о лиофобных золях. Мицелярная теория строения лиофобных золей.
- •27.Устойчивость коллоидных систем. Агрегационная и седиментационная устойчивость. Коагуляция. Коагуляция под действием сильных электролитов. Порог коагуляции. Правила Шульца-Гарди. Коллоидная защита.
- •29.Факторы термодинамической устойчивости растворов вмс. Методы осаждения белков. Особенности высаливания биополимеров из растворов. Коацервация и денатурация белков.
1.Периодический закон Д.И. Менделеева, его современная формулировка. Структура периодической системы с точки зрения строения атома. Периодичность изменения свойств атомов: энергия ионизации, электроотрицательность, энергия сродства к электрону. Основные классы химических соединений. Классификация биогенных элементов. Качественное и количественное содержание макро- и микроэлементов в организме человека. Элементы - органогены.
Периодический закон Д.И. Менделеева: Химические свойства атома или элемента находяться в периодической зависимости от строения атомного ядра или Св-ва химических элементов, а также формы и св-ва соединений элементов находяться в периодической зависимости от величины заряда ядер их атомов.
Структура периодической системы с точки зрения строения атома: В 1869 г. Д.И. Менделеев обнаружил природную связь и объединил все элементы, открыв периодический закон. Физический смысл периодического закона: Порядковый номер элемента равен заряду ядра атома; Элементы в периодической системе размещены в порядке возрастания ядер их атомов; Кол-во протонов и ионов равно порядковому номеру; Кол-во нейтронов равно разности между нуклонным числом и протонным числом. Периодическая система состоит из рядов, периодов и групп. Периоды бывают малые (содержат по 8 элементов), (1, 2, 3) и большие (содержат 18 и более элементов), (4, 5, 6, и 7-ой не завершённый). Состоят из 2-х рядов: чётный содержит только металлы, а не чётнный содержит металлы и неметаллы.
Периодичность изменения свойств атомов: энергия ионизации-это минимальная энергия необхадимая для отщепления электрона от невозбуждеённого атома и преобразование его на катион.
Электронегативность - это электрооотрицательность - относительная способность его атомов притягивать электроны при связывании с другими атомами.
Энергия сродства к электрону. Определение: энергия, которая выделяется (реже поглощается) при присоединении электрона к атому. Э0+е?Э- rат.<r (аниона).
Выводы. Характер изменения энергии сродства к электрону в группе: в группе сверху вниз увеличивается радиус атома, силы электростатического взаимодействия «+» заряженного ядра и внешних электронов ослабевают, поэтому энергия сродства к электрону уменьшается. В периоде слева направо уменьшается радиус атома, количество электронов на внешнем уровне увеличивается, поэтому энергия сродства к электрону тоже увеличивается.
Обозначение: Е. Размерность эВ/атом, кДж/моль Имеет чаще всего отрицательные значения. Наибольшее отрицательные значения Е имеют атомы галогенов.
Основные классы химических соединений: Соли, к-ты, основания, оксиды.
Оксиды - бинарные соединения элементов с Оксигеном не связаны с друг с другом. Не считая фтора, кислород — самый электроотрицательный химический элемент, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2.
К-ты - это слажные вещества, которые содержат атомы гидрогена, способные замещаться металлом и кислотным остатком или Кислоты - это водородосодержащие соединения, водород которых может быть замещён на металл с образованием соли.
Соли - это сложные вещества образованные атомами металлов и кислотными остатками.
Основания - это сложные в-ва, состоящие из атомов металла и гидроксильной групы ОН.В водном растворе диссоциируют с образованием катионов и анионов ОН-. Хорошо растворимые в воде основания называются щёлочами.
Классификация биогенных элементов:
В составе живого вещества найдено более 70 элементов.
Элементы необходимые организму для построения и жизнедеятельности клеток и органов, называют биогенными элементами.
Существует несколько классификаций био-генных элементов:
А) По их функциональной роли:
1) органогены, в организме их 97,4% (С, Н, О, N, Р, S), входят в состав белков, ферментов, витаминов, гормонов, нуклеиновых к-т и воды.
2) элементы электролитного фона (Na, К, Ca, Mg, Сl). Данные ионы металлов состав-ляют 99% общего содержания металлов в организме;
3) Микроэлементы – это биологически активные атомы центров ферментов, гормонов (переходные металлы).
Б) По концентрации элементов в организме биогенные элементы выделяют:
1) макро-элементы;
2) микроэлементы; Na2SO4*10H2O-глауберовая соль; Na2CO3*10H2O-кристалическая сода;
3) ультрамикроэлементы.
К макроэлементам относят те элементы, рекомендуемая суточная доза потребления которых составляет более 200 мг. Макроэлементы, как правило, поступают в организм человека вместе с пищей. Суточная потребность макроэлементов (натрий, калий, кальций, магний, фосфор) более 100 мг.
Биогенные элементы: Кислород — 65 %, Углерод — 18 %, Водород — 10 %, Азот — 3 %.
Микроэлементы: железо, золото, йод, кальций, магний, медь, селен, серебро, фосфор, хром, цинк. Суточная потребность микроэлементов в организме человека (железа, меди, йода, фтора, селена) — менее 100 мг.
2.Биогенные s- элементы. Связь между электронным строением s- и р- элементов и их биологическими функциями. Биохимическая роль и медико-биологическое значение биогенных s- элементов (водород, литий, натрий, калий, кальций, магний). Соединения s- элементов в медицине.
Свойства и биологическая роль некоторых s-элементов. Биогенные элементы подразделяют на три блока: s-, р-, d– блоки. Химические элементы, в атомах которых заполняются электронами, s-подуровень внешнего уровня, называют s-элементами. Строение их валентного уровня ns№-І. Небольшой заряд ядра, большой размер атома способствуют тому, что атомы s-элементов – типичные активные металлы; показателем этого является невысокий потенциал их ионизации.
Биохимическая роль и медико-биологическое значение биогенных s- элементов (водород, литий, натрий, калий, кальций, магний).
Водород. Водород вместе с азотом, кислородом и углеродом входит в группу так называемых элементов-органогенов.Именно из этих элементов в основном и состоит организм человека. Для организма важны соединения, в состав которых он входит, а именно вода, белки, жиры, углеводы, витамины, биологически активные вещества (за исключением минералов) и т.д. Наибольшую ценность, конечно, представляет соединение водорода с кислородом – вода, которая фактически является средой существования всех клеток организма. Другой группой важных соединений водорода являются кислоты – их способность высвобождать ион водорода делает возможным формирование рН среды. Немаловажной функцией водорода также является его способность образовывать водородные связи, которые, например, формируют в пространстве активные формы белков и двухцепочечную структуру ДНК.
Литий является условно-эссенциальным микроэлементом. Содержание лития в организме взрослого человека составляет около 70 мг. Преимущественно он находится (по уменьшению концентрации) в мозге, печени, почках, костях, сердце, легких. Биологическая роль лития
Биологическая роль лития установлена не до конца. По разным источникам литий может оказывать следующие эффекты:1)снижает возбудимость центральной нервной системы (препараты лития применяются в психиатрии); 2)регулирует транспорт натрия в нервных и мышечных клетках; 3)снижает количество доступного свободного норадреналина в центральной нервной системе; 4)снижает содержание серотонина в центральной нервной системе; 5)увеличивает чувствительность нейронов некоторых областей мозга к действию дофамина. Наиболее важными источниками лития являются некоторые растения (томаты), рыба и морепродукты, а также печень и лёгкие.
Натрий является макроэлементом, его содержание в организме взрослого человека составляет около 150-200 граммов. Обмен регулируется натрия гормонами щитовидной железы: при ее недостаточности натрий задерживается в тканях, а при гиперфункции натрий усиленно выводится из организма. Биологическая роль натрия: 1)поддерживает осмотическое давление и рН среды; 2)вместе с калием формирует электрический потенциал мембран клеток, за счет которого передается сигнал в нервных клетках, мышечных клетках и пр.; 3)участвует в транспорте через мембраны клеток аминокислот, сахаров, неорганических и органических анионов; 4)участвует в переносе оксида углерода в крови; 5)усиливает выделение почками различных продуктов метаболизма; 6)участвует в гидратации белков и растворении органических кислот; 7)участвует в образовании желудочного сока; 8)активирует ферменты слюны и поджелудочного сока.
Калий (К). Находится в печени, почках, сердце, мышцах. Ионы Калия-раслабляют мышцы. Влияет на процес фотосинтеза. Обуславливает сердечный ритм. Входит в состав клеточного сока, поддерживает осмотическое давление клетки.
Основные функции калия в организме: 1)обеспечение возбудимости и проводимости клеток нервной системы и мышечных клеток, участие в передаче нервных импульсов и сокращении мышечных клеток; 2)поддержка осмотического давления в клетках, тканях и биологических жидкостях; 3)обеспечение кислотно-щелочного равновесия; 4)участие в нервной регуляции сердечных сокращений.
Продукты с высоким содержанием калия в нашем магазине:Зелень,Курага,Шоколад,Овощи,Орехи,Фрукты,Соя,Отруби,Мясо,Рыба.
Биологическая роль кальция. Прежде всего, кальций является важнейшим структурным компонентом костей и зубов.
Также кальций регулирует проницаемость клеточных мембран, а также инициирует ответы клеток на различные внешние стимулы. Присутствие кальция в клетки или во внеклеточной среде обуславливает дифференцировку клетки, а также сокращение мышц, секрецию и перистальтику. Кальций регулирует активность многих ферментов (включая ферменты систем свертывания крови). Кальций регулирует работу некоторых эндокринных желез, обладает десенсибилизирующим и противовоспалительным эффектом.
Продукты с высоким содержанием кальция в нашем магазине:Орехи,Фасоль,Сухофрукты,Зелень,Яблоки.
Магний относится к макроэлементам, его содержание в организме составляет около 25 г.Значительное количество магния содержится в костной ткани (депо магния).
Биологическая роль магния: 1)вляется кофактором многих ферментов, в т.ч. кокарбоксилазы и коэнзима А (принимают участие в высвобождении энергии из пищи; 2)играет значительную роль при передаче нервных импульсов и необходим для ритмичной работы сердца; 3)активно участвует в обмене белка и нуклеиновых кислот; 4)регулирует митохондрильаную выработку и перенос энергии; 5)регулирует передачу сигнала в нервной и мышечной ткани; 6)способствует расслаблению гладкомышечных волокон; 7)снижает артериальное давление; 8)угнетает агрегацию тромбоцитов; 9)он ускоряет пассаж содержимого кишечника.
Соединения s- и р- элементов в медицине:
Натрий (Na) - один из основных элементов, участвующих в минеральном обмене животных и человека. Содержится главным образом во внеклеточных жидкостях (в эритроцитах человека около 10 ммоль/кг, в сыворотке крови 143 ммоль/кг); участвует в поддержании осмотического давления и кислотно- щелочного равновесия, в проведении нервных импульсов. Применение соединений натрия в медицине. 1) Гипертонический раствор натрия хлора. В следствии большого астматического давления обезвоживает клетки и способствует плазмолизу бактерий. Такой раствор применяют наружно при лечении гнойных ран.
Калий (К). Находится в печени, почках, сердце, мышцах. Ионы Калия-раслабляют мышцы. Влияет на процес фотосинтеза. Обуславливает сердечный ритм. Входит в состав клеточного сока, поддерживает осмотическое давление клетки.
Кальций (Ca) - превалирующий катион организма, минеральный компонент скелета, макроэле-мент с множеством физиологических функций. 99% кальция организма содержится в костях скелета и зубах в виде гидроксиапатитов - соединений кальция с фосфатами. Лишь около 1% кальция находится в крови и дру-гих биологических жидкостях организма.
Магний (Mg) Суточная потребность человека в магние - 0,3-0,5 г; В организме магний накапливается в печени, затем значительная его часть переходит в кости и мышцы. В мышцах магний участвует в активировании процессов анаэробного обмена углеводов.
3.Биогенные р- элементы. Связь между электронным строением р- элементов и их биологическими функциями. Биохимическая роль и медико-биологическое значение биогенных р- элементов (углерод, азот, фосфор, кислород, сера, хлор, бром и йод). Соединения р- элементов в медицине.
р-элементы: Фосфор (P) - один из важнейших биогенных элементов, необходимый для жизнедеятельности всех организмов.Биологическая роль фосфора: необходим для нормального функционирования почек способствует росту и восстановлению организма нормализует обмен веществ важен для хорошей работы сердца является источником энергии способствует делению клеток регулирует кислотно-щелочной баланс активизирует действие витаминов уменьшает боли при артритах укрепляет зубы, десна и костную ткань участвует в регуляции нервной системы.
Препараты, содержащие иод, обладают антибактериальными и противогрибковыми свойствами, она оказывают также противовоспалительное и отвлекающее действие; их применяют наружно для обеззараживания ран, подготовки операционного поля. При приёме внутрь препараты иода оказывают влияние на обмен веществ, усиливают функцию щитовидной железы.
Сера (S). В печени-как продукты обеззараживания токсичных соединений.
Фтор (F). В виде неорганических соединений содержится главным образом в костях животных и человека - 100-300 мг/кг; особенно много фтора. в зубах. Поступает в организм животных и человека преимущественно с питьевой водой, оптимальное содержание фтора в которой 1-1,5 мг/л. При недостатке фтора у человека развивается кариес зубов, при повышенном поступлении - флюороз.
Биохимическая роль и медико-биологическое значение биогенных р- элементов (углерод, азот, фосфор, кислород, сера, хлор, бром и йод).
Углерод является элементом-органогеном.Его содержание в организме составляет 18% от общего веса, то есть более 12 кг для взрослого.
Биологическая роль углерода. Как и другие элементы-органогены, углерод в виде отдельного элемента не обладает биологическим значением, - биологической ролью обладают его соединения.
1)из различных соединений углерода (белки, жиры, углеводы, нуклеотиды, гормоны, амино- и карбоновые кислоты и др.) состоят все ткани организма; 2)является структурным компонентом всех органических соединений; 3)его соединения участвуют во всех биохимических процессах; 4)при окислении соединений углерода образуется необходимая для организма энергия. 5)оксид углерода (IV) CO2, образующаяся в результате окисления соединений углерода, стимулирует дыхательный центр, регулирует значение рН крови.
Азот – один из элементов-органогенов.Азот является составной частью таких веществ, как аминокислоты (а, следовательно, пептидов и белков), нуклеотиды, гемоглобин, некоторых гормонов и медиаторов.
Биологическая роль азота. Чистый (элементарный) азот сам по себе не обладает какой-либо биологической ролью. Биологическая роль азота обусловлена его соединениями. Так в составе аминокислот он образует пептиды и белки (наиболее важный компонент всех живых организмов); в составе нуклеотидов образует ДНК и РНК (посредством которых передается вся информация внутри клетки и по наследству); в составе гемоглобина участвует в транспорте кислорода от легких по органам и тканей.
Кислород относится к элементам-органогенам. Его содержание составляет до 65% массы тела человека, то есть более 40 кг у взрослого. Кислород наиболее распространенный окислитель на Земле, в окружающей среде он представлен в двух формах – в виде соединений (земная кора и вода: оксиды, пероксиды, гидроксиды и т.д.) и в свободном виде (атмосфера).
Фосфор относится к структурным (тканеобразующим) макроэлементам, его содержание в организме взрослого человека составляет около 700 г.
Большая часть фосфора (85-90%) находится в костях и зубах, остальное – в мягких тканях и жидкостях. Около 70% общего фосфора в плазме крови входит в органические фосфолипиды, около 30% - представлено неорганическими соединениями (10% соединения с белком, 5% комплексы с кальцием или магнием, остальное – анионы ортофосфата).
Сера является структурным макроэлементом, ее содержание в организме взрослого человека составляет около 140 г.
Сера в значительных количествах также находится и в растениях, где она содержится виде неорганических и органических соединений (содержащие серу гликозиды, аминокислоты и пр.). Какие продукты содержат серу. Наиболее важными источниками серы являются: яйцо, кунжут, соя, курица, тунец, ростки пшеницы, овес, орехи, кукуруза, фасоль, капуста, чечевица, нежирная говядина, молоко, рыба, моллюски, сыры, гречневая крупа, хлебобулочные изделия.
Хлор - один из важнейших биогенных макроэлементов, содержится во всех живых организмах.
В организме взрослого человека содержание хлора составляет 50-60 г. Биологически активной формой хлора являются хлорид-ионы.
Биологическая роль хлорид-ионов: 1)в связи с тем, что хлорид-ионы способны проникать через мембрану клеток, они вместе с ионами натрия и калия поддерживают осмотическое давление и регулируют водно-солевой обмен; 2)создают благоприятную среду в желудке для действия протеолитических ферментов желудочного сока; 3)благодаря наличию в мембранах клетоки митохондрий специальных хлорных каналов, хлорид ионы регулируют объем жидкости, трансэпителиальный транспорт ионов, создают и стабилизируют мембранный потенциал; 4)участвуют в создании и поддержании рН в клетках и биологических жидкостях организма.
Бром является условно-эссенциальным микроэлементом. Это означает, что его биологическая функция известна (или признана), однако явлений дефицита брома не наблюдают. Всего в организме взрослого человека содержится около 200 мг брома, по организму он распределяется равномерно. Биологическая роль брома. Бром избирательно усиливает ряд тормозных процессов в центральной нервной системе (ранее препараты брома назначали как успокаивающее средство). Местонахождения: гипофиз.
Биологическая роль йода. Основная биологическая роль йода заключается в синтезе гормонов щитовидной железы (тироксина и трийодтиронина), через которые он и реализует следующие эффекты:1)стимулирует рост и развитие организма; 2)регулирует рост и дифференцировку тканей; 3)повышает артериальное давление, а также частоту и силу сердечных сокращений; 4)регулирует (увеличивает) скорость протекания многих биохимических реакций; 5)регулирует обмен энергии, повышает температуру тела; 6)регулирует белковый, жировой, водно-электролитный обмен; 7)регулирует обмен витаминов; 8)повышает потребление тканями кислорода.
4.Биогенные d- элементы. Связь между электронным строением d- элементов и их биологическими функциями. Роль d- элементов в комплексообразовании в биологических системах (железо, медь, цинк, кобальт, марганец, молибден).
Свойства и биологическая роль некоторых d-элементов:
Элементы d–блока – это элементы, у которых происходит достройка d–подуровня предвнешнего уровня. Они образуют В – группы. Электронное строение валентного уровня d–элементов: (n-1)d1-10, ns1-2. Они расположены между s– и р–элементами, поэтому получили название «переходные элементы», d-элементы образуют 3 семейства в больших периодах и включают по 10 элементов (4-й период семейство Sc21 – Zn30, 5-й период – Y39 - Cd48, 6-й период - La57 – Hg80, 7-й период Ас89 – Mt109).
Вслед за лантаном 5d1 6s2 следовало ожидать появление ещё 8 элементов с всё возрастающим количеством 5d электронов. Но оказывается, что теперь 4f оболочка несколько более устойчива, чем 5d, так что у последующих 14 элементов электроны заполняют 4f оболочку, пока она целиком не застроится. Эти элементы называются f-элементами, они занимают в периодической системе одну клетку с лантаном, так как имеют общие с ними свойства и называются лантаноиды.
Особенности d-элементов определяются электронным строением их атомов: во внешнем электронном слое содержится, как правило, не более 2 s-электронов, р-подуровень свободный, происходит заполнение d-подуровня предвнешнего уровня. Свойства простых веществ d-элементов определяется в первую очередь структурой внешнего слоя, и лишь в меньшей степени зависят от строения предшествующих электронных слоев. Невы-сокие значения энергии ионизации этих атомов указывают на сравнительно слабую связь внешних электронов с ядром.
Железо входит в группу эссенциальных (жизненно важных) микроэлементов.
Биологическая роль железа: 1)обеспечивает транспорт кислорода (входит в состав гемоглобина); 2)обеспечивает транспорт электронов в окислительно-восстановительных реакциях организма (входит в состав цитохромов и железосеропротеидов); 3)участвует в формировании активных центров окислительно-восстановительных ферментов.
Пищевые источники железа.Наиболее богаты железом следующие продукты: красное мясо, чечевица, фасоль, птица, рыба, листовые овощи, сыр тофу, и пр. Железо легче усваивается из мяса (гемовое железо), чем из овощей.
Кобальт входит в группу эссенциальных (жизненно необходимых) микроэлементов, его содержание в организме взрослого человека составляет 0,2 мг/кг.
Пищевые источники кобальта (цианокоболамина): Витамин В12 содержится только в продуктах животного происхождения. Основные источники - печень, почки, мясо, рыба, яйца, молоко, молочные продукты, обогащенные пищевые продукты.
Медь является одним из важнейших эссенциальных (жизненно-необходимых) микроэлементов.
В организме взрослого человека содержание меди составляет примерно 100-200 мг, при этом около 50% всей меди находится в мышцах, а еще 10% в печени. В организме человека способствует процессам кроветворения, синтеза гемоглобина, образовании пигмента меланина. В организме растений принимает участие в процессе фотосинтеза.
Цинк относится к эссенциальным (жизненно необходимым) микроэлементам, его содержание в организме взрослого человека составляет 1,5-2 г.
Преимущественно цинк находится в скелетных мышцах (63% всего цинка).
Значительные концентрации цинка обнаружены в коже, волосах, костной ткани, печени, сетчатке глаза, предстательной железе. Биологическая роль цинка: 1)является компонентом многих ферментов в организме (известно о более 300); 2)влияет на рост клеток, особенно в время их репродукции и дифференциации; 3)участвует в обмене нуклеиновых кислот, транскрипции; 3)участвует в обмене белков; 4)участвует в обмене витамина А; 5)поддерживает концентрацию витамина Е в крови, в т.ч. облегчая его всасывание; 6)участвует в связывании некоторых гормонов с соответствующими рецепторами; 7) поддерживает репродуктивную функцию; 8)участвует в кроветворении; 9)участвует в процессах регенерации кожи, секреции сальных желез; 10)участвует в росте ногтей, волос; 11)повышает иммунитет; 12)снижает эффект токсических веществ; 13)участвует в работе вкусовых и обонятельных рецепторов.
Марганец относится к эссенциальным (жизненно важным) микроэлементам.
Его содержание в организме взрослого человека составляет 12-20 мг.
Наибольшие концентрации марганца наблюдают в головном мозге, печени, почка, поджелудочной железе.
Биологическая роль марганца: 1)активирует или входит в состав многих ферментов; 2)является катализатором некоторых реакций в организме человека; 3)участвует в синтезе белка, нуклеиновых кислот, нейромедиаторов; 4)участвует в обмене инсулина, гормонов щитовидной железы; 5)препятствует окислению свободными радикалами, обеспечивая стабильность клеточных мембран; 6)регулирует функционирование мышц, развитие соединительной ткани, хрящей, скелета; 7)повышает утилизацию жиров и углеводов.
Молибден является эссенциальным (жизненно необходимым) микроэлементом.
Его содержание в организме взрослого человека составляет примерно 5 мг, наибольшие его концентрации наблюдают в печени и почках.
Биологическая роль молибдена
Молибден - кофактор многих ферментов, которые обеспечивают метаболизм аминокислот (содержащих в своей структуре атом серы), а также ферментов, обеспечивающих метаболизм пуринов и пиримидинов.1)повышает эффективность применения антиоксидантов (например, витамина С); 2)является важным компонентом тканевого дыхания; 3)улучшает накопление азота в организме; 4)увеличивает синтез аминокислот в организме.
5.Комплексные соединения. Классификация комплексных соединений по заряду координационной сферы. Координационная теория А.Вернера. Понятия об ионе комплексообразователе, лигандах, координационном числе. Биологические комплексы железа, кобальта, меди, цинка, их роль в процессах жизнедеятельности.
Комплексные соединения называется элементные объекты состоящие из более простых в-в, а в комплексных соединениях присутствует донорно-акцепторная связь.
По природе лиганда: 1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.
2) Аквакомплексы — в которых лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.
3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4].
4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: H2[CoCl4], H2[SiF6].
5) Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
По числу мест, занимаемых лигандами в координационной сфере.
Структура комплексного иона, образованного катионом металла и анионом ЭДТА
1) Монодентатные лиганды. Такие лиганды бывают нейтральными (молекулы Н2О, NH3, CO, NO и др.) и заряженными (ионы CN−, F−, Cl−, OH−, SCN−, S2O32− и др.).
2) Бидентатные лиганды. Примерами служат лиганды: ион аминоуксусной кислоты H2N — CH2 — COO−, оксалатный ион −O — CO — CO — O−, карбонат-ион СО32−, сульфат-ион SO42−.
3) Полидентатные лиганды. Например, комплексоны — органические лиганды, содержащие в своём составе несколько групп −С≡N или −COOH (этилендиаминтетрауксусная кислота — ЭДТА). Циклические комплексы, образуемые некоторыми полидентатными лигандами, относят к хелатным (гемоглобин и др.).
Координационная теория А.Вернера, современные представления о природе координационных соединений. Понятия об ионе комплексообразователе, лигандах.
Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными.
Строение комплексных соединений.
Согласно теории Вернера центральное положение в комплексных соединениях занимает, как правило, ион металла, который называют центральным ионом, или комплексообразователем.
Комплексообразователь – частица (атом, ион или молекула), координирующая (располагающая) вокруг себя другие ионы или молекулы.
Комплексообразователь обычно имеет положительный заряд, является d-элементом, проявляет амфотерные свойства, имеет координационное число 4 или 6. Вокруг комплексообразователя располагаются (координируются) молекулы или кислотные остатки – лиганды (адденды).
Лиганды – частицы (молекулы и ионы), координируемые комплексообразователем и имеющие с ним непосредственно химические связи (например, ионы: Cl–, I–, NO3–, OH–; нейтральные молекулы: NH3, H2O, CO).
Лиганды не связаны друг с другом, так как между ними действуют силы отталкивания. Когда лигандами являются молекулы, между ними возможно молекулярное взаимодействие. Координация лигандов около комплексообразователя является характерной чертой комплексных соединений.
Координационное число, его связь с геометрией комплексного иона. Природа связи в координационных соединениях.
Координационное число – это число химических связей, которые комплексообразователь образует с лигандами.
Биологическая роль комплексных соединений. Биологические комплексы железа, кобальта, меди, цинка, их роль в процессах жизнедеятельности.
Железо входит в группу эссенциальных (жизненно важных) микроэлементов.
Биологическая роль железа: 1)обеспечивает транспорт кислорода (входит в состав гемоглобина); 2)обеспечивает транспорт электронов в окислительно-восстановительных реакциях организма (входит в состав цитохромов и железосеропротеидов); 3)участвует в формировании активных центров окислительно-восстановительных ферментов.
Пищевые источники железа.Наиболее богаты железом следующие продукты: красное мясо, чечевица, фасоль, птица, рыба, листовые овощи, сыр тофу, и пр. Железо легче усваивается из мяса (гемовое железо), чем из овощей.
Кобальт входит в группу эссенциальных (жизненно необходимых) микроэлементов, его содержание в организме взрослого человека составляет 0,2 мг/кг.
Пищевые источники кобальта (цианокоболамина): Витамин В12 содержится только в продуктах животного происхождения. Основные источники - печень, почки, мясо, рыба, яйца, молоко, молочные продукты, обогащенные пищевые продукты.
Медь является одним из важнейших эссенциальных (жизненно-необходимых) микроэлементов.
В организме взрослого человека содержание меди составляет примерно 100-200 мг, при этом около 50% всей меди находится в мышцах, а еще 10% в печени. В организме человека способствует процессам кроветворения, синтеза гемоглобина, образовании пигмента меланина. В организме растений принимает участие в процессе фотосинтеза.
Цинк относится к эссенциальным (жизненно необходимым) микроэлементам, его содержание в организме взрослого человека составляет 1,5-2 г.
Преимущественно цинк находится в скелетных мышцах (63% всего цинка).
Значительные концентрации цинка обнаружены в коже, волосах, костной ткани, печени, сетчатке глаза, предстательной железе. Биологическая роль цинка: 1)является компонентом многих ферментов в организме (известно о более 300); 2)влияет на рост клеток, особенно в время их репродукции и дифференциации; 3)участвует в обмене нуклеиновых кислот, транскрипции; 3)участвует в обмене белков; 4)участвует в обмене витамина А; 5)поддерживает концентрацию витамина Е в крови, в т.ч. облегчая его всасывание; 6)участвует в связывании некоторых гормонов с соответствующими рецепторами; 7) поддерживает репродуктивную функцию; 8)участвует в кроветворении; 9)участвует в процессах регенерации кожи, секреции сальных желез; 10)участвует в росте ногтей, волос; 11)повышает иммунитет; 12)снижает эффект токсических веществ; 13)участвует в работе вкусовых и обонятельных рецепторов.
6.Основные положения теории растворов: раствор, растворитель, растворенное вещество. Классификации растворов. Факторы, определяющие растворимость.Способы выражения концентрации растворов: массовая доля, молярность, молярная концентрация эквивалентов. Растворы газообразных веществ: законы Генри, Дальтона. Растворимость газов в присутствии электролитов – закон Сеченова. Роль растворов в жизнедеятельности организма.
Раствор-это гомогенная, многокомпонентная, термодинамически устойчивая система.
Растворители — органические или неорганические жидкости или их смеси, применяемые для растворения различных веществ.
Растворенное вещество – компоненты раствора за исключением растворителя.
Классификация растворов (по содержанию растворенного вещества, по агрегатному состоянию).
Насыщенный раствор – термодинамически устойчивая равновесная система, в которой скорость растворения вещества равна скорости выделения его из раствора.
Ненасыщенный раствор – термодинамически устойчивая неравновесная система, в которой концентрация вещества меньше, чем в насыщенном растворе, и поэтому скорость растворения больше скорость выделения.
Пересыщенный раствор – термодинамически неустойчивая псевдоравновесная система, в которой концентрация вещества больше, чем в насыщенном растворе, и поэтому скорость выделения больше скорости растворения.
Концентрированный раствор – раствор с высоким содержанием растворенного вещества.
Разбавленный – с низким содержанием растворенного вещества.
Гомогенные растворы – истинные растворы.
Гетерогенные растворы – коллоидные растворы
Растворимость зависит от температуры. Все вещества с точки зрения его растворимости можно классифицировать на: Хорошо растворимые – в 100 г воды способно раствориться более 10 г. вещества; Малорастворимые — в 100 г воды способно раствориться менее 1 г. вещества; Нерастворимые — в 100 г воды способно раствориться менее 0,01 г. вещества.
Способы выражения концентрации растворов: массовая доля, молярность, молярная концентрация эквивалентов. Закон эквивалентов.
Массовая доля – отношение массы растворенного вещества к массе раствора
ω(в-ва) = m(в-ва)/m(р-ра)
Объемная доля – отношение объема газа к объему всей смеси газов
φ(газа) = V(газа)/V(смеси)
Мольная доля – отношение количества вещества в сумме количеств вещества и растворителя
χ(в-ва) = n(в-ва)/(n(в-ва)+n(р-ра))
Моляльная концентрация, или моляльность – отношение количества вещества к массе растворителя
B(в-ва) = n(в-ва)/m(р-ля) (моль/кг)
Массовая концентрация – отношение массы вещества к объему раствора
Р(в-ва) = m(в-ва)/V(р-ра) (г/л)
Титр – масса растворенного в-ва в 1 мл раствора
Т(в-ва) = m(в-ва)/V(р-ра) (г/мл)
Молярная концентрация – отношение количества растворенного вещества к объему раствора
С(в-ва) = n(в-ва)/V(р-ра) (моль/л)
Закон эквивалентов. Все вещества реагируют между собой в эквивалентных количествах.
Роль растворов в жизнедеятельности организма.
Растворами называют однородные системы переменного состава. Химический состав и физические свойства одного раствора во всех частях его объема одинаковы.
Растворы могут существовать в трех агрегатных состояниях — твердом, жидком и газообразном (парообразном). Примерами твердых растворов могут служить некоторые сплавы металлов, на-пример сплав золота и меди, а газообразных — воздух. Процесс растворения обусловлен взаимодействием частиц рас-творяемого вещества и растворителя. Растворение твердых веществ в воде и диссоциацию молекул на ионы можно представить сле-дующим образом: диполи воды, попадая в электрическое поле полярных молекул, ориентируются вокруг полярных групп или вокруг ионов, находящихся на периферии кристаллических реше-ток вещества. Притягивая к себе молекулу или ион, диполи воды ослабляют, а затем и разрывают межмолекулярные или ионные связи. В частности, вода уменьшает прочность ионной связи между ионами Nа+ и Сl или ионами Nа+ и Вг - При растворении часто проис-ходит не только разрыв связей в растворяемом веществе, но и раз-рушение ассоциаций молекул рас-творителя. В образующемся рас-творе возникают новые ассоциации, как из молекул растворителя, так и растворенного вещества (особенно при больших его кон-центрациях), а также ассоциации из обоих видов молекул.
Вода-важнейший полярный растворитель. Растворение в-ва в воде: 1) разрушение кристаллической решётки; 2) электролитическая диссоциация; 3) гидратация молекул или ионов твёрдого в-ва.
Растворы газообразных веществ: законы Генри, Дальтона. Растворимость газов в присутствии электролитов – закон Сеченова.
Закон Генри: масса газов в растворе прямо пропорциальна парцеальному давлению газа над жидкостью. m=k*р, р-парцеальное давление.
I закон Дальтона: относительное давление смеси газов, которые между собой не взаимодействуют равняется смеси парциальных давлений всех её компонентов.
Р(отн)=р1+р2+р3...;
Закон Сеченова: растворимость газоа в жидкостях в присутствии электролитов понижается; происходит высаливание газа.
7.Колигативные свойства разбавленных растворов. Диффузия. Относительное понижение давления насыщенного пара растворителя над раствором (первый закон Рауля). Понижение температуры замерзания и повышение температуры кипения растворов по сравнению с растворителем (второй закон Рауля). Криометрия, эбулиометрия, их применение в медико-биологических исследованиях.
Колигативными называют св-ва растворов, зависящие от числа кинетических(подвижных) единиц системы.
Одно из важнейших свойств жидкостей и растворов (и вообще всех веществ) – давление насыщенного пара вещества над поверхностью жидкости (или кристалла).
Давление пара над раствором отличается от давления пара над чистым веществом. Давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем
Для некоторых растворов выполняется следующая закономерность, называемая первым законом Рауля: Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
Поскольку сумма мольных долей всех компонентов раствора равна единице, для бинарного раствора, состоящего из компонентов А и В легко получить следующее соотношение, также являющееся формулировкой первого закона Рауля:
Относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества.
Второй закон Рауля можно в наиболее общем виде сформулировать следующим образом: понижение температуры замерзания и повышение температуры кипения разбавленного раствора нелетучего вещества прямо пропорционально моляльной концентрации раствора и не зависит от природы растворенного вещества.
Криометрия-совокупность методов определения молекулярной массы неэлектролитов, степени диссоциации слабых электролитов и осмотического давления, основанных на измерении разности температур замерзания чистого растворителя и растворов исследуемых веществ; используется, напр., для анализа биологических жидкостей.
Эбулиометрия-метод измерения повышения температуры кипения р-ов.
Метод криометрии имеет широкое применение при исследовании растворов, представляющих собой по меньшей мере двухкомпо-нентную систему и образующих три фазы: пар, жидкость, твердое вещество. Метод криометрии используют для определения эффективной концентрации биологических, агрономических и лекарственных сред ( кровь, молоко, клеточный сок, растворы для инъекций, почвенные растворы).
Экспериментальная задача криометрии заключается в том, чтобы сначала определить температуру замерзания чистого растворителя - воды, затем ту же величину для двух растворов мочевины различной концентрации. Из полученных данных необходимо вычислить молекулярный вес мочевины.
8.Осмос, осмотическое давление. Закон Вант-Гоффа для разбавленных растворов электролитов и неэлектролитов. Изотонический коэффициент. Поведение живой клетки в гипо-, гипер-, изотонических растворах. Роль осмоса и осмотического давления в биологических системах. Осмотическое давление крови, онкотическое давление крови.
Осмос-это система стремления к равенству концентраций растворённого в-ва.
Осмотическое давление разбавленного р-ра равно такому газовому давлению, которая имела бы растворённое вещ-во, если бы при той же температуре находилась в газообразном состоянии и занимала бы объём равный объёму р-ля.
Осмотическое давление-это внешнее давление на раствор, при котором устанавливается осмотическое равновесие(через полупроницаемую мембрану) между р-ом и чистым растворителям.
Закон Вант-Гоффа для разбавленных растворов электролитов и неэлектролитов. Изотонический коэффициент.
Закон Ван-Гоффа: осмотическое давление, разбавленных р-ов неэлектролитов прямо пропорционально молярной концентрации и абсолютной температуре р-ра и не зависит о его природы. п(пи)=с*К*Т, К-универсальная газовая постоянная 8, 31.
Изотонический коэффициент-этоотношение между экспериментальным и теоритическим значением.
і=(дельта)t^э/(дельта)t^т
Поведение живой клетки в гипо-, гипер-, изотонических растворах. Плазмолиз, гемолиз.
Гипертонические-р-ры с более высоким осмотическим давлением.
Гипотанические-р-ры с меньшим осмотическим давлением.
Гемолиз - это нарушение эритроцитов ( красных кровяных телец ). В норме эритроциты живут 120 суток, при гемолизе их жизнь снижается до 100...Обычно такая картина наблюдается у пожилых людей. Свертывание крови- ферментативный процесс, в его участии принимает комплекс белков, находящихся в плазме.
Плазмолиз — сжатие протоплазмы растительной клетки и отделение ее пристеночного слоя от целлюлозной клеточной оболочки. Плазмолиз происходит при погружении растительной клетки в гипертоническую среду, осмотическое давление которой выше, чем у вакуолярного сока клетки. В этом случае клетка теряет воду и её цитоплазма отделяется от стенок. Некоторые авторы полагают, что аналогичные явления имеют место и в клетках животных, где роль полупроницаемой оболочки выполняет клеточная мембрана.
Роль осмоса и осмотического давления в биологических системах.Осмотическое давление крови, онкотическое давление.
Роль осмотических явлений в различных физиологических про-цессах чрезвычайно велика. Постоянство осмотического давления (изоосмия) тех или иных физиологических сред (плазма, внутри-клеточная жидкость, моча и др.) представляет собой фундамен-тальное физико-химическое требование гомеостаза. Осмотическое давление плазмы крови человека составляет около 8 атмосфер. Столь высокие значения осмотического давления достигаются за счет суммарного эффекта раство-ренных в биосредах низкомолекулярных веществ и ионов. В плаз-ме, в частности, наиболее значимым компонентом является хлорис-тый натрий. На долю высокомолекулярных компонентов - белков - прихо-дится незначительная часть от общего давления, называемая онкотическим давлением..Величина онкотического давления кро-ви, вызываемого альбуминами и глобулинами, составляет только 0.03-0.04 атм. Стенка капилляров проницаема для воды и низкомолекулярных веществ, но не для белков. На артериальном конце капилляра соле-вой раствор вместе с питательными веществами переходит в меж-клеточное пространство. На венозном конце капилляра процесс идет в обратном направлении, так как венозное давление ниже онкотического давления. В результате в кровь переходят вещества, отдаваемые клетками. На клеточное осмотическое давление влияет обмен веществ. При распаде больших молекул осмолярность повышается; при син-тезе - снижается. Осмотические взаимоотношения ответственны за распределение воды в жидкостных пространствах организма.
9.Растворы электролитов. Электролиты в организме человека. Растворы слабых электролитов, теория Аррениуса. Понятия о константе диссоциации и степени диссоциации. Закон разбавления Оствальда. Теории кислот и оснований Аррениуса, Бренстеда –Лоури, Льюиса.
Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения электронов. К электролитам относятся вещества с ионной или сильнополярной ковалентной связью.
Электролиты в нашем организме это соли и минералы, которые фактически присутствуют во всех жидкостях – крови, поту, моче, и слезах. В нашем теле они могут носить как отрицательный, так и положительный заряды.
Все они жизненно важны для нормального функционирования нервной системы, кровеносной системы, мышечной системы, кровяного давления, для восстановления и пищеварения. Также они помогают контролировать количество воды в организме. Если Ваша диета состоит в основном из хлебов и мяса, то у Вас будет наблюдаться недостаток электролитов. Нужно много пить воды.
Важными электролитами являются:Натрий,Калий,Хлорид,Кальций,Магнезий,Сульфаты,Бикарбонаты.
Растворы слабых электролитов, теория Аррениуса. Понятия о константе диссоциации и степени диссоциации. Закон разбавления Оствальда.
Теория Аррениуса: процесс растворения или плавления электролитов сопровождается образованием заряженных частиц, способных проводить электрический ток.
Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоциации.
Электролитическая диссоциация-это распад вещ-ва на ионы под действием молекул растворителя. L=n/N*100%. Степень и константа диссоциации слабых электронов L:
L=h(дис.)/h(общ.)*100%. В-ва с ионной связью-сильные электролиты, а с ковалентной связью-слабые электролиты.
Закон разбавления Оствальда: при разбовление слабых электролитов их диссоциация увеличивается.
Активность. Ионная сила растворов сильных электролитов.
Активность-эфективная концентрация.
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда.
Теории кислот и оснований Аррениуса, Бренстеда –Лоури, Льюиса.

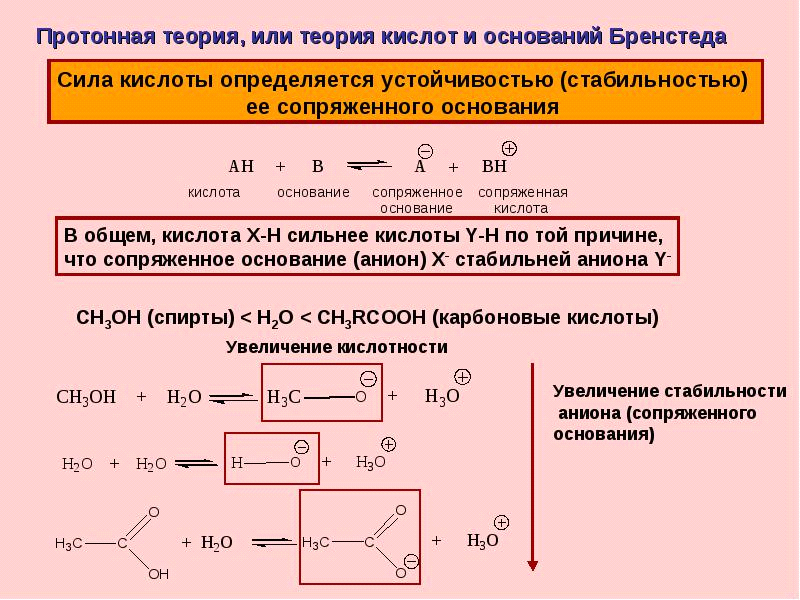

10.Диссоциация воды, ионное произведение воды. РН растворов. Водно-электролитный баланс в организме человека. РН биологических жидкостей.
Вода как слабый электролит.
Чистая вода очень плохо проводит электрический ток, но все-таки имеет измеримую электропроводимость, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксила:
Н2О = Н+ + ОН-
Действительно, при 22оС ее степень электролитической диссоциации равняется ( 1,8 *10-9, то есть диссоциирует лишь одна из 555 000 000 молекул воды. Одной из причин такой незначительной диссоциации воды является то, что диссоциация подавляется действием водородных связей, которые являются типичными для воды. Диссоциацию воды можно записать в две стадии:
Н2О = Н+ +ОН- (эндотермический процесс)
Н+ +Н2О = Н3О+ (экзотермический процесс)
Или 2Н2О = Ы Н3О+ + ОН-)
Последняя запись реакции - это запись реакции автопротолиза. Одна молекула воды играет роль кислоты (отщепляет протон), а вторая - основания (присоединяет протон). Гидратированный протон Н3О+, как мы уже знаем называется ионом гидроксония образования при диссоциации воды катионов Н3О+ и анионов ОН- свидетельствует про амфотерную ее природу и называют такие электролиты - амфолитом. По величине электропроводимости чистой воды можно вычислить концентрацию ионов водорода и ионов гидроксила в воде. При 25оС их концентрация равняется 10-7 моль/л.
Применив закон действующих масс к реакции диссоциации воды будем иметь:
Для воды и разбавленных водных растворов при постоянной температуре произведение концентраций ионов водорода и гидроксила есть величина постоянная. Эта постоянная величина называется ионным произведением воды. Численное значение ее можно выразитьтак:
К(н2о)= 10-7 *10-7 = 10-14
Величина КН2О является постоянной величиной при определенной температуре. Поскольку диссоциация воды - эндотермический процесс, то нагревание воды смещает равновесие в сторону образования ионов воды (гидроксония и гидроксила), которая вызывает увеличение величины ионного произведения воды или константы воды и наоборот.
Водно-электролитный баланс в организме человека. рН биологических жидкостей.
Водно-солевой обмен — совокупность процессов поступления воды и солей (электролитов) в организм, их всасывания, распределения во внутренних средах и выделения. Суточное потребление человеком воды составляет около 2,5 л, из них около 1 л он получает с пищей. В организме человека 2/3 общего количества воды приходится на внутриклеточную жидкость и 1/3 — на внеклеточную. Часть внеклеточной воды находится в сосудистом русле (около 5% от массы тела), большая же часть внеклеточной воды находится вне сосудистого русла, это межуточная (интерстициальная), или тканевая, жидкость (около 15% от массы тела). Кроме того, различают свободную воду, воду, удерживаемую коллоидами в виде так называемой воды набухания, т.е. связанную воду, и конституционную (внутримолекулярную) воду, входящую в состав молекул белков, жиров и углеводов и освобождающуюся при их окислении. Разные ткани характеризуются различным соотношением свободной, связанной и конституционной воды. За сутки почками выводится 1—1,4 л воды, кишечником — около 0,2 л; с потом и испарением через кожу человек теряет около 0,5 л, с выдыхаемым воздухом — около 0,4 л.
