
Книги фарма 1 / Фармакология_вит / Глава_08_НС_Противопаркинсонические
.docПРОТИВОПАРКИНСОНИЧЕСКИЕ СРЕДСТВА
Жена же Лотова оглянулась позади его, и стала соляным столпом
Бытие, 19:26
Противопаркинсоническими называют лекарственные средства, которые применяют для лечения болезни или синдрома Паркинсона. Паркинсонизм (болезнь Паркинсона, дрожательный паралич) – хроническое прогрессирующее заболевание при котором поражаются ядра экстрапирамидной нервной системы. Клиническая картина Паркинсонизма включает 4 основных синдрома:
-
Ригидность мышц – повышение тонуса скелетных мышц и затруднения при совершении пассивных движений;
-
Олигокинезия – заторможенность, обеднение движений (возможна олигомимия - маскообразное лицо, лишенное мимики); брадифрения – психическая и аффективная (чувственная) заторможенность;
-
Тремор – стереотипное ритмичное дрожание головы и рук, которое усиливается в покое и исчезает во время сна;
-
Синдром вегетативных нарушений – слюнотечение, повышенная потливость, сальность кожи (эти симптомы обусловлены преобладанием тонуса блуждающего нерва).
Развитие болезни Паркинсона сопровождается изменением психики человека – возникает психическая заторможенность, депрессия, мышление пациента вязкое, речь монотонная с преобладанием уменьшительно-ласкательных оборотов, возможны быстрые переходы от благодушия к дисфории.
Физиология и патофизиология экстрапирамидной системы. Экстрапирамидная система представлена 3 основными центрами: paleostriatum (бледным шаром), neostriatum (хвостатое ядро и скорлупа) и s. nigra (черное вещество).
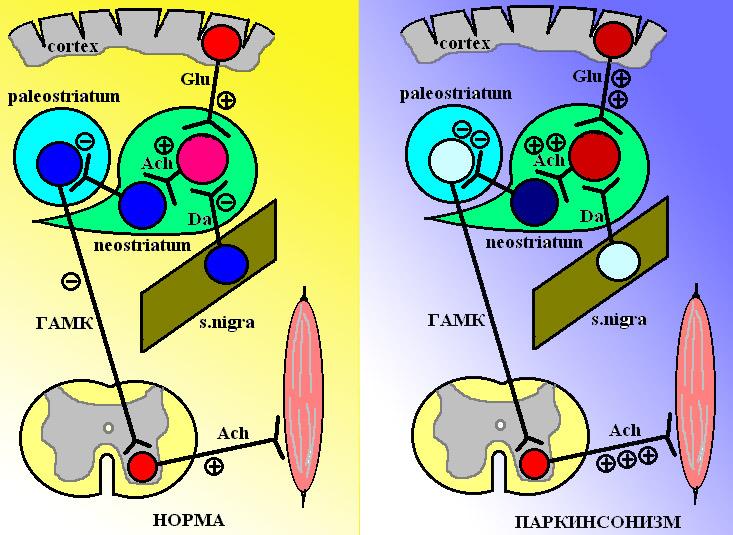
Схема 1. Слева представлены нормальные взаимоотношения между компонентами экстрапирамидной системы: наблюдается балланс дофамин- и холинергических влияний на нейроны хвостатого ядра (neostriatum). Справа представлена картина, которая имеет место у пациента с паркинсонизмом: усиление холинергических влияний на фоне недостатка тормозных дофаминергических импульсов. Ach – ацетилхолин, Glu – глютаминовая кислота, Da – дофамин.
В норме холинергические -мотонейроны спинного мозга находятся в состоянии постоянной активности и повышают тонус мышц. Функция мотонейронов спинного мозга тормозится ГАМК-ергическими нейронами бледного шара через ГАМКВ-рецепторы, расположенные на -мотонейронах (при этом тонус мышц понижается). В свою очередь, хвостатое ядро также имеет ГАМК-ергические нейроны, которые тормозят бледный шар, при этом прекращается угнетение мотонейронов спинного мозга и тонус мышц повышается.
Полноценный контроль мышечного тонуса в экстрапирамидной системе осуществляется путем взаимодействия возбуждающих глутаматергических нейронов коры, тормозных дофаминергических нейронов черного вещества и возбуждающих холинергических нейронов хвостатого ядра.
Во время физической активности глутаматергические нейроны коры головного мозга через NMDA-рецепторы стимулируют холинергические нейроны хвостатого ядра, а те, в свою очередь, повышают активность тормозных ГАМК-ергических нейронов, за счет которых хвостатое ядро тормозит бледный шар. Выключение бледного шара приводит к растормаживанию мотонейронов и повышению тонуса мышц.
В покое активируются дофаминергические нейроны черной субстанции. Они выделяют дофамин, который стимулирует постсинаптические D2-рецепторы, и тормозят тем самым холинергические нейроны хвостатого ядра. Кроме того, дофамин, выброшенный нейронами черной субстанции, стимулирует пресинаптические D1-рецепторы, которые располагаются на терминалях возбуждающих глутаматергических нейронов коры, и вызывает торможение этих нейронов (уменьшая тем самым их влияние на холинергические нейроны хвостатого ядра). В итоге, ГАМК-ергические нейроны хвостатого ядра остаются неактивными и прекращают оказывать тормозящее действие на бледный шар, он, в свою очередь, начинает тормозить -мотонейроны спинного мозга, снижая тонус мышц.
При паркинсонизме происходит гибель дофаминергических нейронов черной субстанции и тонус холинергических нейронов хвостатого ядра остается повышенным как при нагрузке, так и в покое. Глутаматергические нейроны коры постоянно стимулируют холинергические нейроны хвостатого ядра и те, в свою очередь, поддерживают ГАМК-ергические нейроны в активном состоянии. Таким образом, хвостатое ядро постоянно тормозит бледный шар и он не оказывает сдерживающего влияния на активность -мотонейронов и тонус мышц остается повышенным как в покое, так и при нагрузке.
Таким образом, при паркинсонизме имеет место дефицит дофаминергических влияний при усилении глутамат и холинергических влияний на тонус нейронов хвостатого ядра.
Классификация противопаркинсонических средств:
-
Средства, активирующие дофаминергические процессы:
-
Предшественники дофамина – леводопа;
-
Агонисты дофаминовых рецепторов – бромокриптин, перголид;
-
Средства, торомозящие метаболизм леводопы:
-
Ингибиторы ДОФА-декарбоксилазы – карбидопа, бензсеразид;
-
Ингибиторы МАО-В – селегилин;
-
Ингибиторы КОМТ – толкапон.
-
-
Средства, увеличивающие выделение дофамина – амантадин.
-
-
Средства, блокирующие М,Н-холинорецепторы в ЦНС: тригексифенидил, бипериден.
Л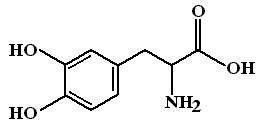 еводопа
(Levodopa,
Dopar).
Леводопа
– левовращающий изомер диоксифенилаланина,
используется для восполнения дефицита
дофамина в ядрах экстрапирамидной
системы. Поскольку ГЭБ непроницаем для
медиаторов (в том числе и дофамина),
применение для лечения паркинсонизма
самого дофамина бессмыслено и не
позволяет добиться терапевтического
эффекта. Леводопа будучи предшественником
дофамина способна проникать через ГЭБ.
еводопа
(Levodopa,
Dopar).
Леводопа
– левовращающий изомер диоксифенилаланина,
используется для восполнения дефицита
дофамина в ядрах экстрапирамидной
системы. Поскольку ГЭБ непроницаем для
медиаторов (в том числе и дофамина),
применение для лечения паркинсонизма
самого дофамина бессмыслено и не
позволяет добиться терапевтического
эффекта. Леводопа будучи предшественником
дофамина способна проникать через ГЭБ.
Механизм действия: В ядрах ЦНС леводопа подвергается декарбоксилированию до дофамина, который восполняет собственный дефицит в нейронах черной субстанции экстрапирамидно системы. Воздействуя на D2-рецепторы холинергических нейронов хвостатого ядра, дофамин снижает их активность и уменьшает стимулирующее воздействие этих нейронов на ГАМК-ергические нейроны бледного шара. Растормаживание бледного шара способствует снижению тонической активности -мотонейронов спинного мозга и снижению мышечного тонуса.
ФК: После перорального введения леводопа всасывается в кишечнике активным транспортом при помощи переносчика для ароматических аминокислот. Богатая белком пища замедляет всасывание леводопы, т.к. ароматические аминокислоты конкурируют с ней за молекулы переносчика. Однако, процессу всасывания подвергается только около 10% введенной дозы, т.к. 90% лекарства разрушается до дофамина под воздействием ДОФА-декарбоксилазы кишечника. К сожалению, из всосавшихся 10% леводопы только 1-3% дозы поступает в нервную систему, а остальное подвергается разрушению ДОФА-декарбоксилазой крови и периферических тканей. При применении леводопы следует помнить, что витамин В6 (кофермент ДОФА-декарбоксилазы) усиливает периферический метаболизм леводопы и тем самым снижает ее активность.
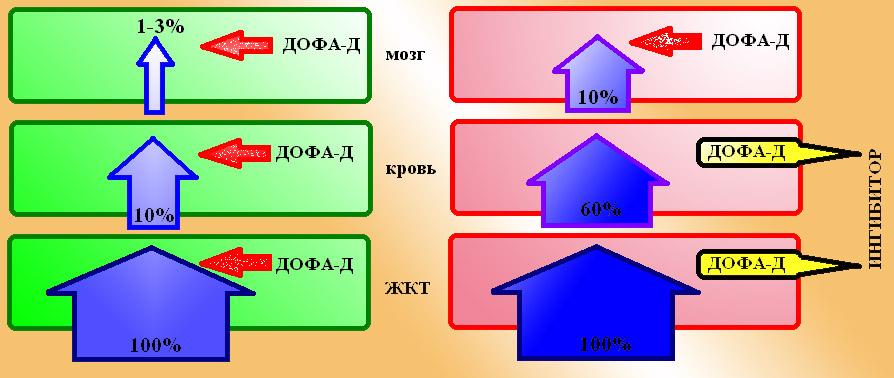
Схема 2. Метаболизм леводопы: слева поступление леводопы в ЦНС в обычных условиях, справа – та же картина при блокаде активности ДОФА-декарбоксилаз периферических тканей.
Метаболизм леводопы протекает при участии ДОФА-декарбоксилазы, которая переводит ее дафамин с последующим окислением ферментативными системами МАО и КОМТ до гомованилилминдальной кислоты.
ФЭ: Леводопа уменьшает ригидность и олигокинезию у пациентов с болезнью Паркинсона, но чрезвычайно слабо влияет на тремор. Леводопа наиболее эффективна в первые несколько лет приема, однако, со временем ее эффект снижается, а количество нежелательных эффектов начинает увеличиваться.
НЭ: При приеме леводопы нежелательные эффекты связаны в первую очередь с накоплением дофамина в ядрах ЦНС (центральные нежелательные эффекты) и периферических тканях (периферические эффекты).
Периферические нежелательные эффекты:
-
Нарушения сердечного ритма, развитие приступов стенокардии, полиурия. Тахикардия и аритмия обусловлены активацией под влиянием дофамина -адренорецепторов миокарда. Полиурия связана с расширением сосудов клубочков почек, которые несут дофаминовые D1-рецепторы, стимулируемые дофамином.
-
Анорексия, тошнота и рвота. Данные эффекты развиваются практически у каждого пациента, которому назначают даже минимальные дозы леводопы. По мере применения развивается привыкание и дозу в дальнейшем можно повышать до терапевтически значимой. Развитие рвоты связано со способностью дофамина стимулировать D1 и D5 рецепторы желудка, а также D2-рецепторы триггерной зоны рвотного центра продолговатого мозга. Триггерная зона располагается в области дна IV желудочка и лежит кнаружи от ГЭБ, поэтому ее возникновение связано не с концентрацией дофамина в ЦНС, а с его содержанием в крови и периферических тканях.
Центральные нежелательные эффекты:
-
Ортостатическая гипотензия. Ортостатическая гипотензия возникает примерно у ⅓ пациентов, которые принимают леводопу и связана, как полагают, со способностью дофамина стимулировать адренорецепторы продолговатого мозга и снижать интенсивность симпатических сосудосуживающих влияний вазомоторных центров ЦНС.
-
Оральный гиперкинез – облизывание, оскаливание, почмокивание.
-
Хореические гиперкинезы – быстрые насильственные, неконтролируемые движения, обусловлены резким возрастанием концентрации дофамина, после приема леводопы.
-
Мышечные дистонии – внезапное застывание в аномальной позе, связано с падением концентрации дофамина перед очередным приемом лекарства.
-
Феномен «включения-выключения» или «on-off»-феномен – внезапные переходы от движения к полной неподвижности.
-
Тревога, бессонница, ночные кошмары – связаны с влиянием дофамина на систему ядер шва (гипногенная зона мозга).
-
Зрительные галлюцинации, бред, психоз – обусловлены стимуляцией D2-рецепторов лимбической системы.
-
Синдром «отмены» – возникает при внезапном прекращении приема леводопы, после длительного ее использования. Проявляется полной иммобилизацией, грубым тремором, злокачественной гипертермией, дыхательной и сердечной недостаточностью. Для купирования этого состояния необходимо внутривенное введение леводопы, апоморфина или бромокриптина.
К достаточно редким нежелательным эффектам леводопы относят мидриаз и повышение внутриглазного давления (влияние на адренорецепторы радужки), гемолитическая анемия, гепато- и нефротоксичность, нарушения вкуса и обоняния, приапизм, окраска секретов (слюна, пот, слезная жидкость) в коричневый цвет.
Режим дозирования: Лечение леводопой начинают с минимальных доз (120-250 мг 4-6 раз в день), которые постепенно увеличивают до создания оптимального эффекта. Увеличение дозы проводят 1 раз в 2-3 дня на 500-1000 мг. Как правило, поддерживающая доза при монотерапии леводопой составляет 1,5-8,0 г/сут. При возникновении нежелательных эффектов центрального типа («on-off»-феномен и др.) рекомендуется перейти на более частый прием дробных доз или использовать препараты леводопы продленного действия. При возникновении гиперкинезов иногда помогают «лекарственные каникулы» - отказ от приема леводопы на 3-21 дня.
ФВ: таблетки по 0,25
Ингибиторы периферической ДОФА-декарбоксилазы. Карбидопа (Carbodopa), Бенсеразид (Benserazide). Эта группа лекарственных средств, которые сами по себе не оказывают терапевтического эффекта (противопаркинсонического действия).
М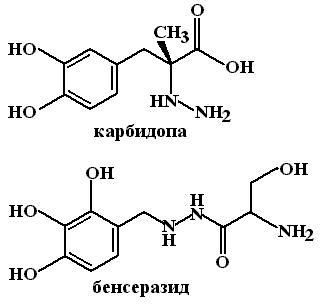 еханизм
действия: Ингибиторы ДОФА-декарбоксилазы
не проникают через ГЭБ. Они конкурируют
с леводопой в периферических тканях за
активный центр фермента и, связываясь
с ним, препятствуют декарбоксилированию
леводопы в дофамин. Таким образом, на
периферии (кишечник, печень, легкие)
разрушение леводопы прекращается и
бóльшая часть лекарственного вещества
(около 10%) достигает ЦНС. В то же время,
активность ДОФА-декарбоксилазы ЦНС не
нарушается и леводопа без помех
превращается в дофамин, который оказывает
свое терапевтическое действие.
еханизм
действия: Ингибиторы ДОФА-декарбоксилазы
не проникают через ГЭБ. Они конкурируют
с леводопой в периферических тканях за
активный центр фермента и, связываясь
с ним, препятствуют декарбоксилированию
леводопы в дофамин. Таким образом, на
периферии (кишечник, печень, легкие)
разрушение леводопы прекращается и
бóльшая часть лекарственного вещества
(около 10%) достигает ЦНС. В то же время,
активность ДОФА-декарбоксилазы ЦНС не
нарушается и леводопа без помех
превращается в дофамин, который оказывает
свое терапевтическое действие.
При лечении паркинсонизма ингибиторы ДОФА-декарбоксилаз используют совместно с препаратами леводопы (эффект потенцирования). Т.о., на фоне применения ингибиторов можно вводить меньшие дозы леводопы. Как правило эффективная доза комбинированных препаратов леводопы и ингибиторов составляет 0,5-1,0 г/сут леводопы и 100-200 мг/сут ингибитора.
Прекращение периферического декарбоксилирования леводопы снижает концентрацию дофамина в периферических тканях и уменьшает частоту и выраженность периферических нежелательных эффектов (гипотензии, тошноты, рвоты, полиурии). В то же время, усиление поступления леводопы в ЦНС чревато возрастанием частоты и выраженности центральных нежелательных эффектов (гиперкинезов, психозов, бессонницы и др.).
ФВ: Синемет (Sinemet,) таблетки по 250 мг, содержащие 200 мг леводопы и 50 мг карбидопы; Мадопар (Madopar) капсулы по 125 и 250 мг, содержащие 100 и 200 мг леводоы соответственно в комбинации с 25 и 50 мг бенсеразида.
Селегилин (Selegiline, Deprenyl, Niar). Механизм действия. Является избирательным ингибитором МАО типа B. В организме человека присуствует две изоформы фермента МАО:
-
МАО-А – располагается преимущественно на периферии (кишечник, печень, легкие) и в меньшей степени в ЦНС; проводит окислительное дезаминирование норадреналина, серотонина, дофамина, тирамина.
-
МАО-В – располагается преимущественно в ЦНС и в меньшей степени на периферии, проводит окислительное декарбоксилирование дофамина и тирамина.
В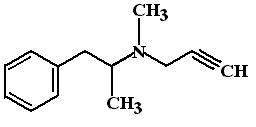 дозах менее 10 мг/сут селегилин связывается
практически исключительно с активным
центром МАО-В и нарушает способность
этого фермента разрушать дафамин.
Следовательно, на фоне селегилина эффект
леводопы усиливается и продлевается.
Это объясняется тем, что замедляется
разрушение дофамина, который образуется
из леводопы.
дозах менее 10 мг/сут селегилин связывается
практически исключительно с активным
центром МАО-В и нарушает способность
этого фермента разрушать дафамин.
Следовательно, на фоне селегилина эффект
леводопы усиливается и продлевается.
Это объясняется тем, что замедляется
разрушение дофамина, который образуется
из леводопы.
ФЭ: Сам по себе селегилин оказывает лишь минимальный антипаркинсонический эффект. Это может быть связано с тем, что эндогенного дофамина у лиц страдающих паркинсонизмом недостаточно. Однако, в комбинации с препаратами леводопы селегилин позволяет усилить ее эффект.
Показано, что селегилин замедляет прогрессирование заболевания. Возможно, что это связано с его антиоксидантным эффектом и способностью защищать дофаминергические нейроны черной субстанции от повреждающего действия свободных радикалов. К сожалению, через 1-2 года терапевтический эффект селегилина заметно ослабевает.
Показания и режим дозирования: Лечение паркинсонизма у пациентов с ухудшающимся ответом на терапию леводопой. Селегилин назначают внутрь в 2 приема по 5 мг утром и в полдник.
НЭ: Подобно ингибиторам периферической ДОФА-декарбоксилазы селегилин увеличивает частоту и выраженность центральных нежелательных эффектов леводопы.
В процессе метаболизма селегилина образуется амфетамин, который оказывает выраженное стимулирующее влияние на ЦНС, вызывая возбуждение, спутанность сознания, параноидные психотические реакции, повышение артериального давления.
Поскольку селегилин не нарушает активность МАО-А он не препятствует разрушению других аминов и не вызывает гипертонической реакции при употреблении в пищу продуктов, богатых этими аминами.
Применение с аналогичными целями неселективных ингибиторов МАО-А и В неприемлемо. При этом нарушается дезаминирование не только дофамина, но и других биогенных аминов (тирамина, серотонина), которые содержатся в ряде продуктов питания, технология производства которых связана с процессами ферментации. Употребление в пищу этих продуктов приводило бы у таких пациентов к развитию гипертонических кризов по типу «сырного» и «серотонинового» синдромов, описанных у лиц, которые принимают ингибиторы МАО для лечения депрессии.
ФВ: таблетки по 5 и 10 мг.
Толкапон (Tolcapone, Tasmar). МД: Является обратимым ингибитором КОМТ. При приеме внутрь, толкапон хорошо всасывается и проникает через ГЭБ в ЦНС. Связываясь с активным центром КОМТ он препятствует метилированию катехоламинов (в том числе и дофамина) и скорость метаболизма дофамина замедляется.
П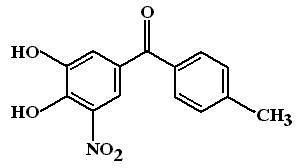 оказания
и режим дозирования: Толкапон дополняет
антипаркинсонический эффект других
лекарственных средств, тормозящих
метаболизм леводопы. Чаще всего его
применяют в сочетании с селегилином,
ингибиторами ДОФА-декарбоксилаз в
дополнение к терапии леводопой у
пациентов, которые плохо переносят
монотерапию леводопой или недостаточно
отвечают на нее. Толкапон применяют
внутрь по 100-200 мг 3 раза в день во время
еды.
оказания
и режим дозирования: Толкапон дополняет
антипаркинсонический эффект других
лекарственных средств, тормозящих
метаболизм леводопы. Чаще всего его
применяют в сочетании с селегилином,
ингибиторами ДОФА-декарбоксилаз в
дополнение к терапии леводопой у
пациентов, которые плохо переносят
монотерапию леводопой или недостаточно
отвечают на нее. Толкапон применяют
внутрь по 100-200 мг 3 раза в день во время
еды.
НЭ: Наиболее частым нежелательным эффектом является диарея, которая развивается через 2-4 месяца регулярного применения толкапона и связана с усилением перистальтики кишечника. Толкапон увеличивает частоту и выраженность центральных нежелательных эффектов леводопы, оказывает гепатотоксическое действие. Справедливости ради, следует отметить, что гепатотоксическое действие толкапона привело к запрещению его применения в ряде европейских стран. В настоящее время проводятся интенсивные клинические испытания менее токсичных ингибиторов КОМТ – энтокапона и нитекапона.
ФВ: таблетки по 100 и 200 мг.
Бромокриптин (Bromocriptin, Parlodel). Производное алкалоидов спорыньи. Механизм действия: Бромокриптин является агонистом постсинаптических D2-дофаминовых рецепторов.
Ф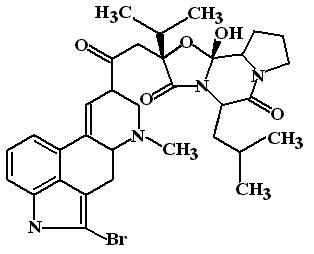 К:
Определенным недостатком бромокриптина
является его неблагоприятные
фармакокинетические свойства. Высокая
пресистемная элиминация приводит к
тому, что уже во время первого прохождения
через печень, после приема внутрь,
разрушается 70-80% принятой дозы. Кроме
того, период полуэлиминации бромокриптина
всего 2-4 часа, что требует его достаточно
частого (3 раза) применения в течение
суток.
К:
Определенным недостатком бромокриптина
является его неблагоприятные
фармакокинетические свойства. Высокая
пресистемная элиминация приводит к
тому, что уже во время первого прохождения
через печень, после приема внутрь,
разрушается 70-80% принятой дозы. Кроме
того, период полуэлиминации бромокриптина
всего 2-4 часа, что требует его достаточно
частого (3 раза) применения в течение
суток.
ФЭ:
-
Противопаркинсонический эффект. Бромокриптин активирует D2-рецепторы нейронов хвостатого ядра и воспроизводит тем самым тормозящий эффект, который оказывают нейроны черной субстанции или леводопа на хвостатое ядро. Торможение хвостатого ядра приводит к активации нейронов бледного шара и усилению его нисходящих тормозных влияний на -мотонейроны спинного мозга. В итоге, бромокриптин снижает брадикинезию и ригидность.
-
Эндокринологические эффекты. Бромокриптин вызывает угнетение секреции пролактина. Этот эффект связан с влиянием на рецепторы гипофиза. В настоящее время полагают, что гипоталамический гормон пролактостатин является ни чем иным, как дофамином. Бромокриптин, стимулируя D2-дофаминовые рецепторы гипофиза, тормозит образование и секрецию пролактина. Кроме того, показано, что бромокриптин (как и другие дофаминомиметики) нормализует уровень гормона роста: снижает патологически повышенную его секрецию и несколько повышает нормальную секрецию СТГ.
Показания к применению:
-
Лечение гиперпролактинемии и связанных с ней нарушений менструального цикла, женского и мужского бесплодия, лечение пролактином (гормонпродуцирующих опухолей гипофиза, выделяющих пролактин). Бромокриптин назначают в дозе 7,5-20 мг/сут.
-
Подавление лактации в послеродовом периоде (т.к. синтез и секреция молока определяются уровнем пролактина). Используют бромокриптин в дозах 7,5-15 мг/сут.
-
Лечение акромегалии (обусловленой гормонпродуцирующими опухолями гипофиза). Эффективные дозы составляют 1,25-5,0 мг/сут.
-
Лечение диффузной формы кистозно-фиброзной мастопатии. Показано, что бромокриптин снижает число кист и узлов в тканях молочной железы, полагают, что это связано с нормализацией секреции пролактина и соотношения эстрогенов и прогестерона. Эффективные дозы составляют 5,0-10,0 мг/сут.
-
Лечение паркинсонизма. Используют дозы 10-40 мг/сут.
Режим дозирования: Во всех случаях подбор оптимальной дозы бромокриптина проводят по следующей схеме. В 1-ую неделю его принимают внутрь по 1,25 мг на ночь, в течение второй недели – по 2,5 мг на ночь, с 3-ей недели – по 2,5 мг 2 раза в день и с 4-ой недели – по 2,5 мг 3 раза в день (что соответствует 7,5 мг/сут). При необходимости дальнейшего увеличения его проводят каждые 3 дня повышая дозу на 2,5 мг.
НЭ:
-
Со стороны ЖКТ отмечаются эффекты характерные для леводопы и других дофаминомиметиков – анорексия, тошнота и рвота.
-
Ортостатический коллапс при первых приемах.
-
Эритромелалгия – болезненный спазм сосудов пальцев рук, который сменяется их внезапным расширением с гиперемией, отеком и жжением. Провоцирующим фактором является контакт с водой.
-
Эрготизм – сочетание спазмов сосудов конечностей, внутренних органов с изменениями психики в виде галлюцинаций и бреда.
ФВ: таблетки по 0,0025; 0,004 и 0,01; капсулы по 0,004 и 0,01; раствор для приема внутрь 4 мг/5 мл (0,08%) во флак. по 100 мл
П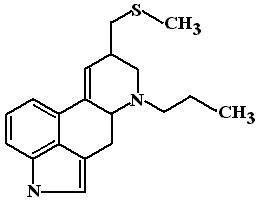 ерголид
(Pergolide, Permax).
Механизм
действия: Перголид является полным
агонистом постсинаптических D2-рецепторов
и парциальным агонистом пресинаптических
D1-рецепторов.
По активности в отношении D2-рецепторов
в 10 раз превосходит бромокриптин. За
счет активации постсинаптических
D2-рецепторов
воспроизводит тормозящие эффекты
дофамина в экстрапирамидной системе.
Действуя на пресинаптические D1-рецепторы,
которые расположены на возбуждающих
терминалях корковых глутаматергических
нейронов, тормозит выделение глютамата
и чрезмерную стимуляцию нейронов
хвостатого ядра
ерголид
(Pergolide, Permax).
Механизм
действия: Перголид является полным
агонистом постсинаптических D2-рецепторов
и парциальным агонистом пресинаптических
D1-рецепторов.
По активности в отношении D2-рецепторов
в 10 раз превосходит бромокриптин. За
счет активации постсинаптических
D2-рецепторов
воспроизводит тормозящие эффекты
дофамина в экстрапирамидной системе.
Действуя на пресинаптические D1-рецепторы,
которые расположены на возбуждающих
терминалях корковых глутаматергических
нейронов, тормозит выделение глютамата
и чрезмерную стимуляцию нейронов
хвостатого ядра
В отличие от бромокриптина перголид не подвержен пресистемной элиминации, имеет более длительный период полувыведения (около 27 часов), что позволяет назначать его 1 раз в день. Кроме того, он более доступен по цене, что немаловажно, если учитывать чрезвычайно высокую стоимость терапии бромокриптином.
ФЭ: Для перголида характерны те же эффекты, что и для бромокриптина.
Показания для применения и режим дозирования. В настоящее время одобрено применение перголида только для лечения паркинсонизма. Прием перголида начинают с 0,05 мг на ночь в течение 2 дней, затем дозу повышают на 0,1 мг каждые 3 дня. Как правило, эффективными являются дозы 0,4-0,5 мг/сут, однако, при необходимости можно увеличивать их до 3-5 мг/сут. При плохой переносимости можно принимать перголид в 2-3 приема.
НЭ: Перголид лучше переносится, чем бромокриптин и реже вызывает ортостатический коллапс и рвоту. При длительном применении перголида возможно появление плеврального или перикардиального выпота, фиброза плевральной полости или забрюшинного пространства. Возможно развитие психотических реакций.
ФВ: таблетки по 0,00005; 0,00025 и 0,001
Амантадин (Amantadine, Midantan). Первоначально был создан как противовирусное средство из группы адамантановых производных. Его противопаркинсоническая активность была обнаружена случайно.
М Д:
До конца механизм действия амантадина
неясен. Полагают, что в реализации его
активности играют роль несколько
процессов:
Д:
До конца механизм действия амантадина
неясен. Полагают, что в реализации его
активности играют роль несколько
процессов:
-
Блокада NMDA-рецепторов на поверхности холинергических нейронов хвостатого ядра. В результате это блокады не происходит стимулирующего воздействия на эти клетки возбуждающих глутаматергических нейронов коры и активность холинергических нейронов понижается. При этом уменьшается активность связанных с ними ГАМК-ергических нейронов хвостатого ядра и они прекращают тормозить нейроны бледного шара. В итоге, ГАМК-ергические нейроны бледного шара снижают тонус -мотонейронов спинного мозга и тонус скелетных мышц.
-
Полагают, что амантадин может усиливать выделение дофамина в синаптическую щель из нейронов черной субстанции и тормозить его обратный нейрональный захват. В итоге, в области нейронов хвостатого ядра концентрация дофамина повышается и он оказывает тормозящее действие на холинергические нейроны, дополняя эффект амантадина, связанный с блокадой NMDA-рецепторов.
-
Амантадин обладает слабой М-холиноблокирующей активностью. Поэтому он блокирует М-холинорецепторы тормозных нейронов хвостатого ядра и препятствует их активации ацетилхолином, который выделяется возбуждающими холинергическими нейронами.
ФЭ: Амантадин оказывает противопаркинсоническое действие и уменьшает выраженность акинезии, ригидности и тремора в равной мере, хотя и с меньшей эффективностью, чем леводопа. По эффективности в 15-20 раз слабее леводопы. Чаще всего амантадин используют как вспомогательное средство при лечении леводопой (для усиления ее эффекта). Терапевтический эффект леводопы развивается через 3-5 дней регулярного приема, но, к сожалению, уже через несколько недель терапии он значительно ослабевает.
Благодаря противовирусному эффекту в отношении вируса гриппа типа А амантадин используют для лечения и профилактики гриппа.
Режим дозирования: Как противопаркинсоническое средство амантадин применяют по 100-200 мг 2 раза в день внутрь.
НЭ: Чаще всего наблюдаются изменения со стороны ЦНС в виде депрессии, бессонницы, психомоторного возбуждения, галлюцинаций. В высоких (более 200 мг/сут) дозах способен вызвать судороги.
При применении амантадина возможно развитие периферических отеков и livedo reticularis – зигзагообразной пигментации кожи в виде «стрел молний» (чаще всего возникает в области лодыжек). Как правило эти симптомы исчезают через 1 месяц после регулярного применения амантадина.
М-холиноблокирующее действие амантадина может приводить к появлению сухости во рту, глотке, запорам и задержке мочи (особенно у пожилых мужчин).
ФВ: таблетки по 0,1 и 0,2.
Т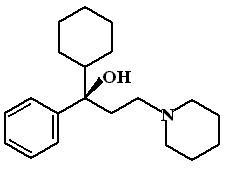 ригексифенидил
(Trihexyphenidyl,
Cyclodol
Romparkin).
МД: Блокирует М- и Н-холинергические
рецепторы, которые расположены на
тормозных нейронах хвостатого ядра. В
итоге, невозможна активация этих
рецепторов ацетилхолином, который
выделяется возбуждающими холинергическими
нейронами хвостатого ядра. Поскольку
тормозные нейроны хвостатого ядра
остаются неактивными, оно перестает
тормозить бледный шар и его активность
восстанавливается – он угнетает
-мотонейроны
спинного мозга и тонус мышц падает.
ригексифенидил
(Trihexyphenidyl,
Cyclodol
Romparkin).
МД: Блокирует М- и Н-холинергические
рецепторы, которые расположены на
тормозных нейронах хвостатого ядра. В
итоге, невозможна активация этих
рецепторов ацетилхолином, который
выделяется возбуждающими холинергическими
нейронами хвостатого ядра. Поскольку
тормозные нейроны хвостатого ядра
остаются неактивными, оно перестает
тормозить бледный шар и его активность
восстанавливается – он угнетает
-мотонейроны
спинного мозга и тонус мышц падает.
